−
Acid hydrochloric ®Æc lµ chÊt láng trong, kh«ng mµu, bèc khãi, cã tû
träng ë 20 oC kho¶ng 1,18, nång ®é HCl tõ 35 ®Õn 38% (kl/ kl) øng víi
nång ®é ®−¬ng l−îng kho¶ng 10 – 12 N.
−
Acid hydrochloric ®Æc dÔ bay h¬i, th−êng kh«ng ®¹t tiªu chuÈn chÊt
gèc, bëi vËy khi pha dung dÞch HCl 0,1 N tõ dung dÞch HCl ®Æc ta chØ
cã thÓ pha gÇn ®óng. Nång ®é dung dÞch HCl 0,1 N sau khi pha ®−îc
x¸c ®Þnh b»ng mét dung dÞch chuÈn kh¸c cã tÝnh base ®· biÕt nång ®é.
−
V× dung dÞch HCl ®Æc lµ chÊt láng, bèc khãi nªn ta tÝnh thÓ tÝnh dung
dÞch cÇn lÊy thay cho khèi l−îng. Gi¶ sö, ®Ó pha 100 mL dung dÞch
HCl cã nång ®é xÊp xØ 0,1N ta tÝnh nh− sau:
−
BiÕt ®−¬ng l−îng gam E cña HCl b»ng khèi l−îng ph©n tö cña nã vµ
b»ng 36,46.
−
Sè gam HCl nguyªn chÊt cã trong 100 mL dung dÞch HCl 0,1N lµ:
(g)0,3646
1000
10036,460,1
1000
VEN
m=
=
=
−
Do ®ã, thÓ tÝch dung dÞch HCl ®Æc cÇn lÊy lµ:
(ml)0,81100
381,18
0,3646
100
Cd
m
VHCldÆc ≈×
×
=×
×
=
TiÕn hµnh pha dung dÞch HCl 0,1N:
−
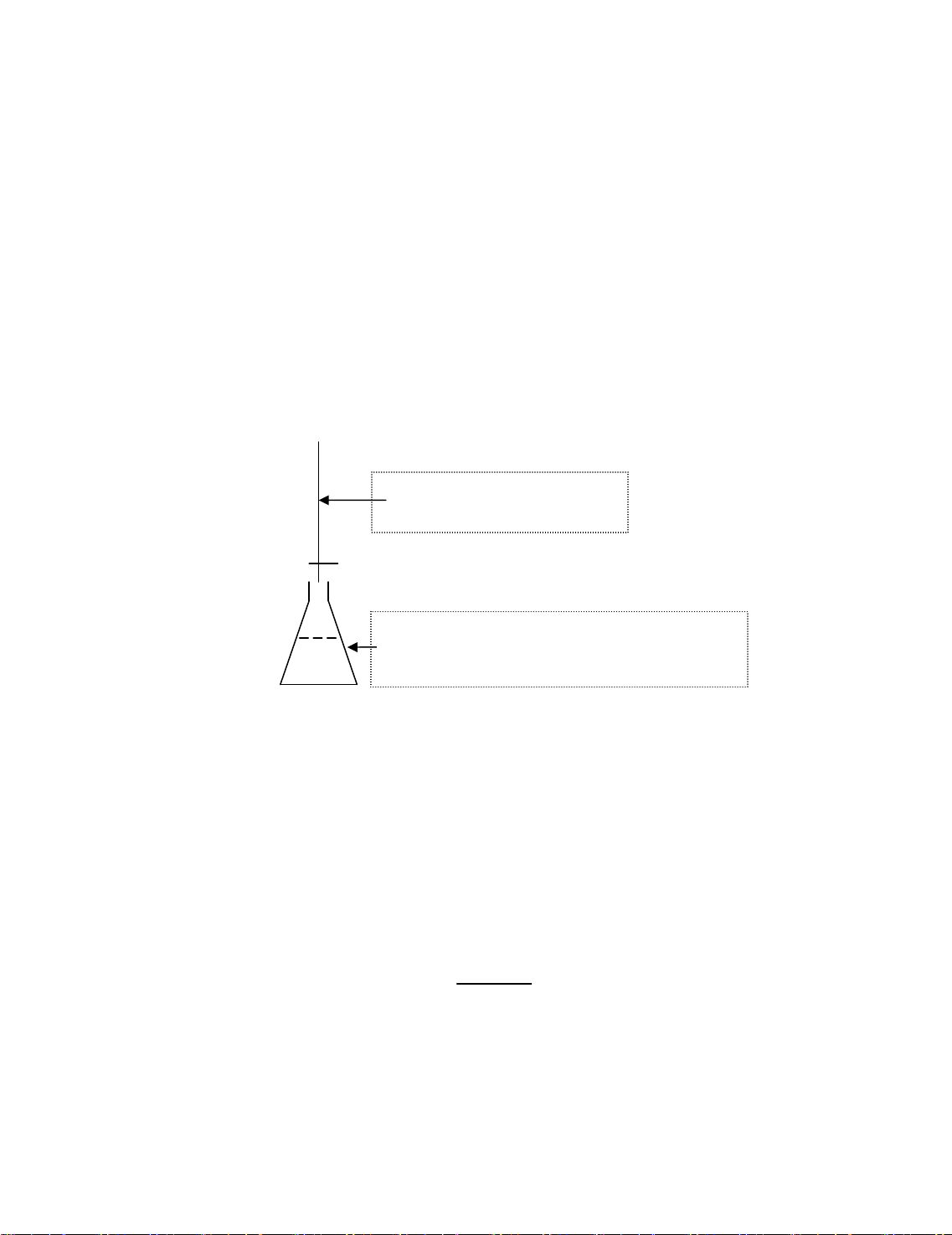
Cho vµo cèc ch©n kho¶ng 30 - 50 mL n−íc cÊt.
−
Dïng pipet chia v¹ch cho kho¶ng 0,8 mL dung dÞch HCl ®Æc (dïng
qu¶ bãp hoÆc ®Ó dung dÞch tù mao dÉn, tuyÖt ®èi kh«ng ®−îc hót) vµo
cèc ch©n trªn. Thao t¸c nµy ®−îc thùc hiÖn trong tñ hèt.
−
Dïng ®òa thñy tinh khuÊy ®Òu.
−
Thªm n−íc cÊt võa ®ñ 100 mL. KhuÊy ®Òu.
3. nguyªn t¾c ®Þnh l−îng acid hydrochloric
Acid hydrochloric lµ mét acid m¹nh, cã thÓ dïng chÊt gèc lµ natri
carbonat ®Ó x¸c ®Þnh nång ®é cña nã. §iÓm t−¬ng ®−¬ng ®−îc x¸c ®Þnh dùa
vµo sù chuyÓn mµu cña dung dÞch cã cho thªm chØ thÞ mµu thÝch hîp do cã
sù thay ®æi ®ét ngét pH cña dung dÞch.
Ph−¬ng tr×nh ph¶n øng ®Þnh l−îng:
Na2CO3 + HCl = NaHCO3 + NaCl (1)
NaHCO3 + HCl = H2O + CO2↑ + NaCl (2)
241