PH M CHÍNH TH CẠ Ứ
PH NG PHÁP DÙNG HOÁ CH T Đ PHÂN BI T CÁC CH T H U C VÀ VÔƯƠ Ấ Ể Ệ Ấ Ữ Ơ
CƠ
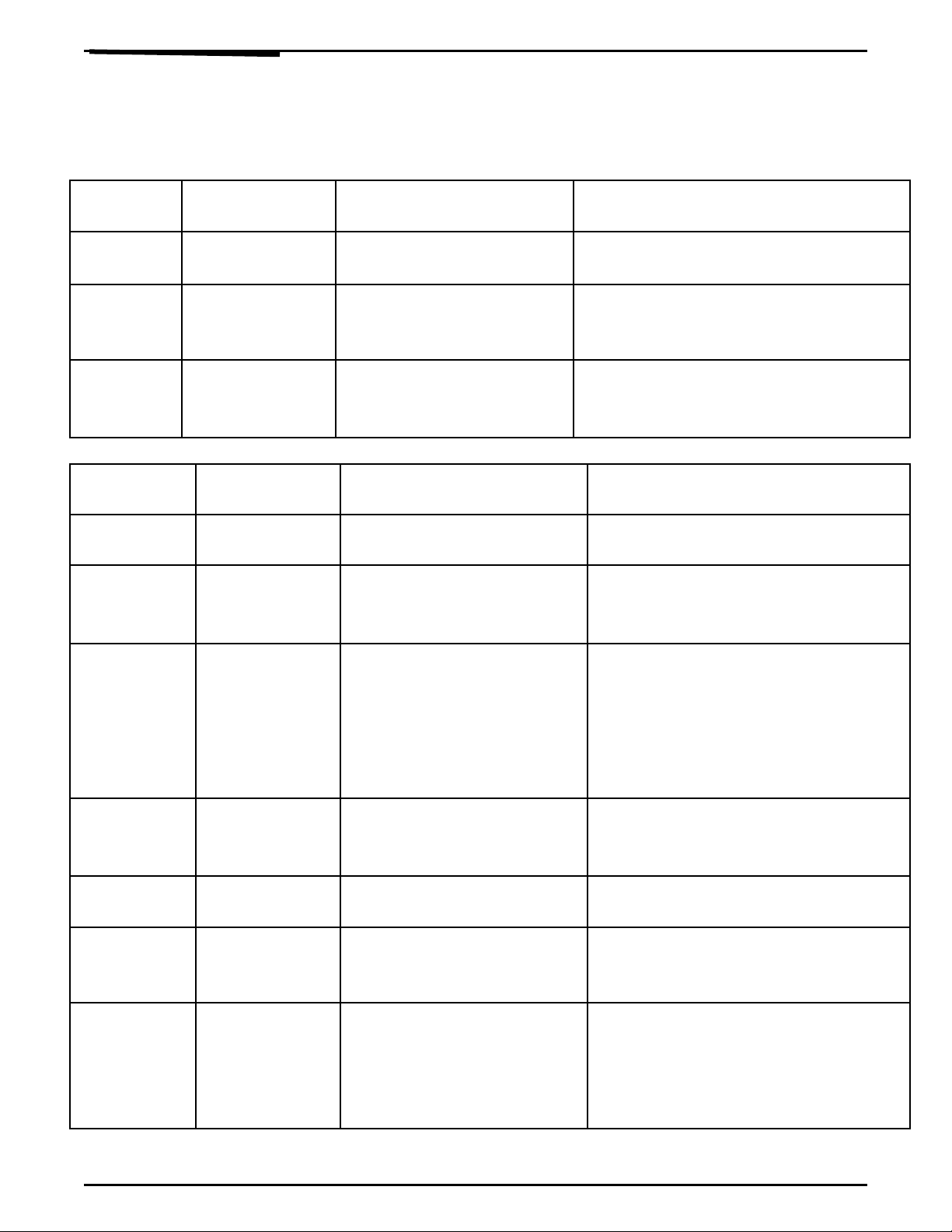
I) NH N BI T CÁC KHÍ H U C :Ậ Ế Ữ Ơ
Ch t c nấ ầ
nh nậLo i thu cạ ố
thửHi n t ngệ ượ Ph ng trình hoá h cươ ọ
Metan
(CH4 )
Khí Clo M t màu vàng l c c aấ ụ ủ
khí Clo CH4 + Cl2 CH3Cl + HCl
( vàng l c) ( không màu)ụ
Etilen
(C2H4 )
D.D Brom M t màu da cam c a d.dấ ủ
Br2
C2H4 + Br2 d.d C2H4Br2
Da cam không màu
Axetilen
(C2H2 )
Dd Br2 , sau đó
dd AgNO3 /
NH3
-M t màu vàng l cấ ụ
n c Brướ 2.
- Có k t t a màu vàngế ử
C2H2 + Br2 Ag – C = C – Ag +
H2O
( vàng )
II) NH N BI T CÁC CH T H U C :Ậ Ế Ấ Ữ Ơ
Ch t c nấ ầ
nh nậLo i thu cạ ố
thửHi n t ngệ ượ Ph ng trình hoá h cươ ọ
Benzen
(C6H6 )
- N c lãướ
- Kim lo i Naạ- Không tan.
- Không có hi n t ng.ệ ượ
R uượ
Etylic
(C2H5OH )
- Đ t cháy.ố
- Kim lo iạ
Na.
- Cháy không khói ( xanh
m )ờ
- Na tan, có H2 sinh ra. 2C2H5OH +2 Na 2C2H5ONa +
H2
Axit Axetic
( CH3COO
H )
- Na2CO3
- Kim lo i Znạ
- Có khí CO2 thoát ra.
- Có khí H2 thoát ra.
CH3COOH+Na2CO3
CH3COONa +
H2O +
CO2
CH3COOH+Zn (CH3COO)2Zn
+H2
Glucozơ
(C6H12O6)
- d.d AgNO3- Có Ag ( tráng g ng )ươ
C6H12O6 + Ag2O NH3C6H12O7 +
Ag
Saccarozơ
(C12H22O11)
- H2SO4 đ r iồ
vào AgNO3
- Có Ag ( tráng g ng )ươ
Tinh b tộ
( C6H10O5)
I t ( dd màuố
nâu)
- Có màu xanh xu t hi n.ấ ệ
Etyl Axetat
( Este)
- dd NaOH
loãng màu
h ngồ
( có hòa
Phenol)
M t màu h ngấ ồ
III) PHÂN BI T VÀ NH N BI T CÁC CH T L NG :Ệ Ậ Ế Ấ Ỏ
Giúp HS luy n t p nâng cao hoá h c vô cệ ậ ọ ơ Trang : 1
PH M CHÍNH TH CẠ Ứ
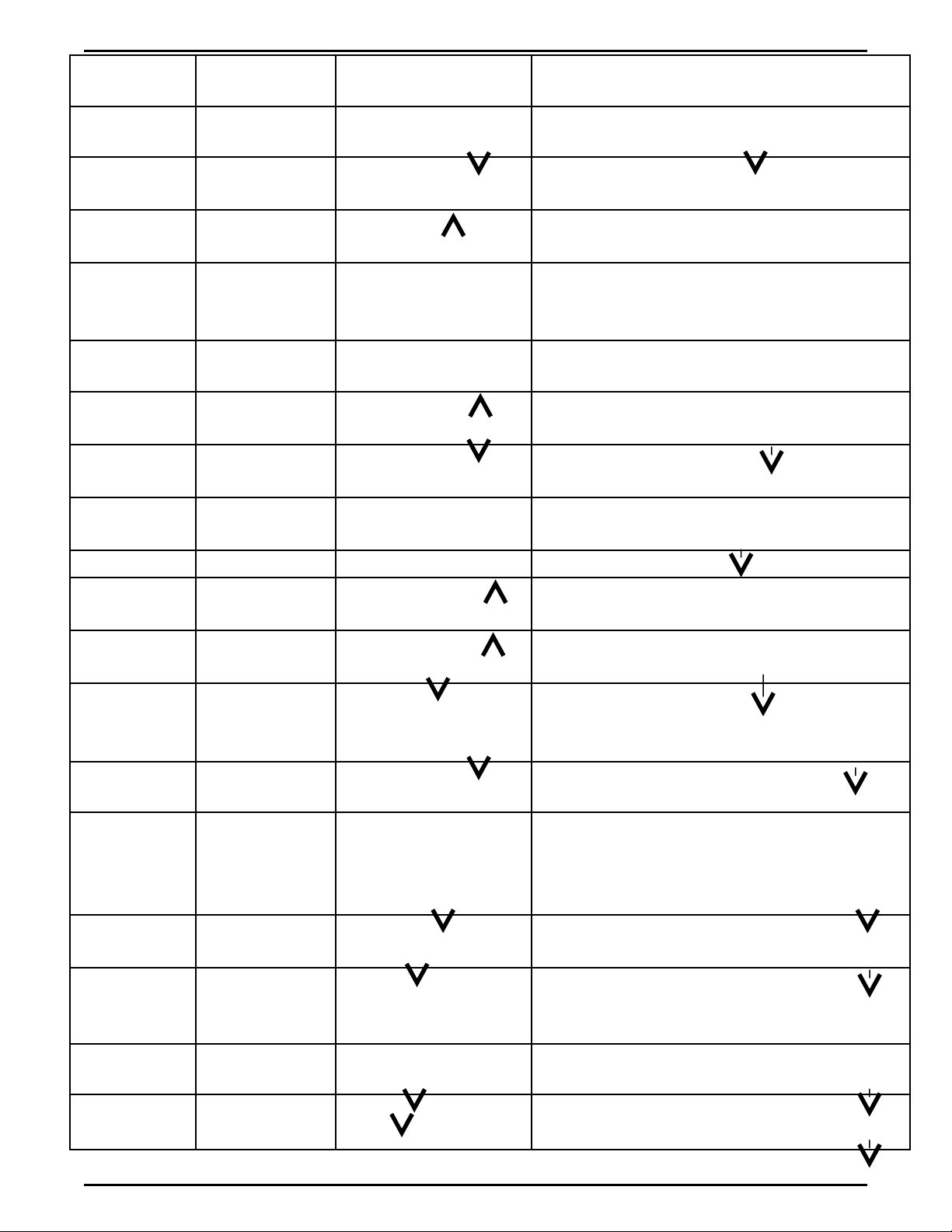
Ch t c nấ ầ
nh nậLo i thu cạ ố
thửHi n t ngệ ượ Ph ng trình hoá h cươ ọ
Axit Quỳ tím Chuy n thànhể
màu đ ỏ
H2SO4
loãng
BaCl2 ;
Ba(OH)2
Có k t t a tr ng ế ủ ắ H2SO4 + BaCl2 BaSO4 + 2 HCl
H2SO4 (Đ,
n)
Cu Có khí SO2 2H2SO4đ,n + Cu CuSO4 + 2H2O + SO2
HNO3 (đ ) Fe hay Mg Có khí màu nâu
NO2
6 HNO3 (đ ) + Fe Fe(NO3)3 +3 H2O +
3NO2
Baz kiơ ềm Quỳ tím Thành màu xanh
Baz ki mơ ề Nhôm Tan ra, có khí H2 Al + NaOH + H2O NaAlO2 + H2
Ca(OH)2CO2 ho cặ
SO2
Có k t t a tr ng ế ủ ắ Ca(OH)2 + CO2 CaCO3 + H2O
H2O Kim lo i Na,ạ
K
Có khí H2 2 H2O + 2 Na 2 NaOH + H2
Mu i : ClốAgNO3Có k t t a AgClế ủ AgNO3 + KCl AgCl + KNO3
Mu i : COố3HCl ho cặ
H2SO4
Tan ra, có khí CO2 2HCl + CaCO3 CaCl2 + H2O + CO2
Mu i : SOố3HCl ho cặ
H2SO4
Tan ra, có khí SO2 H2SO4 + Na2SO3 Na2SO4 + H2O + SO2
Mu i : POố4AgNO3 Có Ag3PO4 vàng 3AgNO3 + Na3PO4 Ag3PO4 + 3
NaNO3
Mu i : SOố4BaCl2 ;
Ba(OH)2
Có k t t a tr ng ế ủ ắ BaCl2 + Na2SO4 2NaCl + BaSO4
Mu i : NOố3H2SO4đ c +ặ
Cu
Có dd xanh + NO2
nâu H2SO4đ + Cu + NaNO3 Cu(NO3)2 +
Na2SO4
+ NO2 +
H2O
Mu i S tố ắ
( III
NaOH d.d Có Fe(OH)3 nâu
đỏ3 NaOH + FeCl3 3NaCl + Fe(OH)3
Mu i S tố ắ
( II )
NaOH d.d Fe(OH)2 tr ng sauằ
b hoá nâu đ ngoàiị ỏ
k. khí
2NaOH + FeCl2 2NaCl + Fe(OH)2
4 Fe(OH)2 + 2 H2O + O2 4 Fe(OH)3
Mu iố
Đ ngồD. d ch có màuị
xanh.
Mu iố
Nhôm
NaOH dưAl(OH)3 ;
sau đó tan ra . 3 NaOH + AlCl3 3 NaCl + Al(OH)3
Al(OH)3 + NaOH NaAlO2 + H2O
Giúp HS luy n t p nâng cao hoá h c vô cệ ậ ọ ơ Trang : 2
PH M CHÍNH TH CẠ Ứ
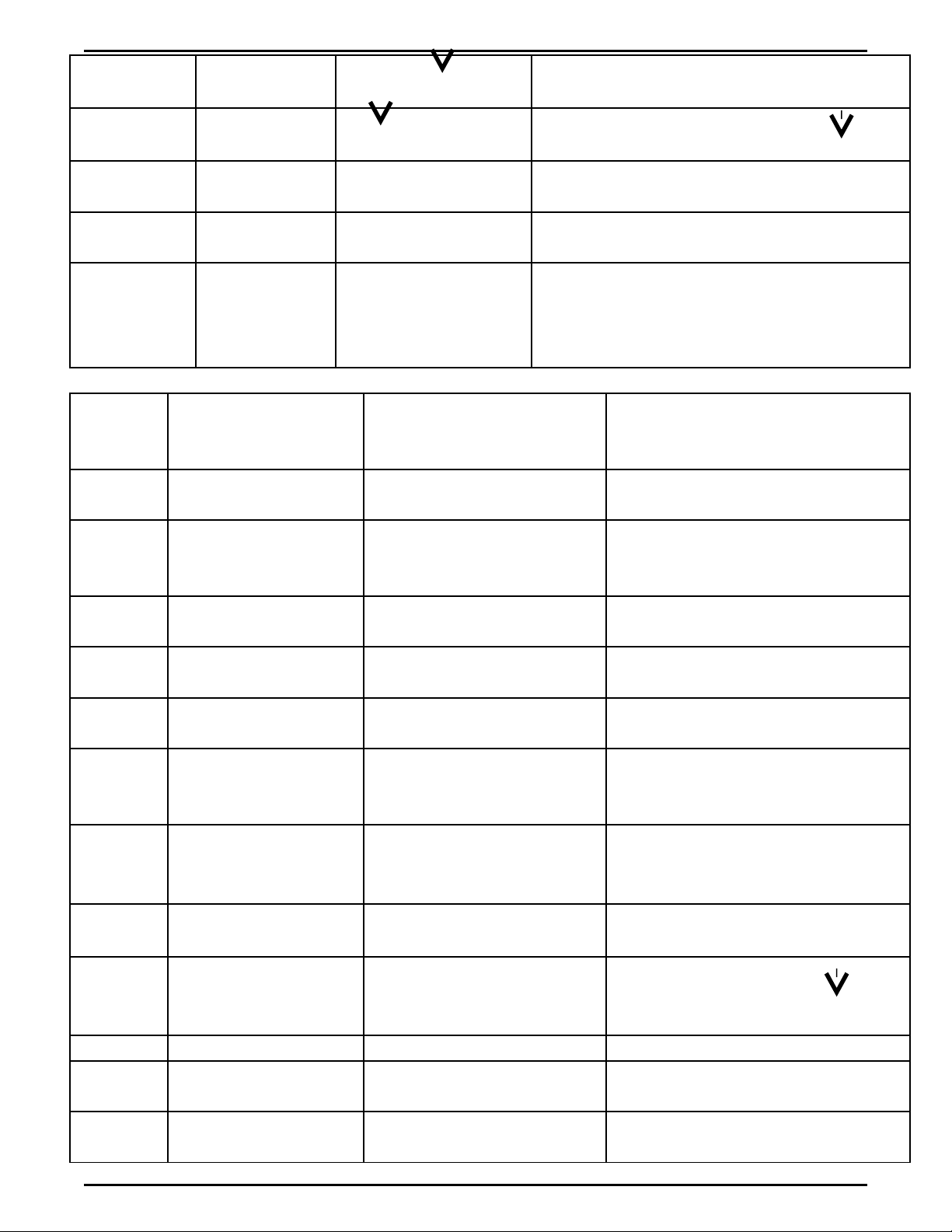
Mu i Canố
xi
Na2CO3 d.d Có CaCO3 Na2CO3 + CaCl2 2NaCl + CaCO3
Mu i ChìốNa2S d.d PbS màu đen Na2S + PbCl2 2 NaCl + PbS
Mu iố
amoni
Dd ki m, đunề
nhẹCó mùi khai NH3 ↑
Mu i silicatốAxits m nhạ
HCl, H2SO4
Có k t t a tr ngế ủ ắ
keo
d.d ch mu iị ố
Al, Cr (III)
Dung d chị
ki m, dề ư * K t t a keo tanế ủ
đ c trong ki mượ ề
d :ư
Al(OH)3 ↓ ( tr ng , Cr(OH)ắ3 ↓ (xanh
xám)
Al(OH)3 + NaOH
→
NaAlO2 +
2H2O
IV) NH N BI T CÁC CH T KHÍ :Ậ Ế Ấ
Ch tấ
c nầ
nh nậ
Lo i thu c thạ ố ử Hi n t ngệ ượ Ph ng trình hoá h cươ ọ
NH3Quỳ tím t ướ Đ i thành màu Xanhổ
Mùi khai
NO2- Màu ch t khíấ
- Gi y qùi tím mấ ẩ Màu nâu
Quì tím chuy n thànhể
đỏ
3 NO2 +H2O 2 HNO3 + NO
NO Dùng không khí
ho c Oxi đ tr nặ ể ộ T không màu, hoáừ
thành nâu 2 NO + O2 2 NO2
H2S Cu(NO3)2CuS màu đen
Khí có mùi tr ng th iứ ố H2S + CuCl2 CuS + HCl
O2Tàn đóm đỏBùng cháy sáng
CO2N c vôi trongướ
Ca(OH)2 ho c tànặ
đóm
N c vôi trong b đ cướ ị ụ
- Tàn đóm t t điắCO2 + Ca(OH)2 CaCO3 +
H2O
CO Đ t cháy, cho s nố ả
ph m qua n c vôiẩ ướ
trong
S n ph m làm n c vôiả ẩ ướ
trong b đ cị ụ 2CO + O2 2CO2
CO2 + Ca(OH)2 CaCO3 +
H2O
SO2N c vôi trongướ
Ca(OH)2
N c vôi trong b đ cướ ị ụ SO2 + Ca(OH)2 CaSO3 +
H2O
SO3Qùi tím mẩ
D.D BaCl
Quì tím hoá đỏ
N c vôi trong b đ cướ ị ụ SO3 + Ca(OH)2 CaSO4 +
H2O
Cl2Quì tìm mẩQuì tím m t màuấ
HCl Quì tìm mẩQuì tím hóa thành đỏ
H2Đ t: có ti ng nố ế ổ
nhỏS n ph m không đ cả ẩ ụ
n c vôi trongướ
Giúp HS luy n t p nâng cao hoá h c vô cệ ậ ọ ơ Trang : 3

PH M CHÍNH TH CẠ Ứ
Không
khí
Tàn đóm còn đỏTàn đóm v n bìnhẫ
th ngườ
V) NH N BI T CÁC KIM LO I :Ậ Ế Ạ
Ch tấ
c nầ
nh nậ
Lo i thu cạ ố
thửHi n t ngệ ượ Ph ng trình hoá h cươ ọ
Na ; K N c (Hướ 2O) Tan và có khí H24K + O2 2 K2O
Ca N c (Hướ 2O) Tan và có khí H2.
Dd làm n c vôi trongướ
đ cụ.
Al Dd Ki m :ề
NaOH
Ho c: HNOặ3
đ cặ
- Tan ra và có khí H2
- Không tan trong HNO3
đ cặ
2Al + 2NaOH + 2H2O 2 NaAlO2
+3H2
Zn Dd Ki m :ề
NaOH
Ho c: HNOặ3
đ cặ
- Tan ra và có khí H2
- Tan, có NO2 nâu
Mg ,Pb Axit HCl - Có H2 sinh ra.
Cu d.d AgNO3
dd HCl
- Tan ra; có ch t r nấ ắ
tr ng xám bám ngòai; ddắ
màu xanh.
Ag - HNO3
-R i vào d.dồ
NaCl
- Tan, có khí màu nâu NO2
- Có k t t a tr ngế ủ ắ
VI) NH N BI T CÁC PHI KIM :Ậ Ế
Ch t c nấ ầ
nh nậLo i thu c thạ ố ử Hi n t ngệ ượ Ph ng trình hoá h cươ ọ
I2(R nắ
-tím)
H tinh b tồ ộ Có màu xanh xu tấ
hi n.ệ
S
(R n -ắ
vàng)
Đ t trong Oố2 ho cặ
không khí
Có khí SO2 tr ng, mùiắ
h cắ
P
( R n -ắ
Đ )ỏ
- Đ t cháy r i choố ồ
SP vào n c, thướ ử
quì tím
S n ph m làm quì tímả ẩ
hóa đỏ
C
(R n -ắ
Đen )
Đôt cháy cho SP
vào n c vôi trongướ - N c vôi trong bướ ị
đ cụ
Giúp HS luy n t p nâng cao hoá h c vô cệ ậ ọ ơ Trang : 4

PH M CHÍNH TH CẠ Ứ
VII. Nh n bi t các oxitậ ế
Ch t c nấ ầ
nh nậThu c thố ử Hi n t ng và PTPệ ượ Ư
Na2O,K2O,
BaO - n cướ - dd trong su t, làm xanh quỳ tímố
Na2O + H2O NaOH
CaO - n cướ - dd đ c CaO + Hụ2O Ca(OH)2
Al2O3- dd ki m, dd axitề- Al2O3 + NaOH NaAlO2 + H2O
CuO - dd axit - dd màu xanh
Ag2O - dd HCl - k t t a tr ng:Agế ủ ắ 2O + HCl AgCl + H2O
MnO2- dd HCl nóng - khí màu vàng l c. MnOụ2 + HCl MnCl2 + Cl2 +
H2O
SiO2- dd ki mề- tan SiO2 + NaOH Na2SiO3 + H2O
P2O5- n c, quỳ tímướ - dd làm đ quỳ tímỏ
Bài t p:ậ
D ng 1: Đ c dùng thu c th t ch nạ ượ ố ử ự ọ
Câu 1.Nêu cách phân bi t CaO, Naệ2O, MgO, P2O5 đ u là ch t b t màu tr ngề ấ ộ ắ
Câu 2. Trình bày cách phân bi t 5 dd: HCl,NaOH, Naệ2SO4, NaCl, NaNO3
Câu 3. Phân bi t 3 lo i phân bón hóa h c: KCl, NHệ ạ ọ 4NO3, Ca3(PO4)2
Câu 4.Nêu các ph n ng phân bi t 5 dd: NaNOả ứ ệ 3, NaCl, Na2S, Na2SO4, Na2CO3
Câu 5. Có 8 dd ch a: CuSOứ4,FeSO4, MgSO4,Cu(NO3)2, Fe(NO3)2, Mg(NO3)2,Na2SO4,NaNO3.
Hãy ch n các thu c th và ti n hành phân bi t 8 dd nói trên.ọ ố ử ề ệ
Câu 6. Có 7 oxit d ng b t g m: Naở ạ ộ ồ 2O, MnO2, CuO, Ag2O,CaO, Al2O3,Fe2O3. b ng nh ngằ ữ
ph n ng nào có th phân bi t các ch t đóả ứ ể ệ ấ
Câu 7.Phân bi t 6 dd: Naệ2S,NaNO3, NaCl, Na2SO4, Na2CO3, NaHCO3
Câu 8. Nêu ph ng pháp hóa h c phân bi t các khí sau đ ng riêng bi t:ươ ọ ệ ự ệ
a. CH4,C2H4, H2, O2
b. CH4, C2H2, C2H4, CO2
c. NH3, H2S, HCl, SO2
d. Cl2,CO, CO2,SO2,SO3
Câu 9. B ng cách nh n ra s có m t c a các khí sau trong h n h p g m: CO,COằ ậ ự ặ ủ ỗ ợ ồ 2,SO2,SO3
Câu 10.Có 4 ch t l ng : r u etylic, axit axetic, phenol,benzen. Nêu ph ng pháp hóa h cấ ỏ ượ ươ ọ
phân bi t các ch t trên .ệ ấ
Câu 11. Có 5 ch t l ng: c n 90ấ ỏ ồ o, benzen, gi m ăn,dd glucozo,n c b t s n dây.làm th nàoấ ướ ộ ắ ế
phân bi t chúng.ệ
Câu 12.Có 5 ch t l ng: r u etylic, axit axetic, glucozo,benzen,etylaxetat. Hãy phân bi t 5ấ ỏ ượ ệ
ch t đó.ấ
Câu 13. Phân bi t 4 dd: r u etylic, tinh b t, glucozo,sacacrozoệ ượ ộ
Câu 14.Phân bi t 4 ch t l ng d u h a, d u l c, gi m ăn,lòng tr ng tr ng.ệ ấ ỏ ầ ỏ ầ ạ ấ ắ ứ
Gi iả
Câu 1. Hòa tan vào n c phân bi t đ c MgO không tan ướ ệ ượ
- Tan ít tao dd đ c là CaO: CaO + Hụ2O Ca(OH)2
Na2O + H2O NaOH
Giúp HS luy n t p nâng cao hoá h c vô cệ ậ ọ ơ Trang : 5


![Lý thuyết và bài tập Hóa học lớp 12 năm 2022 (KHXH) - Trường THPT Đào Sơn Tây [Tổng hợp]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230310/phuogchi205/135x160/2351678432530.jpg)

![Lý thuyết và bài tập Hóa học lớp 12 (KHTN) năm 2021 - Trường THPT Đào Sơn Tây [Đầy đủ]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230310/phuogchi205/135x160/491678432840.jpg)









![Truyện tranh Gấu Trúc Thích Vẽ [Mới Nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250726/TVSDLibK12/135x160/954_gau-truc-thich-ve.jpg)


![Truyện tranh Hươu cao cổ bị cận thị [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250725/TVSDLibK12/135x160/97_truyen-tranh-huou-cao-co-bi-can-thi.jpg)
![Vui học cùng bé: Tìm và nối chữ [Hướng dẫn chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250725/thuthao00/135x160/971_vui-hoc-cung-be-tim-va-noi-chu.jpg)



![Trò chơi săn chữ: Khám phá chữ cái [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250725/thuthao00/135x160/66711753416654.jpg)


![Tập viết các nét cơ bản [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250724/kimanh00/135x160/80_tap-viet-cac-net-co-ban.jpg)
