TÀI LI U HÓA H CỆ Ọ HÓA H U CƯ Ơ
A. NH N BI T CÁC CH T H U C (T ng quát)Ậ Ế Ấ Ữ Ơ ổ
Ch t mu nấ ố
nh n bi tậ ế Thu cố
thửHi n ệ
t ng ượ Ph n ngả ứ
H p ch t cóợ ấ
liên k t ếC = C
hay − C ≡ C −
dd Brom Phai màu
nâu đỏ
CH2 = CH2 + Br2 → BrCH2 – CH2Br
CH ≡ CH + 2Br2 → Br2CH – CHBr2
Phenol
dd Brom
K t ế
t a ủ
tr ngắ
Anilin
H p ch t cóợ ấ
liên k t ếC = C
dd
KMnO4
Phai
màu
tím
3CH2 = CH2 + 2KMnO4 + 4H2O
→ 3HOCH2−CH2OH + 2MnO2 + 2KOH
− C ≡ C −3CH≡CH+8KMnO4 → 3HOOC−COOH + 8MnO4↓+8KOH
Ankyl benzen
Ankin có liên
k t ba đ uế ầ
m chạ
dd
AgNO3
trong
NH4OH
(Ag2O)
K t t a ế ủ
vàng nh tạR−C≡C−H + Ag[(NH3)2]OH → R−C≡C−Ag↓ + H2O + 2NH3
H p ch t cóợ ấ
nhóm
– CH = O:
Andehit,
glucoz ,ơ
mantôz ơ
K t t a Agế ủ
(ph n ngả ứ
tráng b c) ạ
R − CH = O + 2Ag[(NH3)2]OH
→ R − COONH4 + 2Ag↓ + H2O + 3NH3↑
CH2OH−(CHOH)4−CHO + Ag2O
03
t ,ddNH
CH2OH−(CHOH)4−COOH + 2Ag↓
(Ph n ng này nh n bi t n c ti u b nh ti u đ ng có ch a glucoz )ả ứ ậ ế ướ ể ệ ể ườ ứ ơ
Axit fomic HCOOH+2Ag[(NH3)2]OH→(NH4)2CO3 + 2Ag↓ +H2O+2NH3
Hay: HCOOH + Ag2O
3
ddNH
CO2 + 2Ag↓ + H2O
Este formiat
H – COO – R HCOOR+2Ag[(NH3)2]OH→(NH4)2CO3 + 2Ag↓ +ROH+2NH3
H p ch t cóợ ấ
nhóm –CH= O
Cu(OH)2
↓ Cu2O đỏ
g chạR−CHO + 2Cu(OH)2
0
t
RCOOH + Cu2O↓ + 2H2O
Ancol đa ch cứ
(có ít nh t 2ấ
nhóm – OH
g n vào 2 Cắ
liên ti p)ế
T o ddạ
màu xanh
l trongơ
su tố
Anđehit dd
NaHSO3
b o hòaả
K t t aế ủ
d ng k tạ ế
tinh
R − CHO + NaHSO3 → R − CHOH − NaSO3↓
Metyl xêton
H p ch t có Hợ ấ
linh đ ng: ộaxit,
Ancol, phenol
Na, K S i b t khíủ ọ
không màu
2R − OH + 2Na → 2R − ONa + H2↑
2R − COOH + 2Na → 2R − COONa + H2↑
2C6H5 − OH + 2Na → 2C6H5 − ONa + H2
Trang 1
OH
2
+ 3Br
OH
Br Br
Br
+ 3HBr
(keát tuûa traéng)
2
NH
2
+ 3Br
Br Br
Br
+ 3HBr
(keát tuûa traéng)
2
NH
3
CH
2
0
H O
480-100 C
+ 2KMnO
COOK
2 2
+ 2MnO +KOH+H O
]
2 2
2 2
O
− −
− −
− −
2
CH OH HO CH
CH H + Cu(OH) + HO CH
CH OH HO CH
2 2
2
2 2
O
− −
− − − −
− −
CH OH HO CH
CH O CH + 2H O
CH OH HO CH
Cu
^

TÀI LI U HÓA H CỆ Ọ HÓA H U CƯ Ơ
B. NH N BI T CÁC CH T H U C (Chi ti t)Ậ Ế Ấ Ữ Ơ ế
Ch t ấThu cố
thửHi nệ
t ng ượ Ph n ngả ứ
Ankan Cl2/ás
S n ph mả ẩ
sau PƯ
làm h ngồ
gi y quỳấ
mẩ
CnH2n+2 + Cl2
as
CnH2n+1Cl + HCl
Anken
dd Br2M t màu ấCnH2n + Br2 → CnH2nBr2
dd KMnO4m t màu ấ3CnH2n + 2KMnO4 + 4H2O → 3CnH2n(OH)2 + 2MnO2 + 2KOH
Khí Oxi
Sp cho pứ
tráng
g ngươ 2CH2 = CH2 + O2
2 2
PdCl ,CuCl
CH3CHO
Ankađien dd Br2M t màuấCnH2n−2 + 2Br2 → CnH2nBr4
Ankin
dd Br2M t màu ấCnH2n−2 + 2Br2 → CnH2nBr4
dd KMnO4m t màu ấ3CH≡CH+8KMnO4 → 3HOOC−COOH + 8MnO4↓+8KOH
AgNO3/NH3
(có n i 3ố
đ u m ch)ầ ạ
k t t aế ủ
màu vàng
nh tạ
HC ≡ CH + 2[Ag(NH3)2]OH → Ag − C ≡ C − Ag↓ + 2H2O + 4NH3
R−C ≡ C−H + [Ag(NH3)2]OH → R−C ≡ C−Ag↓ + H2O + 2NH3
dd CuCl
trong NH3
k t t aế ủ
màu đỏCH ≡ CH + 2CuCl + 2NH3 → Cu − C ≡ C − Cu↓ + 2NH4Cl
R − C ≡ C − H + CuCl + NH3 → R − C ≡ C − Cu↓ + NH4Cl
Toluen dd KMnO4,
t0M t màuấ
Stiren dd KMnO4M t màuấ
Ancol Na, K ↑ không
màu 2R − OH + 2Na → 2R − ONa + H2↑
Ancol
b c Iậ
CuO (đen)
t0
Cu (đ ),ỏ
Sp cho pứ
tráng
g ngươ
R − CH2 − OH + CuO
0
t
R − CH = O + Cu + H2O
R − CH = O + 2Ag[(NH3)2]OH
→ R− COONH4 + 2Ag↓ + H2O + 3NH3
Ancol
b c IIậCuO (đen)
t0
Cu (đ ),ỏ
Sp không
p trángứ
g ngươ
R − CH2OH − R′ + CuO
0
t
R − CO − R′ + Cu + H2O
Ancol
đa ch cứCu(OH)2
dung d chị
màu xanh
lam
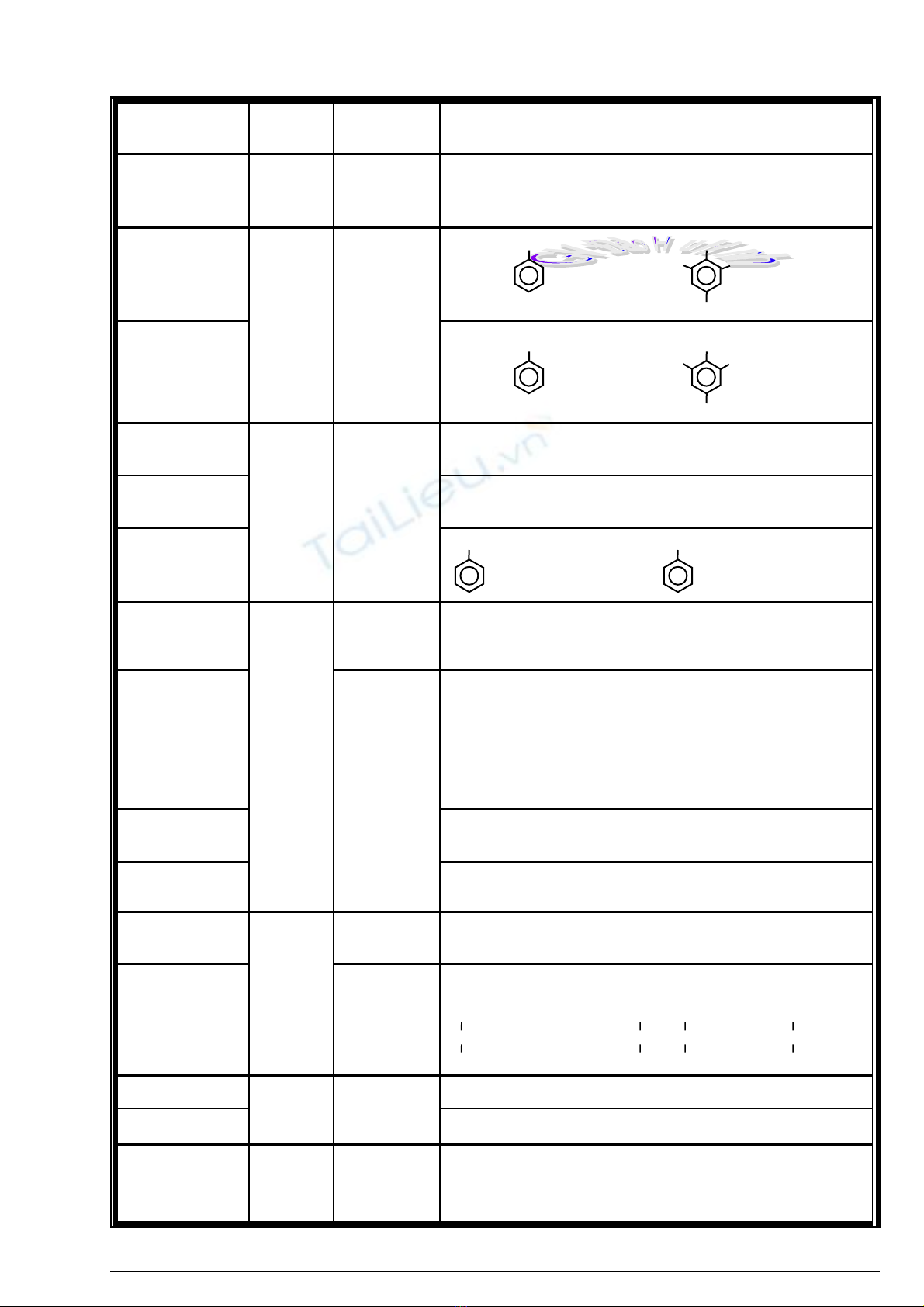
Anilin n c Bromướ T o k tạ ế
t a tr ngủ ắ
Anđehit
AgNO3
trong NH3↓ Ag tr ngắR − CH = O + 2Ag[(NH3)2]OH
→ R − COONH4 + 2Ag↓ + H2O + 3NH3↑
Cu(OH)2
NaOH, t0↓ đ g chỏ ạ RCHO + 2Cu(OH)2 + NaOH
0
t
RCOONa + Cu2O↓ + 3H2O
dd Brom M t màuấRCHO + Br2 + H2O → RCOOH + 2HBr
Andehit no hay ko no đ u làm m t màu n c ề ấ ướ Br2 vì đây là ph n ng oxi hóa kh . Mu nả ứ ử ố
phân bi t ệandehit no và không no dùng dd Br2 trong CCl4, môi tr ng ườ CCl4 thì Br2 không
th hi n tínhể ệ oxi hóa nên ch ph n ng v i ỉ ả ứ ớ andehit không no
Trang 2
3
CH
2
0
H O
480-100 C
+ 2KMnO
COOK
2 2
+ 2MnO +KOH+H O
2 2
+ 2MnO + 2H O
2
CH = CH
+
4 2
+ 2KMnO 4H O
2
CHOH = CH OH
]
2 2
2 2
O
− −
− −
− −
2
CH OH HO CH
CH H + Cu(OH) + HO CH
CH OH HO CH
2 2
2
2 2
O
− −
− − − −
− −
CH OH HO CH
CH O CH + 2H O
CH OH HO CH
Cu
^
2
NH
2
+ 3Br
Br Br
Br
+ 3HBr
(keát tuûa traéng)
2
NH
TÀI LI U HÓA H CỆ Ọ HÓA H U CƯ Ơ
Ch t ấThu cố
thửHi nệ
t ng ượ Ph n ngả ứ
Axit
cacboxylic
Quì tím Hóa đỏ
2
3
CO −
↑ CO22R − COOH + Na2CO3 → 2R − COONa + CO2↑ + H2O
Aminoaxi
t
Hóa xanh
Hóa đỏ
Không đ iổ
S nhóm ố− NH2 > s nhóm ố− COOH
S nhóm ố− NH2 < s nhóm ố− COOH
S nhóm ố− NH2 < s nhóm ố− COOH
2
3
CO −
↑ CO22H2N−R−COOH + Na2CO3 → 2H2N−R−COONa + CO2↑ + H2O
Amin Quì tím Hóa xanh
Glucozơ
Cu(OH)2
dd xanh
lam 2C6H12O6 + Cu(OH)2 → (C6H11O6)2Cu + 2H2O
Cu(OH)2
NaOH, t0↓ đ g chỏ ạ CH2OH − (CHOH)4 − CHO + 2Cu(OH)2 + NaOH
0
t
CH2OH − (CHOH)4 − COONa + Cu2O↓ + 3H2O
AgNO3 /
NH3↓ Ag tr ngắCH2OH − (CHOH)4 − CHO + 2Ag[(NH3)2]OH
→ CH2OH−(CHOH)4−COONH4 + 2Ag↓ + H2O + 3NH3↑
dd Br2M t màu ấCH2OH−(CHOH)4−CHO + Br2→ CH2OH−(CHOH)4−COOH+2HBr
Saccaroz
ơ
C12H22O11
Thu phânỷ
s n ph mả ẩ
tham gia
p trángứ
g ngươ
C12H22O11 + H2O → C6H12O6 + C6H12O6
Glucozơ Fructoz ơ
Vôi s aữV n đ cẩ ụ C12H22O11 + Ca(OH)2 → C12H22O11.CaO.2H2O
Cu(OH)2
dd xanh
lam C12H22O11 + Cu(OH)2 → (C12H22O11)2Cu + 2H2O
Mantozơ
C12H22O11
Cu(OH)2
dd xanh
lam C12H22O11 + Cu(OH)2 → (C12H22O11)2Cu + 2H2O
AgNO3 /
NH3↓ Ag tr ngắ
Thu phânỷ
s n ph mả ẩ
tham gia
p trángứ
g ngươ
C12H22O11 + H2O → 2C6H12O6 (Glucoz ) ơ
Tinh b tộ
(C6H10O5)n
Thu phânỷ
s n ph mả ẩ
tham gia
p trángứ
g ngươ
(C6H10O11)n + nH2O → nC6H12O6 (Glucoz ) ơ
dd ch iotịT o dung d ch màu xanh tím, khi đun nóng màu xanh tím bi n m t, khi đạ ị ế ấ ể
nguôi màu xanh tím l i xu t hi n ạ ấ ệ
Cách nhận biết 1 số hợp chất hữu cơ:
(tổng hợp từ "Bài tập lý thuyết và thực nghiệm Hóa học tập II - Cao Cự Giác)
1. Hidrocacbon no (ankan, xicloankan):
* Có thể nhận biết ankan và xicloankan (n>=5) bằng tính trơ hóa học với hầu hết các thuốc thử thông thường như không
làm mất màu dd nước Br2, KMnO4... và cũng không tan trong axit H2SO4
*Các xicloankan (n>=4) tan trong H2SO4 đặc, làm mất màu Br2 trong CCl4 nhưng không làm mất màu dd KMnO4
Các hidrocacbon có 1-4 nguyên tử C tồn tại ở thể khí
2. Hidrocacbon không no (anken, ankadien, ankin):
*Tan trong H2SO4 đặc
* Nhận biết tính không no: làm mất màu dd Br2 (nâu đỏ), dd KMnO4 (tím) do phản ứng cộng và phản ứng oxi hóa không
Trang 3

TÀI LI U HÓA H CỆ Ọ HÓA H U CƯ Ơ
hoàn toàn
*Nhận biết ank-1-in: tạo kết tủa màu vàng với dd AgNO3/NH3, tạo kết tủa màu đỏ với dd CuCl/NH3
*Xác định cấu tạo của anken bằng phản ứng ozon phân hoặc oxi hóa bằng KMnO4/H+. Dựa vào cấu tạo của các chất sản
phẩm suy ra cấu tạo của anken
*Phân biệt hidrocacbon chứa nối đôi C=C và chứa nối ba C C≡ bằng phản ứng cộng nước (H+). Nếu tạo rarượu đó là
hidrocacbon chứa nối đôi. Nếu tạo andehit/xeton là hidrocacbon chứanối ba
3. Aren (benzen và các chất đồng đẳng):
*Nhận biết benzen: chất lỏng không màu, không tan trong nước (nhẹ nổi lên trên), có mùi thơm đặc trưng, không làm mất
màu dd Br2 và KMnO4
*Nhận biết đồng đẳng benzen: không làm mất màu dd Br2, không tan trong nước, làm nhạt màu dd KMnO4 khi đun
nóng (do phản ứng ở C mạch nhánh)
*Có thể phân biệt aren với anken và xicloankan bằng H2SO4 đặc (aren tan được)
4. Dẫn xuất halogen:
*Nhận biết sự có mặt của halogen: Dùng giấy lọc tẩm rượu, cho thêm vài giọt hóa chất cần nhận biết (chất lỏng hoặc dung
dịch trong rượu) rồi đốt và hứng sản phẩm cháy vào một phễu thủy tinh có phủ lớp dd AgNo3 và úp ngược. Nếu hóa chất
nhận biết là dẫn xuất halogen sẽ tạokết tủa trắng hoặc vàng ở thành phễu (bạc halogenua). Kết tủa này tan nếu cho thêm
amoniac.
*Phân biệt các loại dẫn xuất halogen: dùng dung dịch AgNO3 trong rượu cho trực tiếp vào dẫn xuất halogen cần nhận biết.
Tùy theo bậc của dẫn xuất halogen (độ linh động của nguyên tử halogen) mà phản ứng tạo thành bạc halogenua có thể xảy
ra nhanh hay chậm hoặc không xảy ra. Ví dụ:
+Alyl, benzylhalogenua: tạo kết tủa rất nhanh ở nhiệt độ phòng
+Dẫn xuất halogen bậc 3: tạo kết tủa nhanh ở nhiệt độ phòng:
+Dẫn xuất halogen bậc 2: tạo kết tủa ngay khi đun nóng:
+Dẫn xuất halogen bậc 1: tạo kết tủa khi đun lâu hơn
+Dẫn xuất vinyl và phenylhalogenua: không tạo kết tủa
*Có thể phân biệt các dẫn xuất halogen dựa vào phản ứng thủy phân sau đó tùy theo đặc điểm của sản phẩm thủy phân sẽ
có thể suy ra cấu tạo của dẫn xuất halogen ban đầu.
5. Rượu (ancol và poliancol):
*Rượu nguyên chất: cho Na vào có hiện tượng tan và sủi bọt khí không màu
*Dung dịch rượu: cho axit axetic vào và đun nóng trong H2SO4 đặc có mùi thơm của este tạo thành.
*Phân biệt bậc của rượu bằng thuốc thử Lucas (hỗn hợp HCl đặc và ZnCl2 khan):
+ Rượu bậc 3: phản ứng ngay tức khắc, tạo dẫn xuất halogen làm vẩn đục dung dịch
+Rượu bậc 2: tạo ra sản phẩm sau vài phút (dung dịch phân lớp)
+ Rượu bậc 1: không phản ứng
*Có thể phân biệt bậc của rượu bằng cách oxi hóa rượu trong ống đựng CuO đun nóng sau đó nghiên cứu sản phẩm.
+ Nếu sản phẩm tạo ra là andehit: rượu ban đầu là bậc 1
+ Nếu sản phẩm tạo ra là xeton: rượu bậc 2.
+ Nếu rượu không bị oxi hóa: rượu bậc 3.
*Rượu đa chức có ít nhất 2 nhóm chức OH ở 2 nguyên tử C cạnh nhau có thể hòa tan Cu(OH)2 tạo dd màu xanh lam
trong suốt.
6. Phenol:
*Phenol có thể được phát hiện bằng phản ứng với dung dịch NaOH, khi đó phenol (đục vì ít tan) chuyển thành muối
C6H5ONa (trong suốt và tan). Khi thổi khí CO2 vào dung dịch trong suốt C6H5ONa lại thấy dung dịch trở nên vẩn đục vì tạo
ra C6H5ONa ban đầu (ít tan)
*Phenol phản ứng với dd Br2 tạo 2,3,6-tribromphenol kết tủa trắng
*Có thể phân biệt ancol và phenol với các hợp chất hữu cơ khác bằng phản ứng tạo phức chất có màu vớithuốc thử xeri
Trang 4
TÀI LI U HÓA H CỆ Ọ HÓA H U CƯ Ơ
amoninitratphức màu đỏ (NH4)2Ce(NO)6. Thuốc thử này có màu vàng nhạt, nếu nó cho là ancol, phức màu xanh-
nâu là phenol.
*Nhận biết phenol bằng phản ứng với dung dịch FeCl3 tạo phức phenolat của sắt có màu tím:
6C6H5OH + FeCl3 ↔ [Fe(OC6H5)6]3- + 6H+ + 3Cl-
7. Amin:
*Nhận biết amin mạch hở: làm giấy quỳ tím hóa xanh
*Các amin khí có mùi khai, tạo khói trắng với HCl đặc
*Amin thơm phản ứng với dung dịch Br2 tạo kết tủa trắng như phenol nhưng nếu dùng dư Br2 thì tạo kết tủa vàng.
*Có thể nhận ra sự khác nhau giữa phenol và anilin là phenol tan trong kiềm, anilin tan trong axit.
*Phân biệt bậc của amin bằng cách cho amin phản ứng với NaNO2 và HCl ở nhiệt độ từ 0-5*C:
+ Amin bậc 3: không phản ứng
+ Amin bậc 2: tạo ra hợp chất N-nitrozo (chất lỏng màu vàng ít tan trong nước)
R-NH-R' + NaNO2 + HCl → RR'-N-N=O + NaCl + H2O
+ Amin bậc 1: tạo muối diazoni
RNH2 + NaNO2 + 2HCl ~~~> R-N=NCl + NaCl + 2H2O
+ Nếu là amin no bậc 1 thì muối diazoni sẽ phân hủy ngay, giải phóng khí N2 và tạo ra rượu:
RN2Cl + H2O → ROH + N2 + HCl
+ Nếu là amin thơm bậc 1 thì muối diazoni bền ở 0-5*C có thể tiến hành phản ứng ghép đôi với beta-naphtol tạo sản phẩm
màu
Muốn phân hủy muối diazoni thơm phải đun nóng nhẹ, khi đó thu được phenol, N2
8. Andehit:
*Phản ứng với thuốc thử Tolen (AgNO3/NH3) tạo Ag kết tủa (phản ứng tráng gương)
*Phản ứng với thuốc thử Sip (dung dịch axit fucsinssunfuro không màu) cho màu hồng
*Phản ứng với thuốc thử Felinh (phức của Cu2+ với ion tactrat), thuốc thử Benedic (phức của Cu2+ với ion xitrat)
hoặc Cu(OH)2/OH- đun nóng tạo kết tủa Cu2O màu đỏ gạch.
*Phản ứng với dung dịch NaHSO3 bão hòa tạo tinh thể kết tinh
*Phản ứng với thuốc thử 2,4-dinitrophenylhidrazin (2,4-DNPH) tạo ra sản phẩm không tan có màu đỏ
*Phản ứng oxi hóa làm mất màu nước brom và dung dịch thuốc tím (tạo axit cacboxylic)
9. Xeton:
*Không có phản ứng tráng gương, không tạo kết tủa đỏ gạch với Cu(OH)2
*Phản ứng với thuốc thử 2,4-DNPH tạo sản phẩm không tan có màu đỏ
*Có thể nhận ra metylxeton R-CO-CH3 bằng phản ứng iodofom (tác dụng với I3 trong môi trường kiềm) tạo raCHI3 kết tủa
vàng
*Có thể nhận ra metylxeton bằng phản ứng với dung dịch NaHSO3 bão hòa tạo tinh thể kết tinh
10. Axit:
*Tác dụng với Na hoặc bột Fe tạo khí không màu
*Làm quỳ tím hóa đỏ
*Axit cacboxylic và phenol đều tan trong kiềm nhưng có thể phân biệt chúng bằng quỳ tím(phenol không đổi màu) hoặc cho
phản ứng với muối cacbonat (axit giải phóng khí CO2, phenol không phản ứng)
*Axit foocmic tham gia phản ứng tráng bạc, phản ứng với Cu(OH)2 tạo kết tủa Cu2O đỏ gạch
*Để phân biệt các dẫn xuất khác nhau của axit (clorua axit. anhidrit axit, este, amit) có thể dùng dung dịch AgNO3 (clorua
axit cho AgCl kết tủa trắng), dd NaOH:
+ clorua axit: cho phản ứng mạnh, tan ngay
+ anhidrit axit: tan ngay khi mới đun
+ este: chỉ tan khi đun sôi mà không giải phóng amoniac
+ amit: cũng tan khi đun sôi, đồng thời giải phóng khí NH3 làm quỳ hóa xanh
11. Este:
*Dùng phản ứng thủy phân và nhận biết sản phẩm taọ thành
*Phân biệt este và axit bằng phản ứng với kim loại
*Chỉ có axit, phenol, este phản ứng với kiềm tạo ra muối. Este phản ứng chậm và phải đun nóng
Trang 5


![Tổng hợp cấu trúc lai giáp cạnh 5H-thiazolo[2′,3′:2,3]imidazo[4,5-b]indole bằng phản ứng ghép cặp C-N liên tiếp xúc tác đồng](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250330/vimitsuki/135x160/2451743340007.jpg)









![Đề thi kết thúc học phần Nguyên lí Hóa học 2 [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251014/anhinhduyet000/135x160/69761760428591.jpg)













