TS Hoaøng Ñoâng Nam – Chöông 2
1
CHÖÔNG 2
CAÁU TAÏO NGUYEÂN TÖÛ
I . CAÁU TAÏO NGUYEÂN TÖÛ
I . 1 Nguyeân töû :
Nguyeân töû laø tieåu phaàn nhoû nhaát cuûa moät nguyeân toá hoùa hoïc , khoâng theå chia nhoû hôn
ñöôïc nöõa veà maët hoùa hoïc vaø khoâng bò thay ñoåi trong caùc phaûn öùng hoùa hoïc.
Nhö vaäy, moãi nguyeân toá hoùa hoïc ñöôïc caáu taïo töø moät loaïi nguyeân töû.
I . 2 Caáu taïo nguyeân töû :
Nguyeân töû coù hai phaàn : moät haït nhaân tích ñieän döông vaø moät lôùp voû electron tích
ñieän aâm.
Haït nhaân chöùa caùc haït proton mang ñieän tích döông vaø caùc haït neutron khoâng mang
ñieän. Lôùp voû electron goàm caùc electron mang ñieän tích aâm. Proton vaø electron coù
cuøng giaù trò ñieän tích nhöng traùi daáu.
Nguyeân töû luoân trung hoaø ñieän, nghóa laø noù coù soá proton baèng ñuùng soá electron.
Khoái löôïng cuûa proton xaáp xæ khoái löôïng cuûa neutron (mp = 1,6726.10-27kg , mn =
1,6749.10-27kg) vaø gaáp hôn 1800 laàn khoái löôïng cuûa electron (me = 9,1095.10-31kg), do
ñoù haàu nhö toaøn boä khoái löôïng cuûa nguyeân töû taäp trung trong haït nhaân.
Kích thöôùc cuûa haït nhaân raát nhoû so vôùi kích thöôùc cuûa nguyeân töû.
Moãi loaïi nguyeân töû coù moät soá löôïng proton xaùc ñònh , coøn soá löôïng neutron coù theå
thay ñoåi. Do ñieàu naøy moät nguyeân toá coù theå coù nhieàu ñoàng vò. Ví duï : oxy coù 3 ñoàng
vò 16O,
17O, 18O. Soá proton cuûa oxy baèng 8, soá neutron cuûa oxy thay ñoåi töø 8 trong 16O ñeán 10
trong 18O.
Trong caùc phaûn öùng hoaù hoïc haït nhaân khoâng thay ñoåi maø chæ coù söï thay ñoåi cuûa lôùp
voû electron, vì vaäy tính chaát hoùa hoïc cuûa caùc nguyeân toá phuï thuoäc vaøo caáu taïo cuûa lôùp
voû electron.
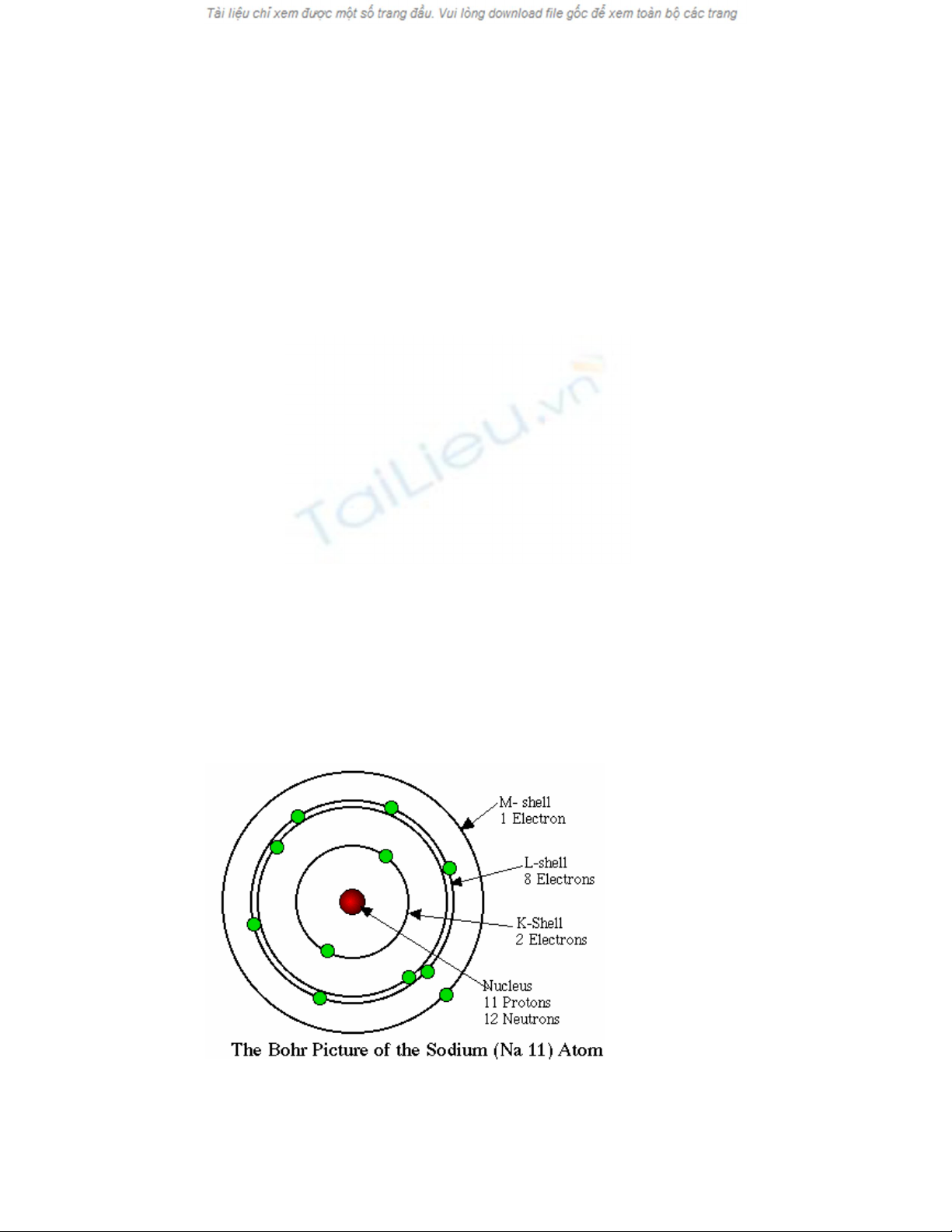
Hình 2.1 Sô ñoà nguyeân töû Na cuûa Bohr

TS Hoaøng Ñoâng Nam – Chöông 2
2
Baøi taäp:
Baøi 2-1. Ngöôøi ta döïa vaøo ñieàu naøo ñeå khaúng ñònh chaát thu ñöôïc laø moät nguyeân toá hoùa
hoïc môùi.
Baøi 2-2. Vì sao khi tính toaùn moät phaûn öùng oxy hoùa – khöû, ngöôøi ta khoâng quan taâm
ñeán söï thay ñoåi khoái löôïng cuûa chaát do söï chuyeån dòch electron?
Baøi 2-3. Vì sao nguyeân töû löôïng cuûa nguyeân toá thöôøng khoâng phaûi laø soá nguyeân.
Baøi 2-4. Trong phaûn öùng hoùa hoïc phaàn naøo cuûa nguyeân töû thay ñoåi? Phaàn naøo cuûa
nguyeân töû khoâng ñoåi?
II . CAÁU TAÏO LÔÙP VOÛ ELECTRON CUÛA NGUYEÂN TÖÛ.
Theo quan nieäm hieän ñaïi , electron vöøa coù tính chaát haït vöøa coù tính chaát soùng, do ñoù
khoâng theå xaùc ñònh chính xaùc ñoàng thôøi toác ñoä vaø vò trí cuûa electron . Ngöôøi ta chæ coù
theå tính toaùn ñöôïc khoaûng khoâng gian coù xaùc suaát cao tìm thaáy electron. Khoaûng khoâng
gian naøy ñöôïc goïi laø ñaùm maây electron.
Trong lôùp voû electron cuûa nguyeân töû caùc electron khoâng chuyeån ñoäng moät caùch tuøy
tieän maø tuaân theo moät söï saép xeáp nghieâm ngaët sao cho moãi electron coù moät traïng thaùi
rieâng bieät.Traïng thaùi cuûa electron trong nguyeân töû ñöôïc ñaëc tröng bôûi caùc giaù trò naêng
löôïng, kích thöôùc, hình daïng vaø söï ñònh höôùng trong khoâng gian cuûa ñaùm maây electron
vaø ñöôïc goïi laø orbital nguyeân töû. Traïng thaùi cuûa electron ñöôïc bieåu thò bôûi giaù trò cuûa
ba soá löôïng töû n , ℓ vaø mℓ.
Döôùi ñaây chuùng ta xem xeùt yù nghiaõ vaø caùc giaù trò ñònh löôïng cuûa ba soá löôïng töû naøy.
II . 1 Soá löôïng töû chính (n)
Naêng löôïng cuûa electron trong nguyeân töû bò löôïng töû hoùa vaø ñöôïc quy ñònh chuû yeáu
bôûi giaù trò cuûa soá löôïng töû chính (kyù hieäu baèng chöõ n). Soá löôïng töû chính coù theå nhaän
nhöõng giaù trò soá nguyeân döông : 1, 2 , 3 , 4 …. Electron ôû traïng thaùi n = 1 coù naêng
löôïng nhoû nhaát. Khi n taêng naêng löôïng cuûa electron taêng.
Soá löôïng töû chính quyeát ñònh caû kích thöôùc cuûa ñaùm maây electron. Ñaùm maây
electron ôû traïng thaùi n = 1 coù kích thöôùc nhoû nhaát. Giaù trò n taêng, kích thöôùc cuûa ñaùm
maây electron taêng..
Ngöôøi ta kyù hieäu caùc möùc löôïng töû cuûa electron theo caùc giaù trò cuûa n nhö sau :
Soá löôïng töû chính n : 1 2 3 4 5 6 7 …
Kyù hieäu caùc möùc löôïng töû : K L M N O P Q …
Caùc electron coù cuøng giaù trò n trong moät nguyeân töû hoïp thaønh moät lôùp löôïng töû
II .2 Soá löôïng töû orbital (ℓ)
Khoâng chæ naêng löôïng cuûa electron vaø kích thöôùc cuûa ñaùm maây electron chæ coù theå
nhaän nhöõng giaù trò xaùc ñònh maø hình daïng cuûa ñaùm maây electron cuõng khoâng theå tuøy
yù ñöôïc. Hình daïng cuûa ñaùm maây electron ñöôïc xaùc ñònh baèng soá löôïng töû orbital (kyù
hieäu baèng chöõ ℓ). Soá löôïng töû orbital cuõng coù nhöõng giaù trò nguyeân döông vaø bò raøng
buoäc bôûi giaù trò cuûa soá löôïng töû chính n theo bieåu thöùc :
ℓ = 0 , 1 , 2 , 3 … (n –1) (2.1)
Theo bieåu thöùc (2.1) , öùng vôùi moãi giaù trò cuûa n coù n giaù trò ℓ
Ví duï : n = 1 ℓ = 0
n = 2 ℓ1 = 0 vaø ℓ2 = 1
TS Hoaøng Ñoâng Nam – Chöông 2
3
n = 3 ℓ1 = 0 , ℓ2 = 1 vaø ℓ3 = 2
Ñoái vôùi caùc nguyeân töû coù nhieàu electron thì naêng löôïng cuûa caùc electron coù cuøng
traïng thaùi löôïng töû n coù söï khaùc nhau chuùt ít vaø ñöôïc ñaëc tröng baèng soá löôïng töû
orbital. Ví duï: Caùc electron ôû traïng thaùi löôïng töû n = 2 vaø ℓ = 0 coù naêng löôïng thaáp
hôn caùc electron ôû traïng thaùi löôïng töû n = 2 vaø ℓ = 1.
Caùc electron trong moät lôùp löôïng töû n coù cuøng giaù trò ℓ hoïp thaønh moät phaân lôùp löôïng
töû.
Caùc phaân lôùp löôïng töû ñöôïc kyù hieäu baèng caùc chöõ caùi thöôøng nhö sau:
Soá löôïng töû orbital ℓ: 0 1 2 3 4 5 …
Kyù hieäu cuûa phaân lôùp löôïng töû : s p d f g h …
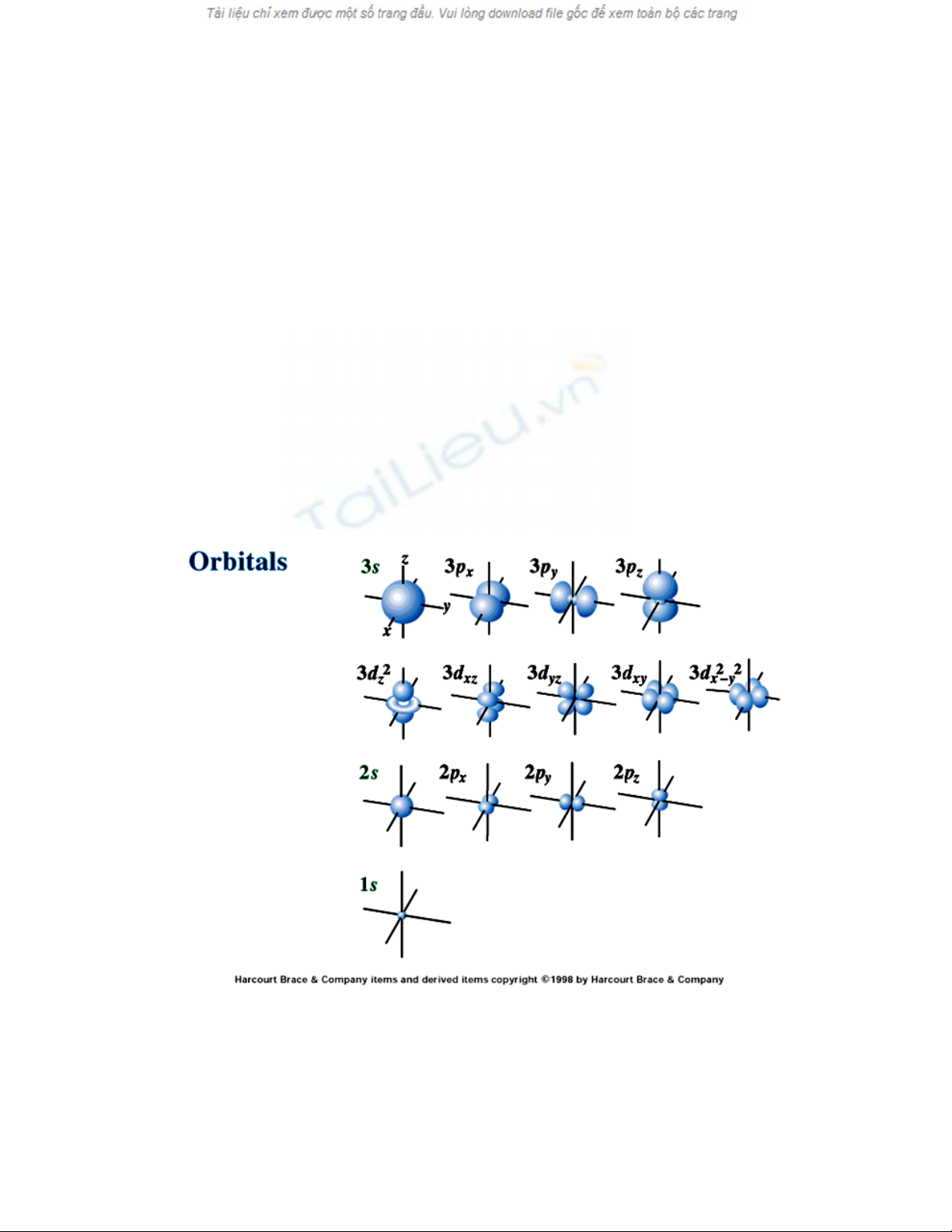
Caùc orbital s coù daïng khoái caàu. Caùc orbital p coù daïng hai khoái caàu tieáp xuùc nhau.
Caùc orbital d noùi chung coù daïng boán khoái caàu bieán daïng tieáp xuùc nhau (hình 2.2).
(Caùc orbital f coù daïng goàm moät soá khoái caàu coù kích thöôùc khaùc nhau tieáp xuùc nhau).
Caùc phaân lôùp löôïng töû trong nguyeân töû ñöôïc kyù hieäu baèng söï toå hôïp giaù trò cuûa soá
löôïng töû n vaø kyù hieäu cuûa soá löôïng töû ℓ.
Ví duï : 1s ( n = 1 , ℓ = 0 ); 2p ( n = 2 , ℓ = 1); 3d ( n = 3 , ℓ = 2 ).
Hình 2.2 Hình daïng moät soá loaïi orbital
II .3 Soá löôïng töû töø (mℓ)
Ngöôøi ta ñaõ tìm thaáy raèng moät phaân lôùp löôïng töû coù theå coù nhieàu orbital.
Caùc orbital trong cuøng moät phaân lôùp löôïng töû coù naêng löôïng vaø hình daùng gioáng nhau
nhöng coù söï ñònh höôùng khaùc nhau trong khoâng gian. Soá löôïng töû töø (kyù hieäu laø mℓ)
ñaëc tröng cho söï khaùc nhau naøy. Caùc giaù trò cuûa soá löôïng töû töø laø caùc soá nguyeân


























