S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
THÀNH PH ĐÀ N NGỐ Ẵ H NG D N CH M KÌ THI H C SINH GI I THÀNH PHƯỚ Ẫ Ấ Ọ Ỏ Ố
NĂM H C 2004 - 2005Ọ
MÔN: HÓA H C L P 11Ọ Ớ
Th i gian: 150 phút (không k th i gian giao đ )ờ ể ờ ề
Câu I M (3 đi m)ể
1. Hãy so sánh và gi i thích s khác nhau v đ phân c c phân t , nhi t đ sôi và đ m nhả ự ề ộ ự ử ệ ộ ộ ạ
tính baz gi a NHơ ữ 3 và NF3.
2. N2O4 phân li 20,0% thành NO2 27ởoC và 1,00 atm. Hãy xác đ nh (a) giá tr Kị ị p; (b) đ phân liộ
c a Nủ2O4 t i 27ạoC và 0,10 atm; (c) đ phân li c a 69g Nộ ủ 2O4 trong bình 20 L 27ởoC.
3. Tính pH c a dung d ch thu đ c khi th i h t 224 mL khí COủ ị ượ ổ ế 2 vào 200 mL dung d ch NaOHị
0,05M, bi t axit cacbonic có ế
35,6pK 1a =
,
33,10pK 2a =
.
ĐÁP ÁN ĐI MỂ
1. C u t o:ấ ạ
N
HH
H
N
FF
F
-NH3 phân c c h n NFự ơ 3 do trong NH3 l ng c c liên k t và l ng c cưỡ ự ế ưỡ ự
electron t do cùng chi u, còn trong NFự ề 3 l ng c c liên k t và l ng c cưỡ ự ế ưỡ ự
electron t do ng c chi u.ự ượ ề
-Nhi t đ sôi c a NHệ ộ ủ 3 cao h n do NHơ3 t o đ c liên k t H liên phân t .ạ ượ ế ử
-NH3 là m t baz còn NFộ ơ 3 thì không, do trong NF3 các nguyên t F hútử
electron làm gi m m t đ electron trên nguyên t N.ả ậ ộ ử
2. Xét ph n ng phân li:ả ứ
N2O4 2NO2
n 0
nα2nα
n-nα2nα
Ph n mol:ầ
α+
α−
1
1
α+
α
1
2
,
P
1
4
P
P
P
K2
2
ON
2
NO
ON
2
NO
P
42
2
42
2×
α−
α
=×
×
×
==
(a)
17,01
)2,0(1
)2,0(4
P
1
4
K2
2
2
2
P=×
−
×
=×
α−
α
=
(b)
%)6,54(546,017,010,0
1
4
2
2=α⇒=×
α−
α
(c)
mol75,0
92
69
n==
)1(9225,0
20
300082,0)1(75,0
P42ON α−=
××α−
=
α=
××α
=845,1
20
300082,0.75,0.2
P2
NO
17,0
)1(9225,0
)845,1(
K
2
P=
α−
α
=
⇒
%)27,19(1927,0=α
0,75
(0,25
×
3)
1,50
(0,50
×
3)
1
3.
01,005,02,0n,mol01,0
4,22
224,0
nNaOHCO2=×===
Vì s mol COố2 và NaOH b ng nhau nên h ch ch a NaHCOằ ệ ỉ ứ 3. Có th tính pHể
c a h l ng tính này b ng công th c:ủ ệ ưỡ ằ ứ
( )
3,833,1035,6
2
1
)pKpK(
2
1
pH 21 =+=+=
0,75
(0,25+0,5)
Câu II (3 đi m)ể
1. Vi t ph ng trình ph n ng x y ra khi cho NHế ươ ả ứ ả 4Cl tác d ng v i CuO và v i ZnO. Cho bi tụ ớ ớ ế
ng d ng th c t c a NHứ ụ ự ế ủ 4Cl t ng ng v i các ph n ng này. ươ ứ ớ ả ứ
2. Hòa tan 10,00 g h n h p g m Cuỗ ợ ồ 2S và CuS b ng 200,0 mL dung d ch MnOằ ị 4- 0,7500 M trong
môi tr ng axit. Sau khi đun sôi đ đu i h t khí SOườ ể ổ ế 2 sinh ra, l ng MnOượ 4- còn d trongư
dung d ch ph n ng v a h t v i 175,0 mL dung d ch Feị ả ứ ừ ế ớ ị 2+ 1,000 M.
(a) Vi t các ph ng trình ph n ng x y ra (d ng ph ng trình ion thu g n).ế ươ ả ứ ả ạ ươ ọ
(b) Tính ph n trăm kh i l ng CuS trong h n h p ban đ u.ầ ố ượ ỗ ợ ầ
ĐÁP ÁN ĐI MỂ
1. Trong th c t , NHự ế 4Cl đ c dùng đ đánh s ch b m t kim lo i tr c khi hàn:ượ ể ạ ề ặ ạ ướ
4CuO + 2NH4Cl → N2 + 3Cu + CuCl2 + 4H2O
ZnO + 2NH4Cl → ZnCl2 + 2NH3 + H2O
2. (a) Ph ng trình ph n ng:ươ ả ứ
5Cu2S + 8MnO4- + 44H+ → 10Cu2+ + 5SO2 + 8Mn2+ + 22H2O (1)
5CuS + 6MnO4- + 28H+ → 5Cu2+ + 5SO2 + 6Mn2+ + 14H2O (2)
5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O (3)
(b) Xác đ nh %ị
(1) ⇒
mol035,01175,0
5
1
n
5
1
n2
4Fe)3(MnO =××== +−
⇒
mol115,0035,075,02,0n )2,1(MnO4=−×=
−
Đ t s mol Cuặ ố 2S và CuS l n l t là x và y, ta có:ầ ượ
=
=
⇒
=+
=+
0625,0y
025,0x
115,0y
5
6
x
5
8
10y96x160
⇒
%60%100
10
960625,0
m% SCu =×
×
=
1,50
(0,50
×
3)
0,75
(0,25
×
3)
0,75
Câu III (4 đi m)ể
1. Ch dùng ch t ch th phenolphtalein, hãy phân bi t các dung d ch NaHSOỉ ấ ỉ ị ệ ị 4, Na2CO3, AlCl3,
Fe(NO3)3, NaCl, Ca(NO3)2. Các ph n ng minh h a vi t d i d ng ion thu g n.ả ứ ọ ế ướ ạ ọ
2. Hòa tan h t 2,2 g h n h p kim lo i A g m s t và nhôm trong 150 mL dung d ch HNOế ỗ ợ ạ ồ ắ ị 3 2M
thu đ c dung d ch B và 448 mL (đktc) khí C g m Nượ ị ồ 2O và N2 có t kh i so v i không khíỉ ố ớ
b ng 1,2414. Thêm 13,6 g NaOH nguyên ch t vào dung d ch B thu đ c k t t a D, l c k tằ ấ ị ượ ế ủ ọ ế
t a D thu đ c dung d ch n c l c E.ủ ượ ị ướ ọ
(a) Tính ph n trăm kh i l ng m i kim lo i trong h n h p A ban đ u.ầ ố ượ ỗ ạ ỗ ợ ầ
(b) Nung k t t a D đ n kh i l ng không đ i thì thu đ c bao nhiêu gam ch t r n khan?ế ủ ế ố ượ ổ ượ ấ ắ
(c) Tính th tích dung d ch HCl 0,5M c n thêm vào dung d ch E đ thu đ c 2,34 g k tể ị ầ ị ể ượ ế
t a.ủ
2

ĐÁP ÁN ĐI MỂ
1. Trích m u th cho m i l n thí nghi m:ẫ ử ỗ ầ ệ
Cho phenolphtalein vào m i m u th . M u th có màu h ng là dung d chỗ ẫ ử ẫ ử ồ ị
Na2CO3, các m u th còn l i không màu.ẫ ử ạ
CO32- + H2O HCO3- + OH-
Dùng Na2CO3 làm thu c th đ cho vào các m u th còn l i. ố ử ể ẫ ử ạ
M u th có s i b t khí không màu là NaHSOẫ ử ủ ọ 4
CO32- + 2H+ → H2O + CO2↑
M u th t o k t t a tr ng keo và s i b t khí không màu là AlClẫ ử ạ ế ủ ắ ủ ọ 3
2Al3+ + 3CO32- + 3H2O → 2Al(OH)3↓+ 3CO2↑
M u th t o k t t a đ nâu và s i b t khí không màu là Fe(NOẫ ử ạ ế ủ ỏ ủ ọ 3)3
2Fe3+ + 3CO32- + 3H2O → 2Fe(OH)3↓+ 3CO2↑
M u th t o k t t a tr ng là Ca(NOẫ ử ạ ế ủ ắ 3)2
Ca2+ + CO32- → CaCO3↓
M u th không t o hi n t ng là NaCl.ẫ ử ạ ệ ượ
2. (a) Đ t s mol Nặ ố 2O và N2 l n l t b ng a và b, ta có:ầ ượ ằ
==⇒
=×=
+
==+
01,0ba
36292414,1
02,0
b28a44
02,0
4,22
448,0
ba
Đ t s mol Fe và Al l n l t b ng x và yặ ố ầ ượ ằ
Ch t khấ ử Ch t oxi hóaấ
Fe - 3e → Fe3+ 10H+ + 2NO3- + 8e → N2O + 5H2O
3x x 0,10 0,08
Al - 3e → Al3+ 12H+ + 2NO3- + 10e → N2 + 6H2O
3y y 0,12 0,10
Vì
mol3,0)bd(nmol22,0)pu(n HH =<= ++
nên axit d , ph n ng không t oư ả ứ ạ
Fe2+.
Ta có:
=
=
⇒
=+
=+
04,0y
02,0x
18,0y3x3
2,2y27x56
V y ậ
%9,50%100
2,2
5602,0
m% Fe =×
×
=
và
%1,49m% Al =
(b) Thêm NaOH vào dung d ch B [Hị+ (0,15.2-0,22 = 0,08 mol), Fe3+ (x = 0,02
mol), Al3+ (y = 0,04 mol) và NO3-]
H+ + OH- → H2O (1)
Fe3+ + 3OH- → Fe(OH)3(2)
Al3+ + 3OH- → Al(OH)3(3)
Al(OH)3 + OH- → AlO2- + 2H2O (4)
mol34,0
40
6,13
nmol3,0n4n3nn )bd(OHAlFeH)4,3,2,1(OH 33 ==<=++= −+++−
⇒ sau (1), (2), (3), (4) v n còn d OHẫ ư -, k t t a D là Fe(OH)ế ủ 3 (0,02mol)
2Fe(OH)3 → Fe2O3 + 3H2O, ⇒ mr nắ =
g6,116001,0m 32OFe =×=
(c) Thêm HCl vào dung d ch E [Naị+, OH- (0,04 mol), AlO2- (0,04 mol) và NO3-]
OH- + H+ → H2O (5)
AlO2- + H+ + H2O → Al(OH)3(6)
Al(OH)3 + 3H+ → Al3+ + 3H2O (7)
1,50
(0,25
×
6)
1,00
0,50
3
mol03,0
78
34,2
n3
)OH(Al ==
Tr ng h p 1: X y ra (5), (6) và AlOườ ợ ả 2- dư
mol07,003,004,0nnn
3
)OH(Al
OHH
=+=+=
−+
, ⇒
L14,0
5,0
07,0
V==
Tr ng h p 2: X y ra (5), (6), (7)ườ ợ ả
mol01,003,004,0n )7()OH(Al 3=−=
mol11,003,004,004,0n3nnn )7()OH(Al
AlOOHH 3
2=++=++= −−+
⇒
L22,0
5,0
11,0
V==
1,00
(0,50
×
2)
Câu IV (3 đi m)ể
1. Tính hi u ng nhi t ph n ng hidro hóa etilen t o etan, bi t nhi t cháy c a Cệ ứ ệ ả ứ ạ ế ệ ủ 2H6 và C2H4
l n l t b ng -368,4 kcal/mol và -337,2 kcal/mol [s n ph m cháy là COầ ượ ằ ả ẩ 2 (k) và H2O (l)],
nhi t hình thành Hệ2O (l) là -68,32 kcal/mol.
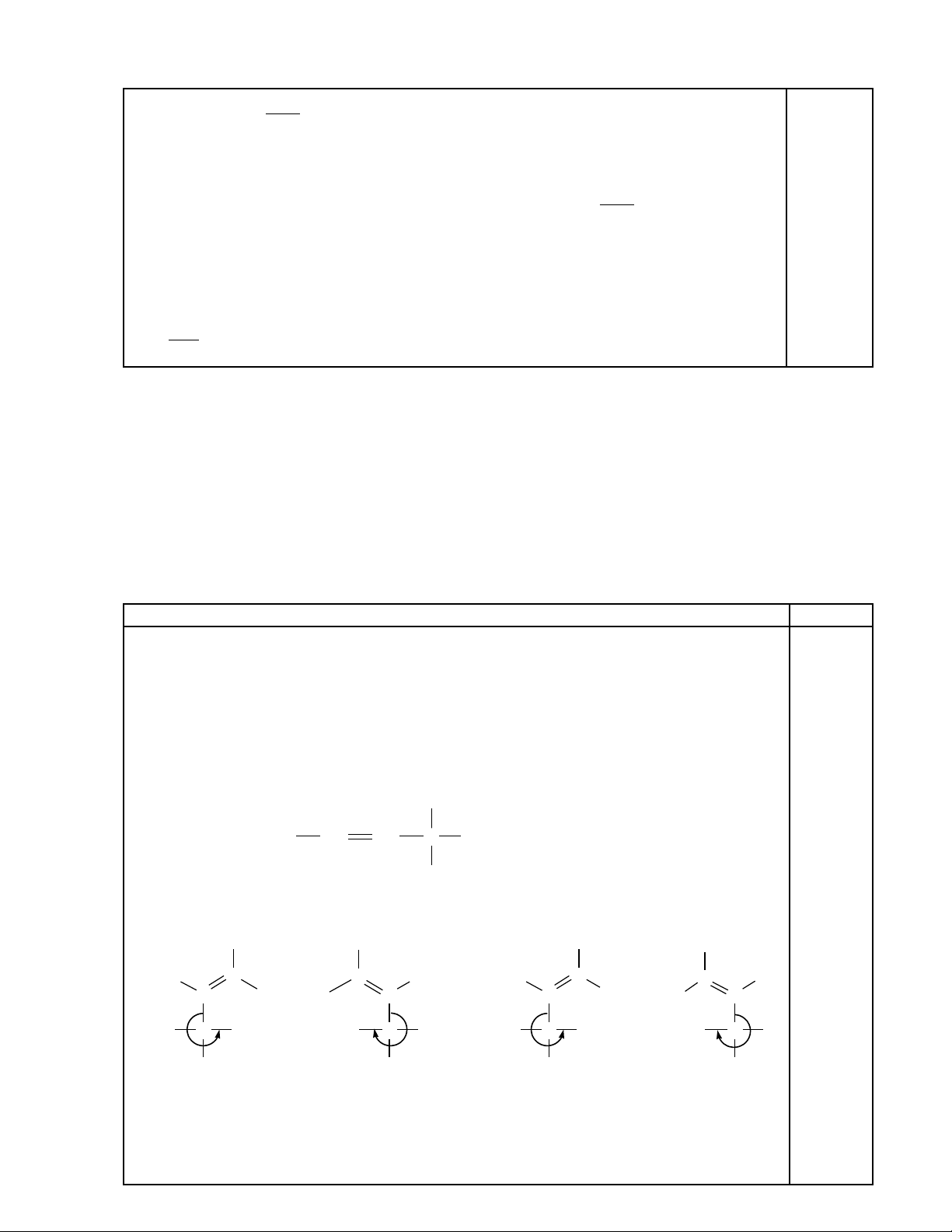
2. (a) Vi t công th c c u t o và g i tên anken ít cacbon nh t đ ng th i có đ ng phân hìnhế ứ ấ ạ ọ ấ ồ ờ ồ
h c và đ ng phân quang h c. (b) Vi t các đ ng phân hình h c và quang h c ng v i c uọ ồ ọ ế ồ ọ ọ ứ ớ ấ
t o đó (s d ng công th c Fisher) và xác đ nh c u hình m i đ ng phân (Z/E và R/S). (b)ạ ử ụ ứ ị ấ ỗ ồ
Vi t c u t o các s n ph m chính hình thành khi cho anken trên tác d ng v i dung d chế ấ ạ ả ẩ ụ ớ ị
n c brom có l ng nh mu i natri clorua.ướ ượ ỏ ố
ĐÁP ÁN ĐI MỂ
1. (1) C2H6 (k) + 7/2O2 (k) → 2CO2 (k) + 3H2O (l)
kcal4,368H −=∆
(2) C2H4 (k) + 3O2 (k) → 2CO2 (k) + 2H2O (l)
kcal2,337H −=∆
(3) H2 (k) + 1/2O2 (k) → H2O (l)
kcal32,68H −=∆
L y (2) - (1) + (3) ta đ c:ấ ượ
C2H4 (k) + H2 (k) → C2H6 (k)
kcal1,37)32,68()4,368()2,337(H −=−+−−−=∆
2. (a) C u t o:ấ ạ
CH
3
CH CH C
H
CH
3
C
2
H
5
(4-metylhex-2-en)
(b) C u hình:ấ
C
C
CH3
H
C2H5
C
H
HCH3
C
C
HCH3
C2H5
C
C
CH3
H
C2H5
C
CH3
HH
C
C
HCH3
C2H5
H
H
C
CH3
H
CH3
C
H
(E)(R) (E)(S)
(Z)(R) (Z)(S)
(c) C u t o các s n ph m:ấ ạ ả ẩ
1,00
0,25
1,00
(0,25
×
4
)
0,75
4
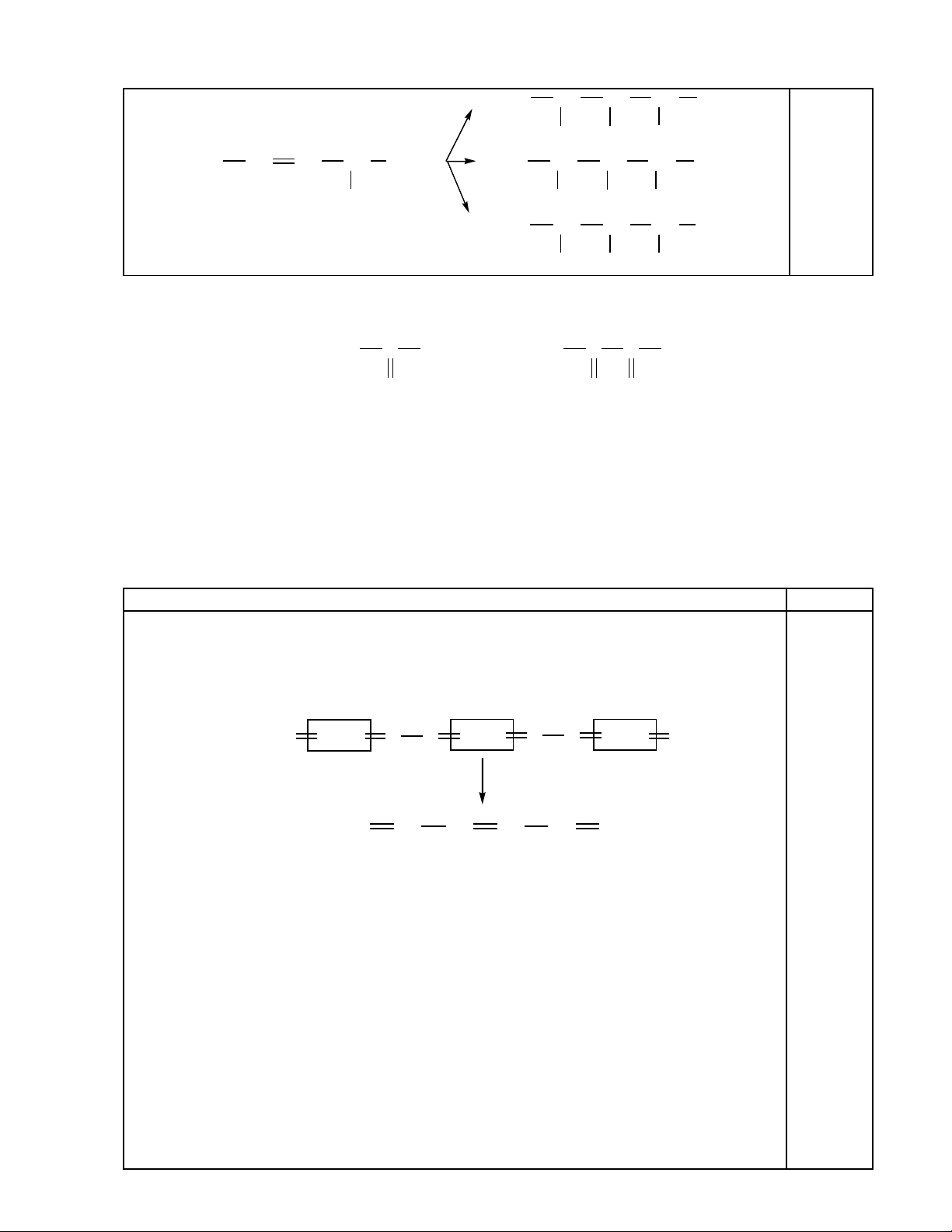
CH3CH CH CH
CH3
C2H5
CH3CH CH CH
CH3
C2H5
Br Br
CH3CH CH CH
CH3
C2H5
OH Br
CH3CH CH CH
CH3
C2H5
Cl Br
(0,25
×
3
)
Câu V (3 đi m)ể
1. Hidrocacbon A có kh i l ng phân t b ng 80. Ozon phân A ch t o andehit fomic vàố ượ ử ằ ỉ ạ
andehit oxalic.
CH
O
H CH
O
C
O
H
andehit fomic andehit oxalic
(a) Xác đ nh c u t o và g i tên A. ị ấ ạ ọ
(b) Dùng c ch gi i thích các s n ph m hình thành khi c ng Brơ ế ả ả ẩ ộ 2 vào A theo t l mol 1:1,ỉ ệ
g i tên các s n ph m này. ọ ả ẩ
2. H p ch t A có công th c phân t Cợ ấ ứ ử 9H8. A làm m t màu Brấ2 trong CCl4; hidro hóa A trong
đi u ki n êm d u t o ra Cề ệ ị ạ 9H10, còn trong đi u ki n nhi t đ và áp su t cao thì t o ra Cề ệ ệ ộ ấ ạ 9H16;
oxi hóa mãnh li t A sinh ra axit phtalic [1,2-Cệ6H4(COOH)2]. L p lu n xác đ nh c u t o c aậ ậ ị ấ ạ ủ
A.
ĐÁP ÁN ĐI MỂ
1. (a) Công th c t ng quát cho A là Cứ ổ xHy
Ta có
=
=
⇒
+≤
=+
8y
6x
2x2y
80yx12
, công th c phân t Cứ ử 6H8
)3( =∆
T s n ph m ozon phân ta thu đ c c u t o c a A:ừ ả ẩ ượ ấ ạ ủ
CH
2
CH CH CH CH CH
2
H
2
C O O H
CH
COOH
CH
COO CH
2
A (hexa-1,3,5-trien)
(b) C ch và s n ph m:ơ ế ả ẩ
0,50
0,50
(0,25
×
2)
1,50
(0,50
×
3)
5



![Đề thi học sinh giỏi Quốc gia THPT môn Hoá học năm 2021-2022 có đáp án [Kèm đề thi]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230215/bapnuong09/135x160/2931676452944.jpg)








![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)




![Đề thi học kì 2 Vật lý lớp 11: Đề minh họa [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/linhnhil/135x160/711752026408.jpg)








