
1
•Nhi t đ ng hóa h cệ ộ ọ
Kh o sát tr ng thái đ u và tr ng thái cu i c a h .ả ạ ầ ạ ố ủ ệ
Đi u ki n đ p di n ra: ề ệ ể ư ễ ∆G = ∆H - T.∆S <0
M c đ di n ra c a quá trình : K ; ứ ộ ễ ủ ∆G0
T = -RTlnKT
•Đ ng hóa h cộ ọ
Nghiên c u giai đo n trung gian : c ch ph n ngứ ạ ơ ế ả ứ
Ph n ng di n ra nhanh hay ch m: t c đ ph n ngả ứ ễ ậ ố ộ ả ứ
Các y u t nh h ng t i t c đ ph n ngế ố ả ưở ớ ố ộ ả ứ
2
2N2O5 = 4NO2 + O2
N2O5 = N2O3 + O2
N2O5 + N2O3 = 4NO2
Ph n ng đ n gi nả ứ ơ ả – p di n raư ễ có 1 giai đo nạ
Ph n ng ph c t pả ứ ứ ạ –
p di n ra qua nhi u giai đo nư ễ ề ạ
M i giai đo n – g i là m t ỗ ạ ọ ộ tác d ng c b n ụ ơ ả
∑ giai đo n ( tác d ng c b n ): ạ ụ ơ ả c ch c a p .ơ ế ủ ư
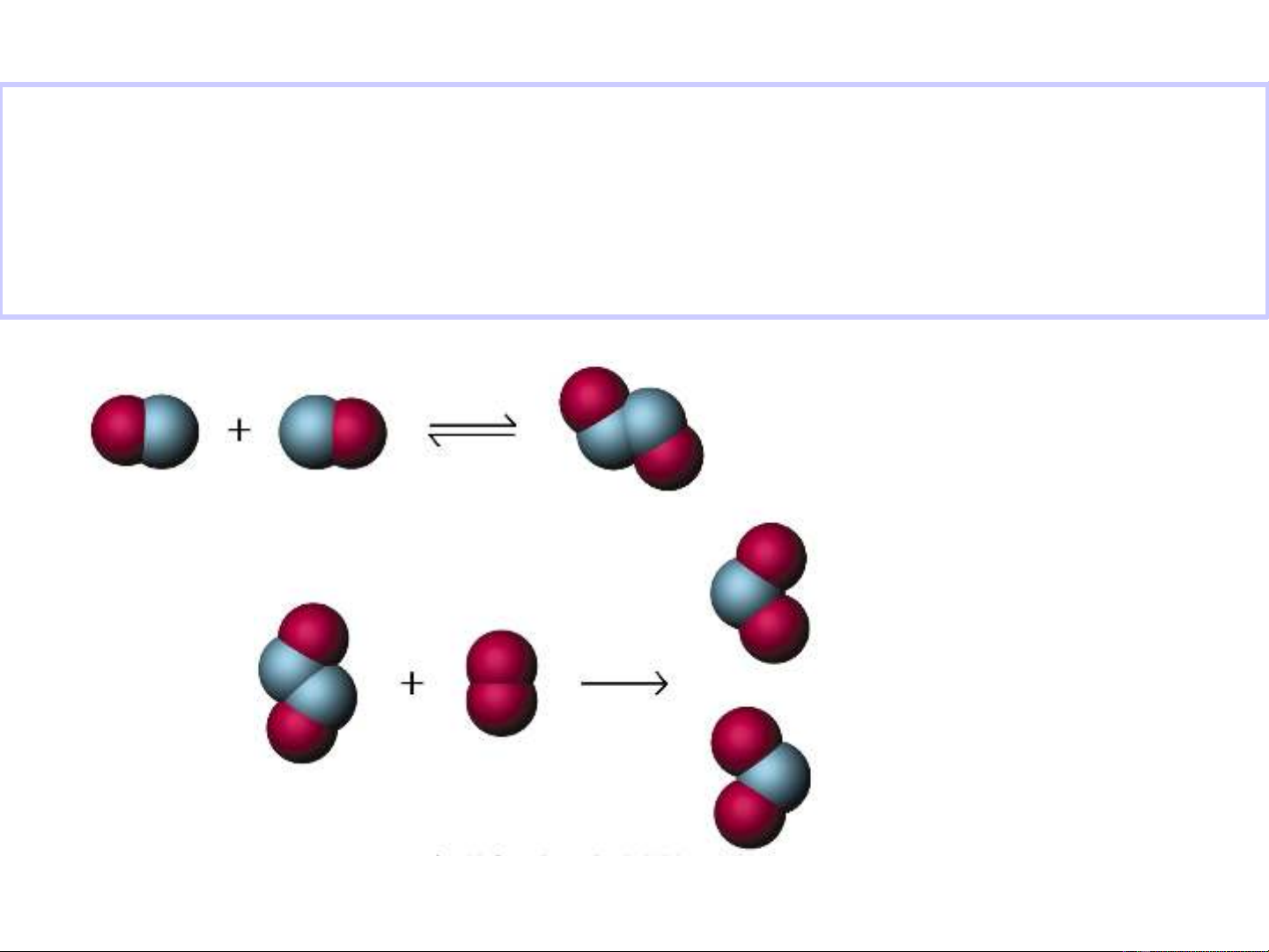
H2 (k) + I2(k) = 2HI(k)
Ví dụ
Có hai giai
đo n:ạ

3
Đ nh lu t tác d ng kh i l ngị ậ ụ ố ượ (M.Guldberg và P.
Waage )
nhi t đ không đ i, p đ ng th , Ở ệ ộ ổ ư ồ ể đ n gi nơ ả :
aA + bB = cC + dD
T c đ ph n ng : ố ộ ả ứ v = k.Ca
A.Cb
B
Đ nh lu t tác d ng kh i l ng c a Guldberg-waage ị ậ ụ ố ượ ủ
nghi m đúng cho các p đ n gi n và cho t ng tác ệ ư ơ ả ừ
d ng c b n c a p ph c t p.ụ ơ ả ủ ư ứ ạ
4
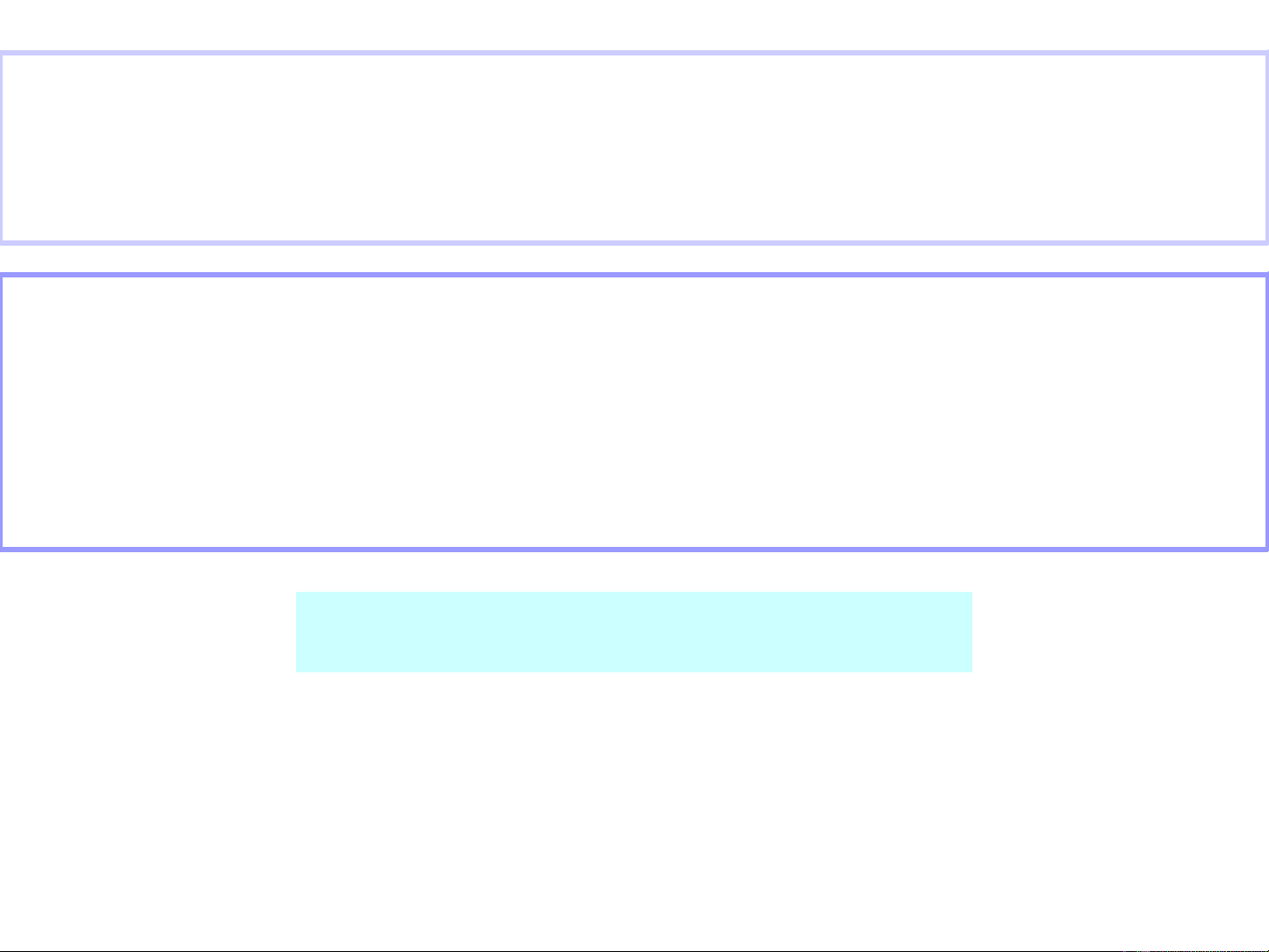
Phân t sử ố
Phân t s - là s ti u phân ( ng t , phân t , ion ) c a ử ố ố ể ử ử ủ
ch t p t ng tác gây nên bi n đ i hoá h c trong 1 tác ấ ư ươ ế ổ ọ
d ng c b n.(PTS = 1,2,3)ụ ơ ả
EOS
Đ n phân tơ ử L ng phân tưỡ ử
Tam phân tử
Đ i v i p đ n gi n ố ớ ư ơ ả
PTS=1 → p đ n phân t Iư ơ ử 2 (k) = 2I(k)
PTS=2 → p l ng phân t Hư ưỡ ử 2(k) + I2(k) = 2HI (k)
PTS=3 → p tam phân t 2NO (k) + Oư ử 2(k) = 2NO2(k)
5
M t ph n ng bao g m nhi u giai đo n n i ti p nhau, ộ ả ứ ồ ề ạ ố ế
t c đ pố ộ ư đ c quy t đ nhượ ế ị b i t c đ c a giai đ an ch m ở ố ộ ủ ọ ậ
nh tấ
Ch m ậ → quy t đ nh t c đế ị ố ộ
EOS
nhanh


























