
Hóa lý dư ợ c
CÁC HIỆ N TƯ Ợ NG BỀ MẶ T
M
Mụục tiêu h
c tiêu họọc t
c tậập
p
-Trình bày đư ợ c: SCBM; hiệ n tư ợ ng ngư ng tụ
mao quả n; và hiệ n tư ợ ng thấ m ư ớ t
-Khái niệ m - Phân loạ i chấ t hoạ t độ ng bề mặ t
-Ả nh hư ở ng chấ t tan đế n SCBM củ a DD
-Ứ ng dụ ng củ a chấ t HĐBM
Khoa Dư ợ c- Đạ i họ c Y Dư ợ c TP HCM

Khoa họ c bề mặ t (Surface sciences)
Là bộ môn quan trọ ng mà cơ cở củ a nó dự a trên:
•Năng lư ợ ng bề mặ t (Surface energy)
•Sứ c căng bề mặ t (Surface tension)
•Lự c mao dẫ n (Capillary forces)
•Độ thấ m ư ớ t (Wettability)
•Sự bám dính (Adhesion)
•Sự hấ p phụ (Adsorption)
•Nhiệ t độ ng lự c họ c bề mặ t
•Sự tư ơ ng tác giữ a các phân tử bề mặ t
Tấ t cả các hiệ n tư ợ ng này đề u xuấ t hiệ n trong đờ i số ng
sinh hoạ t hằ ng ngày củ a chúng ta.

Hòa tan
Phân hủ y
Chuyể n pha
Hình thành
Nghiên
Nghiên c
cứứu
uv
vềề
hi
hiệện
ntư
tư ợợng
ng b
bềềm
mặặt
t
Ý
Ýngh
nghĩ
ĩa
a
Xúc tác
dị thể
Điệ n hóa…
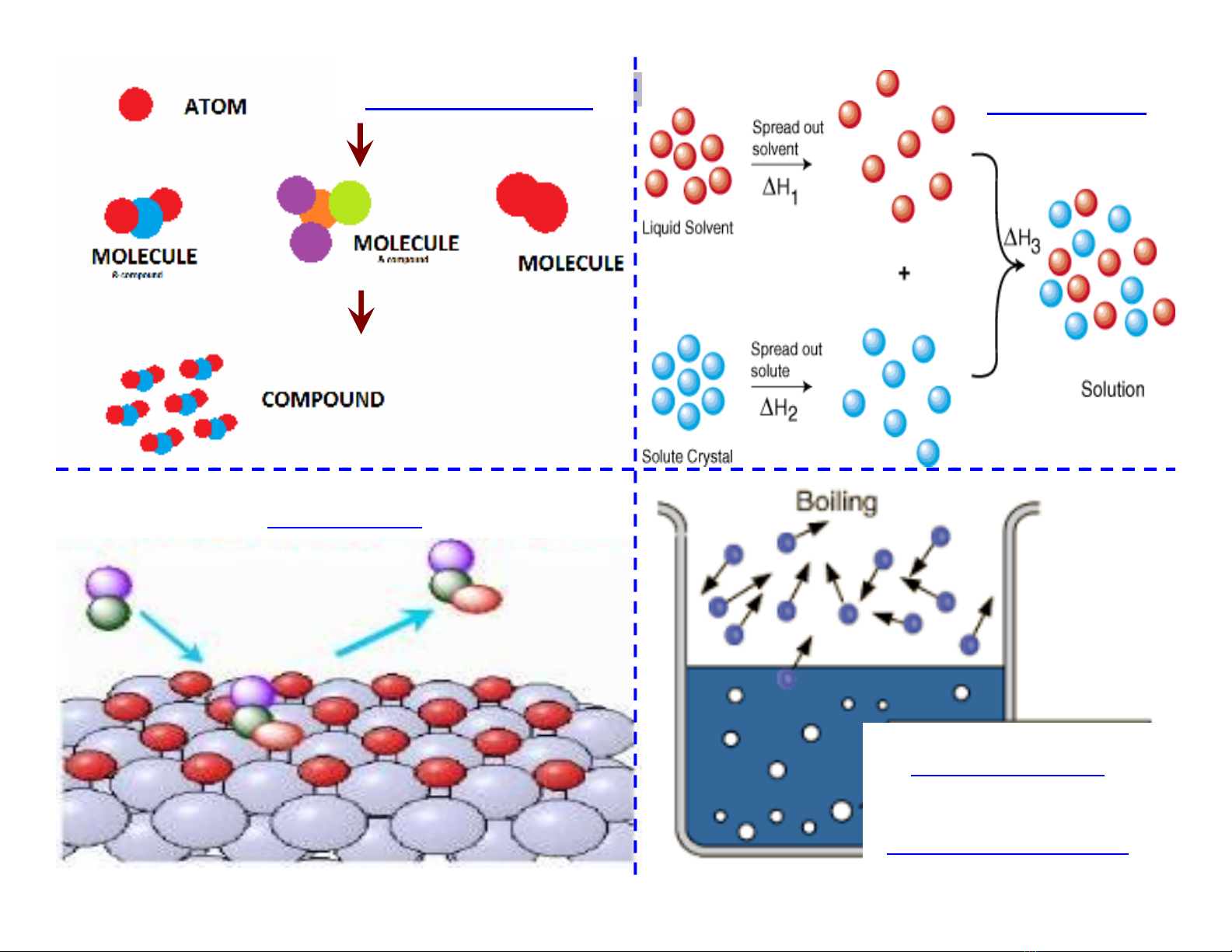
Quá trình
chuyể n pha
Hình thành
Xúc tác
Hòa tan



























