
Chemical
Thermodynamics
NHIỆT ĐỘNG LỰC HỌC
HÓA HỌC
Chemical Thermodynamics

Chemical
Thermodynamics
NGUYÊN LÝ 1
• Định luật bảo toàn năng lượng:
năng lượng không thể tự sinh
ra hoặc tự mất đi.
(James Joule năm 1843 )
DE = q + w
w = PDV
DE = q + PDV
DE = q + DRT
DEHệ + DEMt = 0
DEsys = -DEsurr
• Vì thế, tổng năng nượng của
vũ trụ là một hằng số.
• Năng lượng có thể được chuyển từ
dạng này sang dạng khác. Hoặc,
chuyển từ hệ đến môi trường hay
ngược lại.
Chemical
Thermodynamics
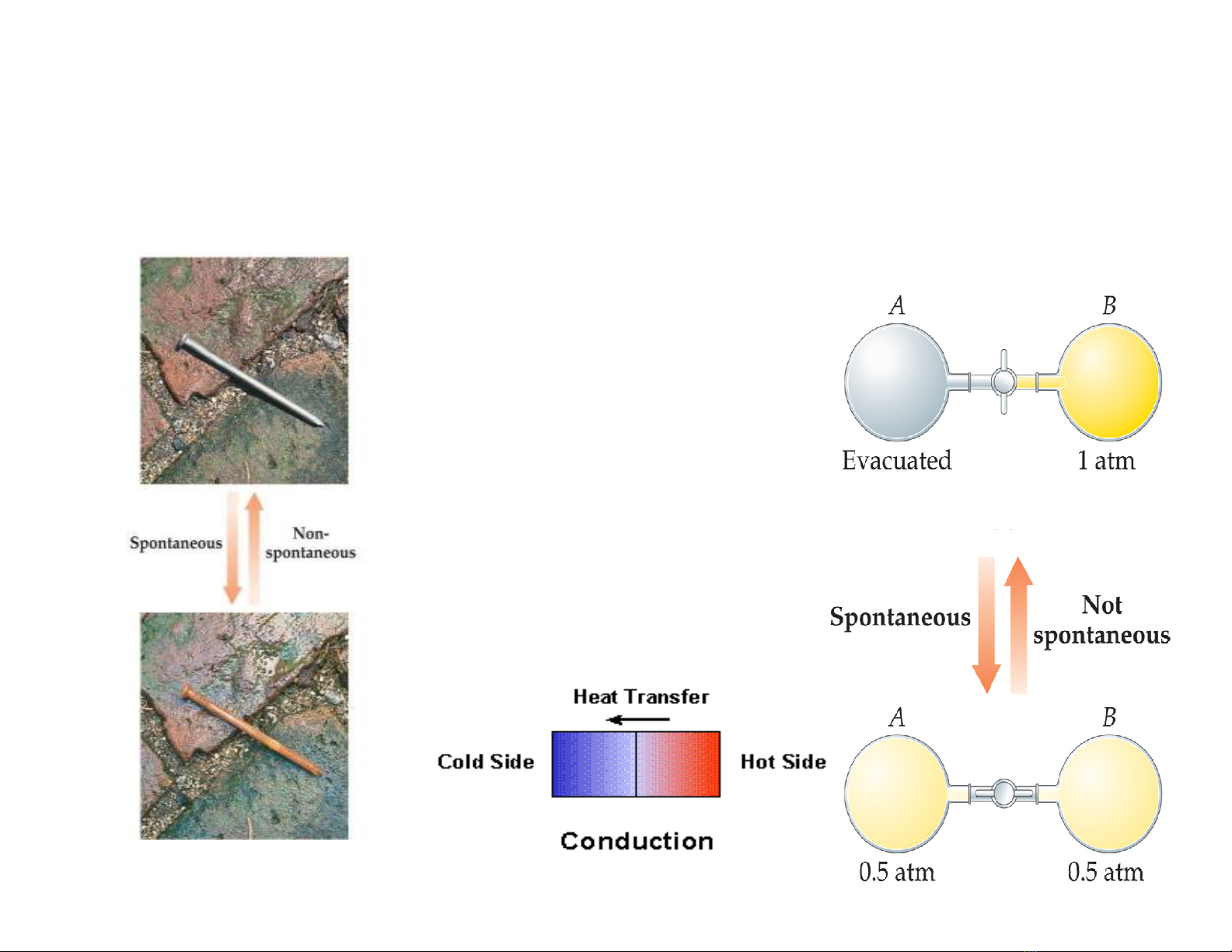
QUÁ TRÌNH TỰ DIỄN BIẾN
• CÓ THỂ TỰ XẢY RA MÀ KHÔNG CẦN SỰ CAN THIỆP.
{Spontaneity}
Các quá trình tự
diễn biến xảy ra
theo chiều nào đó
thì những quá trình
không tự diễn biến
xảy ra theo chiều
ngược lại.

Chemical
Thermodynamics
Quá trình tự diễn biến
• Quá trình tự diễn biến ở nhiệt độ này, có thể không tự
diễn biến ở nhiệt độ khác.
• Trên 0C quá trình nước đá tan chảy là QTTDB.
• Dưới 0C quá trình ngược lại là QTTDB.
Quá trình tan
chảy nước đá
tùy thuộc vào:
Spontaneous @ T > 0ºC
Spontaneous @ T < 0ºC

Chemical
Thermodynamics
Quá trình tự diễn biến liên quan
với tốc độ
Nhiệt động lực học vs. Động hóa
C diamond C graphite









![Bài giảng Hóa lý thực phẩm [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250716/kimphuong1001/135x160/849_bai-giang-hoa-ly-thuc-pham.jpg)
![Bài giảng Hóa lý 1: Tổng hợp kiến thức [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250704/tiepnguyen438@gmail.com/135x160/6631751621117.jpg)
![Bài tập Vật lý sóng: Tổng hợp bài tập 6 [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250805/oursky04/135x160/401768817575.jpg)














