1
TRƯỜNG THCS NGUYỄN TRÃI
__________
ĐỀ CHÍNH THỨC
(Gồm 01 trang)
KỲ THI CHỌN HỌC SINH GIỎI LỚP 9
CẤP TRƯỜNG, NĂM HỌC 2011-2012
_________________________
MÔN: HÓA HỌC
Thời
g
ian: 150
p
hút (Khôn
g
kể thời
g
ian
p
hát đề)
Câu 1: (6điểm)
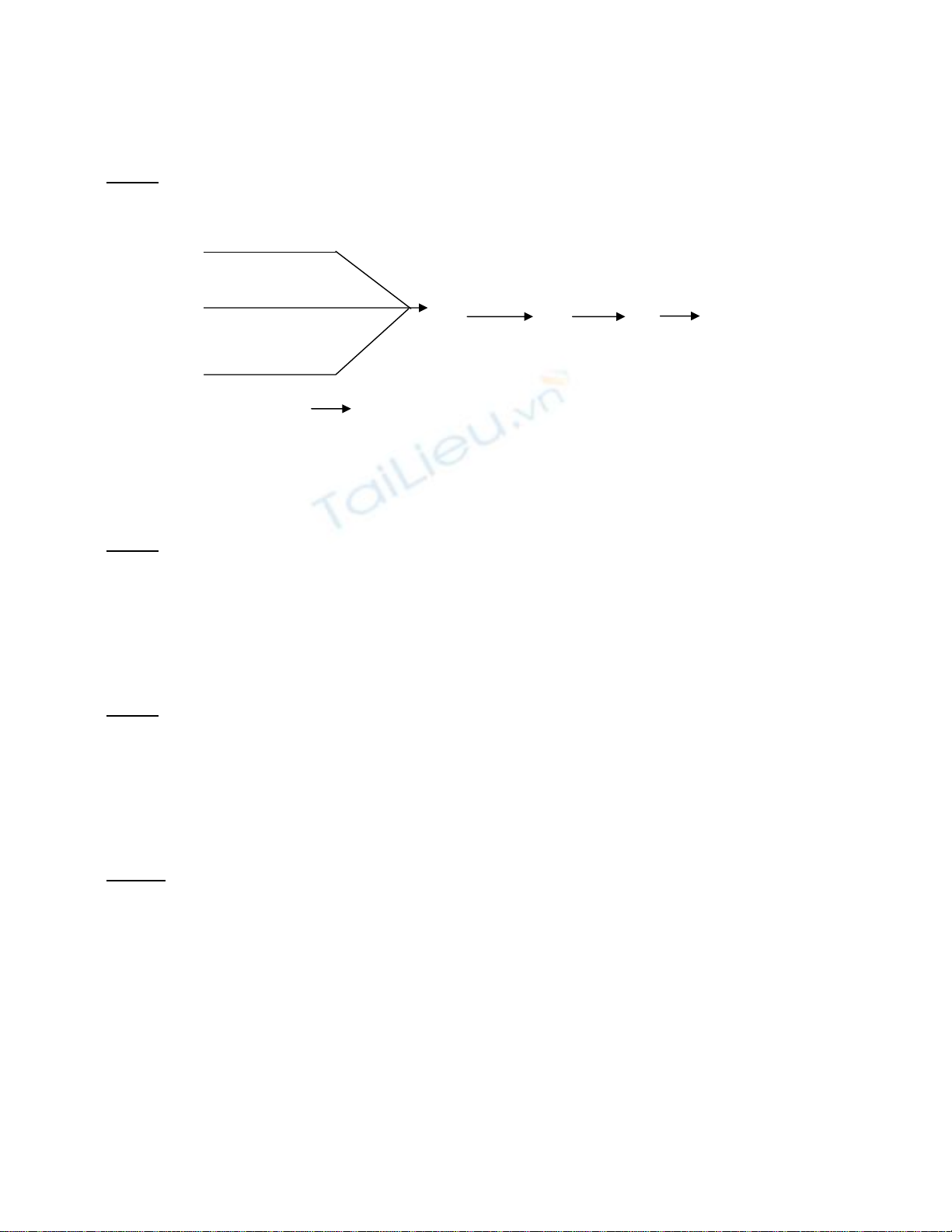
1) Hãy thay các chữ cái bằng các chất thích hợp trong sơ đồ sau và hoàn thành sơ đồ
bằng phương trình phản ứng.
A + X , t0
(1)
+ Y , t0 + B + E + F
A ( 2 ) Fe (4) D (5) G
(6) D
+ Z , t0
A ( 3)
Biết A + HCl D + G + H2O
2) Hãy dùng một kim loại để nhận biết các lọ đựng dung dịch mất nhãn sau:
FeCl2, FeCl3, (NH4)2SO4, MgCl2, NH4Cl, NaCl.
3) Nêu các hiện tượng có thể xảy ra khi cho dung dịch AlCl3 tác dụng với dung dịch
NaOH? Viết phương trình hóa học xảy ra trong các hiện tượng (nếu có)?
Câu 2: (4điểm)
1. Cho a gam dung dịch H2SO4 10% phản ứng với a gam dung dịch KOH 20%. Độ pH
của dung dịch thu được sau phản ứng như thế nào?
2. Trộn lẫn 100 gam dung dịch H2SO4 10% với 200 gam dung dịch H2SO4 C% thu
được dung dịch H2SO4 30%. Tính C% và trình bày cách pha trộn.
3. Cho 21,3 gam P2O5 phản ứng với 200 ml dung dịch hỗn hợp KOH 1M và NaOH
0,5M. Tính khối lượng muối thu được sau phản ứng.
Câu 3: (5điểm)
Hoaø tan 20,8 gam Bari Clorua vaøo x gam dung dòch H2SO4 20% , loïc boû chaát
raén ñöôïc dung dòch A. Cho boät saét vöaø ñuû vaøo A thu ñöôïc 4,48 lít khí ôû ñktc vaø
dung dòch B . Cho KOH dö vaøo B, ñöôïc chaát raén C. Loïc laáy C, nung C trong khoâng
khí ñeán khoái löôïng khoâng ñoåi ñöôïc y gam .
a) Tính x ?
b) Tính y ?
Câu 4: (5điểm)
Nhúng một thanh sắt và một thanh kẽm vào một cốc chứa 500ml dung dịch CuSO4.
Sau một thời gian lấy hai thanh kim loaị ra khỏi cốc thì mỗi thanh có thêm Cu bám vào, khối
lượng dung dịch trong cốc bị giảm mất 0,22g. Trong dung dịch sau phản ứng nồng độ mol
của ZnSO4 gấp 2,5 lần nồng độ mol của FeSO4. Thêm dung dịch NaOH dư vào cốc , lọc lấy
kết tủa rồi nung ngoài không khí đến khối lượng không đổi, thu được 14,5gam chất rắn.
1. Tính số gam Cu bám trên mỗi thanh kim loại ?
2. Tính nồng độ mol của dung dịch CuSO4 ban đầu ?
-----------------------Hết----------------------------
Thí sinh được sử dụng bảng hệ thống tuần hoàn và máy tính bỏ túi

2
Đáp án, thang điểm
Môn: Hóa học 9
Câu Đáp án Điểm
Câu 1:
(6điểm)
1.(1,5đ)
1.Fe3O4 ( r) + 4H2(k) t0 3Fe(r) + 4H2O( h)
2.Fe3O4 ( r) + 4CO(k) t0 3Fe(r) + 4CO2( k)
3.Fe3O4 ( r) + 4C(r) t0 3Fe(r) + 4CO( k)
4. Fe( r) +2 HCl( dd) FeCl2( dd) + H2( k)
5. 2FeCl2( dd) + Cl2( k) → 2FeCl3( dd)
6. 2FeCl3( dd) + Fe ( r) 3FeCl2( dd)
A: Fe3O4 , D: FeCl2 , G: FeCl3 , B: HCl , E: Cl2 , F: Fe
X : CO , Y: H2 , Z : C ( lưu ý : B, X, Y, Z có thể là những chất khác nếu
đúng vẫn đạt điểm.)
2.(3,5đ) Trích mỗi lọ một ít hóa chất làm mẫu thử
Cho kim loại Ba vào các mẫu thử trên, đầu tiên có phản ứng:
Ba ( r) + 2 H2O( l) Ba(OH)2( dd) + H2(k)
Mẫu nào cho kết tủa trắng xanh sau đó hóa nâu trong không khí là FeCl2
Ba(OH)2 (dd) + FeCl2(dd) Fe(OH)2(r)trắng xanh + BaCl2(dd)
4Fe(OH)2(r)trắng xanh + O2(k) + 2H2O(l) →4Fe(OH)3( nâu đỏ)
Mẫu nào có kết tủa nâu đỏ là FeCl3
3Ba(OH)2(dd) + 2FeCl3(dd) → 2Fe(OH)3(r)nâu + 3BaCl2(dd)
Mẫu có kết tủa trắng và có khí mùi khai bay ra là (NH4)2SO4
Ba(OH)2(dd) + (NH4)2SO4(dd) BaSO4(r) + 2NH3(k) + 2H2O(l)
Mẫu nào chỉ có khí mùi khai bay ra là NH4Cl
Ba(OH)2(dd) + 2NH4Cl(dd) →BaCl2(dd) +2 NH3(k) +2 H2O(l)
Mẫu nào chỉ cho kết tủa keo trắng là MgCl2
Ba(OH)2(dd + MgCl2(dd) Mg(OH)2( r) trắng + BaCl2(dd)
Mẫu không có hiện tượng gì là NaCl
3. (1đ) Khi cho dung dịch AlCl3 tác dụng với dung dịch NaOH xảy ra các
trường hợp sau:
TH1: Nếu NaOH vừa đủ tác dụng với dung dịch AlCl3 thì chỉ có hiện
tượng kết tủa trắng.
AlCl3(dd) + 3NaOH(dd) Al(OH)3( r) trắng + 3NaCl (dd)
TH2 : Nếu NaOH dư thì ban đầu có hiện tượng kết tủa sau đó kết tủa tan
dần
Al(OH)3( r) trắng + NaOH(dd) NaAlO2(dd) + 2H2O( l)
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
0.25 đ
Câu 2 1.

3
(4điểm) 24 24 2
H SO + 2KOH K SO + 2H O........................................................................⎯⎯→Số
mol H2SO4 = 0,1a/98
Số mol KOH = 0,2a/56
Theo phương trình phản ứng suy ra KOH dư nên môi trường bazơ, pH > 7
2.
Dung dịch H2SO4 sau khi pha có khối lượng bằng 300 g, 30% nên có phương
trình:
10 2
30 100 40%....................................................................................
300
CC
+
=⇒=
Cách trộn: …………………………………………………………………..
- Cân 100 g dung dịch H2SO4 10%.
- Cân 200 g dung dịch H2SO4 40%. Trộn, khuấy đều hai dung dịch trên.
3.
Số mol P2O5 = 0,15 mol nên suy ra số mol H3PO4 = 0,3 (mol)…………….
Số mol 0,3OH −= mol
Ta có tỉ lệ
34
1
1
OH
HPO
n
n
−= suy ra thu được muối H2PO4
- = 0,3 (mol)
Khối lượng muối bằng: ++ -
24
KNaHPO
m + m + m = 0,2.39 + 0,1.23 + 0,3.97 = 37,2 (g)
0,5đ
0,25đ
0,25đ
0,5đ
0,5đ
0,5đ
0,5đ
0,5đ
0,5đ
Câu 3
(5điểm)
a) Soá mol BaCl2 = 0,1, soá mol H2 = 0,2
BaCl2 + H2SO4 -> BaSO4 + 2HCl (1)
0,1 0,1 0,2
Fe + 2HCl -> FeCl2 + H2 (2)
0,2 0,1 0,1 < 0,2 => H2SO4 dö -> 0,1
molH2 coøn laïi phaûi do saét taùc duïng vôùi H2SO4 dö .
Fe + H2SO4 -> FeSO4 + H2 (3)
0,1 0,1 0,1
=> Toång soá mol cuûa H2SO4 laø : 0,2
Khoái löôïng dung dòch H2SO4 = x = 0, 2.98.100
20 = 98 ( gam )
b) Tính y :
FeCl2 + 2KOH -> Fe(OH)2 (C) + 2KCl
0,1 0,1
FeSO4 + 2KOH -> Fe(OH)2 (C) + K2SO4
0,1 0,1
4Fe(OH)2 (C) + O2 o
t
⎯
⎯→ 2Fe2O3 + 4H2O
0,2 0,1
=> Khoái löôïng Fe2O3 = y = 0,1 .160 = 16 (gam )
0,5ñ
0,5ñ
0,5ñ
0,5ñ
0,5ñ
0,5ñ
0,5ñ
0,5ñ
0,5ñ
0,5ñ
Câu 4
(5điểm)
1. PTHH: Fe + CuSO4 Cu + FeSO4 ( 1)
a mol a mol a mol a mol
Zn + CuSO4 Cu + ZnSO4 (2)
2,5a mol 2,5a mol 2,5a mol 2,5a mol
Gọi a là số mol của Fe tham gia phản ứng
0,5ñ
0,5ñ
0,5ñ
4
Do nồng độ mol của ZnSO4 = 2,5. Nồng độ mol của FeSO4
⇒ Số mol của ZnSO4 = 2,5 lần số mol của FeSO4.
Theo PTHH ta có:
Khối lượng thanh sắt tăng: (64-56).a = 8a (g)
Khối lương thanh kẽm giảm: (65- 64).2,5a = 2,5a (g)
⇒Khối lượng của hai thanh kim loại tăng: 8a – 2,5a = 5,5a (g)
ứng với 0,22 g nên a= 0,22: 5,5 = 0,04(mol)
Vậy khối lượng Cu bám trên thanh sắt là: 64. 0,04 = 2,56 (g)
Khối lượng Cu bám trên thanh kẽm là: 64. 2,5. 0,04 = 6,4(gam)
2. Dung dịch sau phản ứng (1), (2) có FeSO4, ZnSO4 và CuSO4 ( nếu
có)
Ta có sơ đồ phản ứng:
FeSO4 NaOHdư Fe(OH)2
02
,tk
1/2 Fe2O3
amol amol a/2mol
23 160.0,04. 3, 2( )
2
Fe O
a
mg==
CuSO4 NaOHdư Cu(OH)2
0
t CuO
bmol b mol bmol
mCuO = 80b = 14,5 – 3,2 = 11,3 (g)
⇒ b = 0,14 (mol)
Vậy tổng số mol CuSO4 ban đầu= a + 2,5a + b = 0,28(mol)
4
0, 28 0,56
0,5
CuSO
M
CM==
0,25ñ
0,25ñ
0,25ñ
0,25ñ
0,25ñ
0,25ñ
0,5ñ
0,25ñ
0,5ñ
0,25ñ
0,5ñ
Ghi chú: Nếu học sinh làm theo cách khác mà đúng thì vẫn cho điểm tối đa.
-------------------Hết--------------------











![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)




![Đề thi học kì 2 Vật lý lớp 11: Đề minh họa [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/linhnhil/135x160/711752026408.jpg)








