
LỜI NÓI ĐẦU
Theo khung chương trình, sinh viên Đại Học Sư Phạm ngành Vật Lý trong những
năm đầu được học môn Vật lý Phân tử và Nhiệt học (60 tiết) và môn Nhiệt động lực
học (30 tiết). Tuy vậy, nhiều nội dung trong hai giáo trình nầy có sự trùng lặp. Trong
điều kiện ngành học mới mở và thiếu cán bộ giảng dạy nên Khoa vật lý ĐHSP. ĐN
chủ trương nhập chung nội dung hai giáo trình và giảng dạy trong 90 tiết. Để đáp ứng
yêu cầu đó và để sinh viên dể dàng tiếp cận môn học, chúng tôi mạnh dạn biên soạn
giáo trình nầy.
Việc lồng ghép hai nội dung lớn vào trong một giáo trình là điều khó khăn cho
người soạn, đồng thời để phù hợp với kiến thức của sinh viên đã được trang bị ở bậc
học phổ thông về Công và Nhiệt, trong giáo trình nầy người soạn theo đúng quy ước
đại số về dấu của Công và Nhiệt như đã có trong chương trình phổ thông trung học,
sự thay đổi nầy cũng là một khó khăn lớn khi trình bày các nội dung...
Với kiến thức và trình độ có hạn, tuy đã rất cố gắng nhưng chắc rằng giáo
trình không thể tránh khỏi những thiếu sót. Người soạn mong nhận được những góp ý
quý báu của các đồng nghiệp và bạn đọc.
NGƯỜI SOẠN

- Trang 2 -
CHƯƠNG I
MỞ ĐẦU VÀ CÁC KHÁI NIỆM CƠ BẢN
1.1 CÁC KHÁI NIỆM
1.1.1 ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NHIỆT HỌC
1.1.1.1 Đối tượng
Vật lý Phân tử và Nhiệt học nghiên cứu các hiện tượng liên quan đến các
quá trình xảy ra bên trong vật.
Ví dụ: Quá trình nóng chảy hoặc quá trình bốc hơi của các vật khi được nung
nóng, các quá trình này có liên quan đến dạng vận động xảy ra bên trong vật: chuyển
động nhiệt.
Vậy; chuyển động nhiệt là đốí tượng nghiên cứu của nhiệt học.
1.1.1.2 Phương pháp
Nghiên cứu chuyển động nhiệt người ta dùng hai phương pháp:
- Phương pháp thống kê (Vật lý phân tử ): Phân tích các quá trình xảy ra đối
với từng phân tử, nguyên tử riêng biệt trên quan điểm vi mô và dựa vào qui luật thống
kê để tìm qui luật chung cho cả tập hợp các phân tử, từ đó giải thích các tính chất của
vật; phương pháp cho phép nhận thức một cách sâu sắc bản chất nhiệt học.
- Phương pháp nhiệt động: Nghiên cứu sự biến đổi năng lượng của vật từ
dạng này sang dạng khác trên quan điểm vĩ mô. Phương pháp dựa trên hai nguyên lý
cơ bản của NĐH được rút ra từ thực nghiệm; từ đó nêu ra những tính chất của vật
trong các điều kiện khác nhau mà không cần chú ý đến cấu tạo phân tử. Phương pháp
có điểm hạn chế là không giải thích sâu bản chất của hiện tượng nhưng trong nhiều
vấn đề nó cho ta cách giải quyết đơn giản, hiệu quả.
Trong giáo trình nầy chúng ta dùng cả hai phương pháp trên để hổ trợ, bổ sung
cho nhau nhằm hiểu thấu đáo các vấn đề của chuyển động nhiệt; tuy vậy không ít khó
khăn trong trình bày do sự đan xen của các phương pháp và quan điểm.
1.1.2 HỆ NHIỆT ĐỘNG
1.1.2.1 Hệ nhiệt động
Hệ nhiệt động là một tập hợp các vật thể được bao bởi một bề mặt chu vi.

- Trang 3 -
- Các vật thể có thể là các cá thể kích thước vĩ mô, cũng có thể là các phân tử,
nguyên tử khí kích thước rất bé.
- Bề mặt chu vi có thể là thực như chu vi của một bình đựng khí, cũng có thể là
ảo như bề mặt bao quanh một lượng chất lỏng chảy dọc theo một ống mà ta theo dõi
bằng trí tưởng tượng.
Như vậy khái niệm “hệ nhiệt động” (gọi tắc là hệ) là một khái niệm rộng và
tổng quát.
1.1.2.2 Hệ con
Là một phần của hệ nhưng số cá thể ít hơn và có thể tích bé hơn. Như vậy
“hệ” có thể xem như được cấu tạo bởi nhiều hệ con. Hệ con chịu ảnh hưởng tác động
của phần còn lại của hệ lên nó nên trạng thái của hệ con luôn thay đổi.
1.1.2.3 Khoãng ngoài
Phần còn lại ở ngoài hệ được gọi là khoảng ngoài hay ngoại vật.
1.1.2.4 Hệ cô lập
Hệ hoàn toàn không tương tác và trao đổi năng lượng với khoảng ngoài
được gọi là hệ cô lập; ngược lại nếu hệ có tương tác hoặc trao đổi năng lượng với
khoảng ngoài thì gọi là “hệ không cô lập“.
1.1.2.5 Hệ cô lập một phần
Hệ có trao đổi công với khoảng ngoài mà không trao đổi nhiệt thì hệ được
gọi là hệ cô lập về nhiệt, ngược lại có trao đổi nhiệt nhưng không trao đổi công thì
được gọi là hệ cô lập về công, đây là các hệ cô lập một phần.
1.1.3 TRẠNG THÁI MỘT HỆ NHIỆT ĐỘNG
1.1.3.1 Thông số trạng thái
Trạng thái của một hệ nhiệt động được xác định bởi một bộ các đại
lượng vật lý, các đại lượng nầy được gọi là thông số trạng thái của hệ.
Ví dụ: Đối với một khối khí, trạng thái của khối khí được xác định khi biết áp
suất p, nhiệt độ T và thể tích V khối khí. Từ đó các đại lượng p, V và T là các thông
số trạng thái, thông thường một bộ ba thông số (p,V, T) xác định một trạng thái vĩ
mô của khối khí.
Đối với các hệ thống phức tạp, cần xác định thêm các đại lượng: Nồng độ, tỉ
trọng hoặc điện tích...
Thực nghiệm cho thấy: Một hệ cô lập ở không cân bằng nhiệt động, nếu để một
thời gian đủ lâu thì hệ tiến tới cân bằng nhiệt động, khi đó mọi nơi trong hệ đều cùng
- Trang 4 -
một áp suất, cùng một nhiệt độ. Ta chỉ khảo sát những hệ ở cân bằng nhiệt động. Về
phương diện vĩ mô, có thể chia thông số trạng thái làm hai loại :
- Thông số quảng tính: Là thông số mà độ lớn của nó tỉ lệ với khối lượng hệ,
chẳng hạn : thể tích v.
- Thông số cường tính: Là thông số không phụ thuộc vào khối lượng hệ.
Ví du û: Áp suất, nhiệt độ, mật độ ... nếu ta chia nhỏ hệ ra thành nhiều hệ con thì giá
trị của thông số cường tính không đổi.
1.1.3.2 Phương trình trạng thái
Các thông số trạng thái p, V, T...của hệ không hoàn toàn đập lập nhau, mỗi
thông số là một hàm của các thông số còn lại. Hệ thức nối liền các thông số trạng thái
được gọi là phương trình trạng thái của hệ. Đối với một khối khí có khối lượng xác
định, phương trình trạng thái là hệ thức nối liền ba thông số p, V, T.
p = f ( V, T ) hoặc F ( p, V, T ) = 0 (1.1)
Ví dụ : Phương trình trạng thái của một kilômol khí lý tưởng : p.V = RT
Trong phương trình trạng thái, khi hai thông số được xác định thì thông số
thứ ba còn lại sẽ được xác định đơn giá theo hai thông số kia và một trạng thái vĩ mô
hệ được xác định. Việc khảo sát phương trình trạng thái là một vấn đề cơ bản của
nhiệt học.
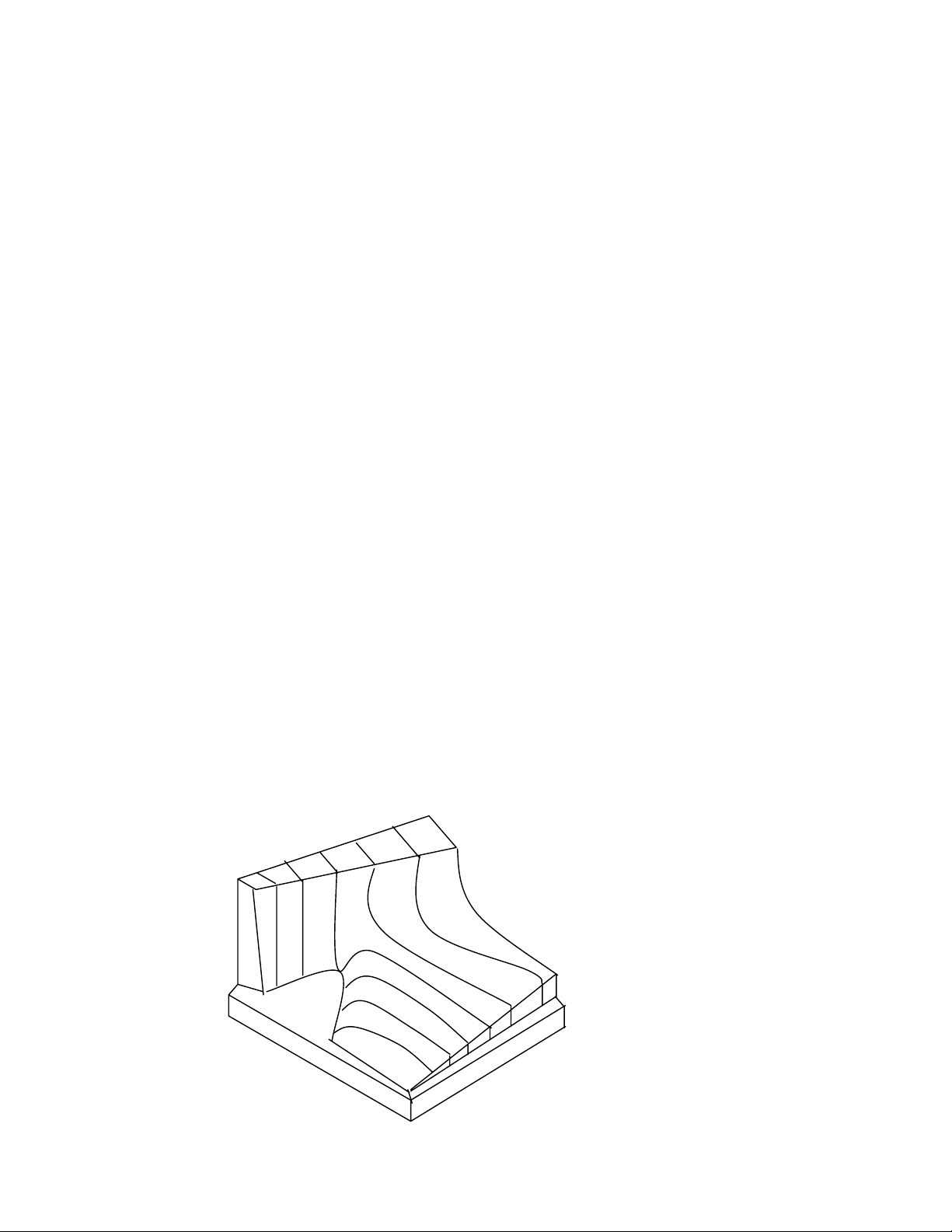
1.1.3.2.1 Biểu diển bằng mặt p - V - T: Vẽ biểu đồ của phương trình
trạng thái trong một hệ trục tọa độ gồm ba trục áp suất p, thể tích V, nhiệt độ T vuông
góc nhau từng đôi, ta được một mặt p - V - T. Bất kỳ một trạng thái cân bằng nào của
hệ cũng được biểu diển bằng một điểm trên mặt p - V - T, ngược lại mỗi điểm trên mặt
p - V - T biểu diển một trạng thái cân bằng của hệ (hinh1.1).
Mặt p -V -T của khí
Van der Waals
T
1
T2 Tth
P
V
T
Hçnh 1.1

- Trang 5 -
1.1.3.2.2 Biểu diễn bằng mặt p - V: Các thông số trạng thái phụ thuộc nhau
nên để đơn giản người ta dùng giản đồ p - V. Ở một nhiệt độ xác định T giao tuyến của
mặt p - V - T với mặt phẳng vuông góc trục nhiệt T là những đường biến đổi cân bằng
gọi là đường đẳng nhiệt (hinh 1.2).
- Tương tự, giao tuyến giữa mặt p - V - T với mặt vuông góc trục thể tích V là
đường biến đổi đẳng tích, hoặc với trục áp suất p là đường biến đổi đẳng áp.
Những đường đẳng nhiệt
của khí Van der Waals
1.2 ÁP SUẤT
1.2.1 Áp suất là đại lượng vật lý có giá trị bằng lực nén vuông góc lên một
đơn vị diện tích.
p =
S
F (1.2)
S : diện tích bề mặt
F : lực nén vuông góc lên diện tích S: áp lực.
Đơn vị:
Trong hệ SI áp suất có đơn vị [ N/m2 ] còn gọi là Pa (Paxcan).
Trong hệ CGS áp suất có đơn vị là : [dyn / cm2 ] ngoài ra áp suâõt còn có
các đơn vị khác : bar ; at ; atm ; mmHg ...
- 1 bar = 105 N/m2
- Atmôtphe kỹ thuật: 1 atĠ4 N/m2.
- Atmôtphe vật lý: 1 atm = 1,013. 105 N/m2.
- 1 mmHg [ 1Tor ] = 133,32 N/m2 là áp suất gây bởi trọng lượng cột
thủy ngân cao 1mm.
Ta có: 1atm = 1,033at = 760 mmHg; hoặc 1at = 736mmHg.
P
K
V
Tth
T1
Hçnh 1.2











![Bài tập Vật lý sóng: Tổng hợp bài tập 6 [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250805/oursky04/135x160/401768817575.jpg)














