LỚP BỒI DƯỠNG KIẾN THỨC HÓA HỌC 10, 11, 12 18A/88ĐINH VĂN TẢTP.HẢI DƯƠNG
Để tìm hiểu và đăng kí học, hãy gọi điện tới số 09798.17.8.85 (gặp Thầy Quỳnh)
Biên soạn và giảng dạy: Thầy Ngô Xuân Quỳnh (E_mail: hoahoc.org@gmail.com – Website: hoahoc.org)
1
«
«
«n
n
n
t
t
th
h
hi
i
i:
:
:
H
H
Hã
ã
ãa
a
a
H
H
Hä
ä
äc
c
c
K
K
Kh
h
hè
è
èi
i
i
B
B
B
M
M
M
®
®
®Ò
Ò
Ò
6
6
63
3
37
7
7
§©y l gîi ý gi¶i ®Ò thi ®¹i häc, cao ®¼ng khèi B n¨m 2009. Gîi ý lêi gi¶i ny t«i ®−a nªn chØ víi môc
®Ých ®Ó cho c¸c em häc sinh, còng nh− c¸c b¹n ®ång nghiÖp tham kh¶o ®Ó biÕt ®−îc h−íng v c¸ch lm mét ®Ò
thi sao cho tèt nhÊt trong kho¶ng thêi gian ng¾n nhÊt.
§: cã rÊt nhiÒu thÇy c« gi¸o ®: nhiÖt t×nh ®−a ra lêi gi¶i chi tiÕt v trän vÑn cho ®Ò thi hãa khèi B n¨m
nay, trong ®ã cã nhiÒu bi viÕt kh¸ hay. Tuy cã ®−a ra h¬i muén so víi c¸c ®¸p ¸n kh¸c, nh−ng trong bi viÕt
ny t«i sÏ ®−a ra nh÷ng ý kiÕn riªng cña b¶n th©n t«i vÒ ®Ò thi, t«i hi väng nh÷ng ý kiÕn cña b¶n th©n t«i vÒ ®Ò
thi ny sÏ gióp Ých cho c¸c em häc sinh còng nh− c¸c b¹n ®ång nghiÖp trong qu¸ tr×nh d¹y v häc hãa häc.
Trong lêi gîi ý gi¶i ë c¸c c©u, t«i cè g¾ng ph©n tÝch nh÷ng lçi v nh÷ng sai lÇm m c¸c em häc sinh cã
thÓ m¾c ph¶i trong qu¸ tr×nh lm bi. Nh÷ng lêi gîi ý v ph−¬ng ph¸p t«i ®−a ra cã thÓ ch−a ph¶i l ph−¬ng
ph¸p nhanh nhÊt hoÆc tèt nhÊt v× cßn cã rÊt nhiÒu ph−¬ng ph¸p v c¸ch lm kh¸c nhau, nh−ng t«i hi väng r»ng
víi c¸ch m t«i ®−a ra sÏ l mét trong nh÷ng c¸ch m häc sinh c¶m thÊy dÔ hiÓu nhÊt.
Lêi gîi ý ny ®−îc ®−a ra ®−îc ®−a ra trong thêi gian rÊt ng¾n sau khi kÕt thóc k× thi khèi B n¨m 2009,
nªn trong qu¸ tr×nh ®¸nh m¸y sÏ kh«ng tr¸nh khái nh÷ng sai xãt trong qu¸ tr×nh ®¸nh m¸y. Trong qu¸ tr×nh ®äc
v t×m hiÓu vÒ lêi gîi ý, nÕu nh− cã bÊt k× ai ®ã ph¸t hiÖn ra ®−îc nh÷ng lçi sai xãt trong c¸c c©u, t«i rÊt mong
sÏ nhËn ®−îc nh÷ng lêi gãp ý ch©n thnh cña c¸c b¹n ®Ó t«i hon thiÖn h¬n n÷a vÒ lêi gîi ý gi¶i.
Mäi gãp ý xin liªn hÖ qua
+ E_mail: netthubuon@yahoo.com hoÆc hoahoc.org@gmail.com
+ §iÖn tho¹i: 0979817885
+ C¬ së båi d−ìng kiÕn thøc: 18A/88§inh V¨n T¶Th#nh Phè H¶i D−¬ng
Cho biÕt khèi l−îng nguyªn tö (theo ®vC) cña c¸c nguyªn tè :
H = 1; C = 12; N = 14; O = 16; F = 19 ; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; K = 39; Ca = 40;
Mn = 55; Fe = 56; Cu = 64; Zn = 65; Br = 80; Ag = 108 ; I = 127 ; Ba = 137 ; Au = 197
!"#$ (40 c©u, tõ c©u 1 ®Õn c©u 40)
C©u 1: Cho m gam bét Fe vo 800 ml dung dÞch hçn hîp gåm Cu(NO
3
)
2
0,2M v H
2
SO
4
0,25M. Sau khi c¸c
ph¶n øng x¶y ra hon ton, thu ®−îc 0,6m gam hçn hîp bét kim lo¹i v V lÝt khÝ NO (s¶n phÈm khö duy nhÊt, ë
®ktc). Gi¸ trÞ cña m v V lÇn l−ît l
A. 17,8 v 4,48. B. 17,8 v 2,24. C. 10,8 v 4,48. D. 10,8 v 2,24.
Gîi ý: Ta cã:
3 2 2 4
3
( )
2 2.0,8.0,2 0,32 2 0,4
+
H
v n
−
= = = = =
Ta cã;
3 2
0,4 0,1
0,32
4 3 2
+
3
H cã kh¶ n¨ng sÏ tham gia ph¶n øng hÕt
v NO d−
+−
+ + → + →
Theo ®Ò bi, sau ph¶n øng thu ®−îc hçn hîp 2 kim lo¹i
VËy chøng tá r»ng Fe vÉn cßn d− sau
=> khi ®ã th×
5 2 2 2
0,1 0,3 0,1 0,16 0,32 0,16 2.
3 ; 2
0,4m + 0,16.64 0,4m + 0,16.64
56 56
v Fe 2e
+ + + +
+ → + → →
(
t¹i sao th× b¹n tù t×m hiÓu nÕu ch−a biÕt
)
Khèi l−îng cña Fe cßn d− l: 0,6m – 0,16.64 => khèi l−îng tham gia ph¶n øng l 0,4m + 0,16.64
Theo ®Þnh luËt b¶o ton electron ta cã: 2.(0,4m.56 + 0,16.64) = (0,3 + 0,32).56 => m = 17,8 gam
VËy ®¸p ¸n l: B
LỚP BỒI DƯỠNG KIẾN THỨC HÓA HỌC 10, 11, 12 18A/88ĐINH VĂN TẢTP.HẢI DƯƠNG
Để tìm hiểu và đăng kí học, hãy gọi điện tới số
09798.17.8.85
(gặp
Thầy Quỳnh
)
Biên soạn và giảng dạy: Thầy
Ngô Xuân Quỳnh (
E_mail:
hoahoc.org@gmail.com –
Website:
hoahoc.org
)
2
NhËn xÐt:
§Ò bi cho kim lo¹i t¸c dông víi dung dÞch hçn hîp chøa
+
3
NO v H
Chóng ta cÇn ph¶i vËn dông ph−¬ng ph¸p b¶o ton electron ®iÖn tÝch v sö dông ph−¬ng tr×nh ion thu
gän. Qua c©u hái ny c¸c em häc sinh cÇn ghi nhí vÒ:
+ HiÓu ®−îc b¶n chÊt cña ph¶n øng hãa häc trong dung dÞch.
+ TÝnh oxi hãa cña ion
)
+
3
NO cña dung dÞch muèi trong m«i tr−êng a
xit (H
.
+ VÞ trÝ cÆp oxi hãa – khö cña kim lo¹i v ý nghÜa cña chóng;
2 2 3
2
+ + +
+
+ RÌn luyÖn ph−¬ng ph¸p tÝnh to¸n bi to¸n (b¶o ton electron, ion,
)
v kÜ n¨ng tÝnh to¸n.
§©y l mét d¹ng to¸n kh¸ l quen thuéc trong ch−¬ng tr×nh hãa häc phæ th«ng.
§iÓm mÊu chèt cña bi to¸n l biÕt dùa vo d÷ kiÖn: “
thu ®−îc 0,6m gam hçn hîp bét kim lo¹i
”
C©u 2
: Cã c¸c thÝ nghiÖm sau:
(I) Sôc khÝ CO
2
vo n−íc Giaven. (III) Nhóng thanh s¾t vo dung dÞch H
2
SO
4
lo:ng, nguéi.
(II) Sôc khÝ SO
2
vo n−íc brom. (IV) Nhóng l¸ nh«m vo dung dÞch H
2
SO
4
®Æc, nguéi.
Sè thÝ nghiÖm x¶y ra ph¶n øng hãa häc l
A. 4. B. 3. C. 1. D. 2.
Gîi ý:
Víi c©u hái ny chñ yÕu l yªu cÇu c¸c em häc sinh ghi nhí ®−îc kiÕn thøc, nªn em no l¾m ®−îc kiÕn
thøc th× viÖc gi¶i quyÕt bi to¸n chØ cÇn kho¶ng thêi gian 20s.
Ph−¬ng tr×nh ph¶n øng:
2 2 3
2 4 4 2
2 2 2 2 4
2 4
2
(lo:ng, nguéi)
(®Æc, nguéi)
+ + → +
+ → +
+ + → +
+ →
2 4
do Al thô ®éng trong dung dÞch ®Æc, ng
uéi
VËy cã 3 ph−¬ng tr×nh ph¶n øng hãa häc x¶y ra => ®¸p ¸n B.
NhËn xÐt:
§©y l mét c©u hái t−¬ng ®èi dÔ, nh−ng do nã r¬i vo phÇn kiÕn thøc hãa häc líp 10, nªn rÊt nhiÒu
c¸c em häc sinh quan t©m nhiÒu, nªn sÏ cã sù lóng tóng khi ®−a ra ®¸p ¸n. Nh−ng víi kiÕn thøc líp 12 v ta sÏ
lo¹i ®−îc ý IV, cßn ý II cã thÓ thÊy r»ng nã ®óng dùa vo tÝnh oxi hãa khö, cßn ý III th× khái ph¶i nãi l còng
biÕt nã ®óng, khi ®ã b¹n chØ ph©n v©n ®¸p ¸n B v D.
C©u 3
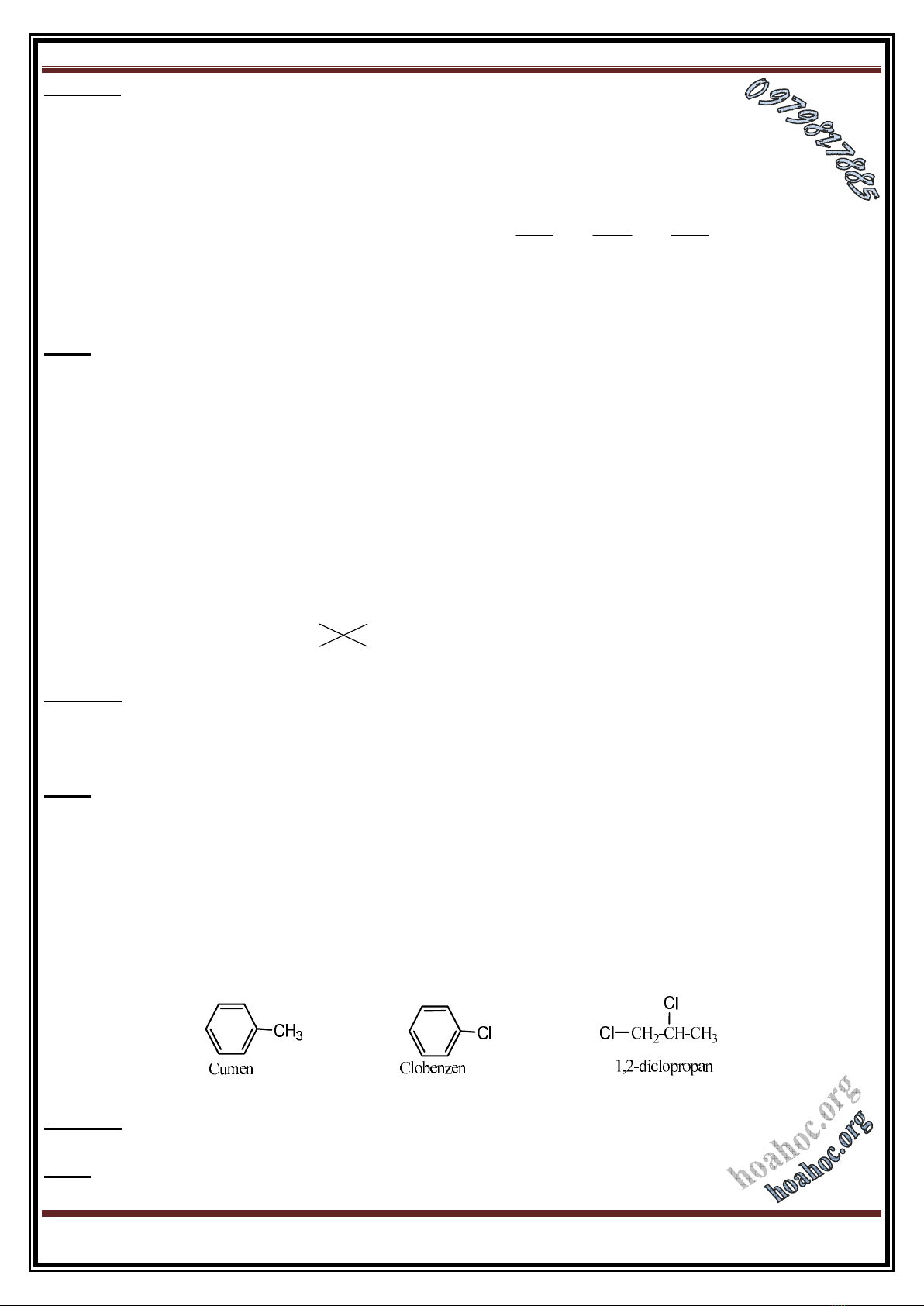
: D:y gåm c¸c chÊt ®Òu cã kh¶ n¨ng tham gia ph¶n øng trïng hîp l:
A. 1,1,2,2tetrafloeten; propilen; stiren; vinyl clorua.
B. buta1,3®ien; cumen; etilen; transbut2en.
C. stiren; clobenzen; isopren; but1en.
D. 1,2®iclopropan; vinylaxetilen; vinylbenzen; toluen.
Gîi ý
: Víi c©u hái ny, c¸c em häc sinh cÇn ghi nhí vÒ ®iÒu kiÖn ®Ó x¶y ra ph¶n øng trïng hîp: “
Ph¶i cã liªn
kÕt ®«i hoÆc cã vßng kh«ng bÒn
” v ph¶i ghi nhí v x¸c ®Þnh ®−îc chÝnh x¸c ®Æc ®iÓm cÊu t¹o cña c¸c chÊt m
®Ò bi cho.
Trong c¸c chÊt ®Ò bi cho th× cã mét sè chÊt kh«ng cã kh¶ n¨ng tham gia ph¶n øng trïng hîp:
VËy khi ®ã ®¸p ¸n A l ®¸p ¸n ®óng. (
ph−¬ng tr×nh ph¶n øng cña c¸c chÊt kia c¸c em tù viÕt ®Ó ghi nhí
)
NhËn xÐt:
§©y l c©u hái t−¬ng ®èi ®¬n gi¶n, kh«ng cã tÝnh chÊt ®¸nh ®è, chñ yÕu l yªu cÇu häc sinh ghi nhí
kiÕn thøc.
C©u 4
: §èt ch¸y hon ton mét hîp chÊt h÷u c¬ X, thu ®−îc 0,351 gam H
2
O v 0,4368 lÝt khÝ CO
2
(ë ®ktc). BiÕt
X cã ph¶n øng víi Cu(OH)
2
trong m«i tr−êng kiÒm khi ®un nãng. ChÊt X l

LỚP BỒI DƯỠNG KIẾN THỨC HÓA HỌC 10, 11, 12 18A/88ĐINH VĂN TẢTP.HẢI DƯƠNG
Để tìm hiểu và đăng kí học, hãy gọi điện tới số
09798.17.8.85
(gặp
Thầy Quỳnh
)
Biên soạn và giảng dạy: Thầy
Ngô Xuân Quỳnh (
E_mail:
hoahoc.org@gmail.com –
Website:
hoahoc.org
)
3
A. CH
3
COCH
3
. B. O=CHCH=O. C. CH
2
=CHCH
2
OH. D. C
2
H
5
CHO.
Gîi ý
: Víi c©u hái ny, khi ®äc ®Ò ta ph¶i ®Õ ý ngay vÒ d÷ kiÖn: “X ph¶n øng víi Cu(OH)
2
trong m«i tr−êng
kiÒm khi ®un nãng” => X sÏ l hîp chÊt chøa nhãm –CHO, khi ®ã ta sÏ lo¹i ngay ®−îc ®¸p ¸n A v C.
Ta cã: 2 2
CO H O
n =0,0195mol v n =0,0195mol
VËy khi ®ã ta sÏ suy ra ngay ®¸p ¸n sÏ l B. (dùa vo sè nguyªn tö H v C trong ph©n tö)
Víi c©u hái ny, chóng ta ph¶i cã sù kÕt hîp gi÷a c¸c ®¸p ¸n ®−a ra v c¸c d÷ kiÖn cña bi to¸n ®Ó ra kÕt qu¶.
C©u 5
: Cho c¸c nguyªn tè: K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). D:y gåm c¸c nguyªn tè ®−îc s¾p
xÕp theo chiÒu gi¶m dÇn b¸n kÝnh nguyªn tö tõ tr¸i sang ph¶i l:
A. N, Si, Mg, K. B. Mg, K, Si, N. C. K, Mg, N, Si. D. K, Mg, Si, N.
Gîi ý
: §©y l mét c©u hái thuéc ch−¬ng tr×nh hãa häc líp 10 – phÇn b¶ng tuÇn hon c¸c nguyªn tè hãa häc.
§Ó cã thÓ xÐt ®−îc, ta cÇn ph¶i s¾p xÕp c¸c nguyªn tè trªn vo trong b¶ng tuÇn hon theo chu k× v nhãm (s¾p
xÕp dùa vo cÊu h×nh electron cña nguyªn tè)
{
{
{
{
2 2 3
7
2 2 6 2
12
2 2 6 2 2
14
2 2 6 2 6 1
19
:1 2 2
:1 2 2 3
:1 2 2 3 3
:1 2 2 3 3 4
chu k× 2 nhãm VA IA
Chu k× 3 nhãm IIA
Chu k× 3 nhãm IVA
Chu k× 4 nhãm IA
→
→ →
→
→
Trong mét chu k×, theo chiÒu t¨ng dÇn ®iÖn tÝch h¹t nh©n th× b¸n kÝnh nguyªn tö gi¶m dÇn
Tuy c¸c nguyªn tö c¸c nguyªn tè cã cïng sè líp electron, nh−ng khi ®iÖn tÝch h¹t nh©n t¨ng, lùc hót gi÷a h¹t nh©n v:
electron ho¸ trÞ ë líp ngo:i cïng còng t¨ng dÇn, l:m b¸n kÝnh nguyªn tö gi¶m dÇn.
Trong mét nhãm theo chiÒu tõ trªn xuèng d−íi, b¸n kÝnh nguyªn tö t¨ng dÇn.
Theo chiÒu tõ trªn xuèng d−íi, sè líp electron t¨ng dÇn, ®iÖn tÝch h¹t nh©n t¨ng dÇn, nh−ng do sè líp electron t¨ng m¹nh
nªn l:m cho b¸n kÝnh nguyªn tö t¨ng dÇn
Qua s¬ ®å miªu t¶ trªn ta nhËn thÊy r»ng ®¸p ¸n D l ®¸p ¸n chÝnh x¸c nhÊt.
NhËn xÐt
: §©y l mét c©u hái kh«ng khã, nh−ng do nã thuéc vo m¶ng kiÕn thøc hãa häc líp 10, nªn sÏ cã
nhiÒu em häc sinh kh«ng ®Ó ý.
C©u 6
: Ph¸t biÓu no sau ®©y l ®óng?
A. Trïng hîp stiren thu ®−îc poli (phenolfoman®ehit).
B. Trïng ng−ng buta1,3®ien víi acrilonitrin cã xóc t¸c Na ®−îc cao su bunaN.
C. Poli (etylen terephtalat) ®−îc ®iÒu chÕ b»ng ph¶n øng trïng ng−ng c¸c monome t−¬ng øng.
D. T¬ visco l t¬ tæng hîp.
Gîi ý :
Víi c©u hái ny chñ yÕu l mang tÝnh chÊt lý thuyÕt, yªu cÇu häc sinh n¾m ®−îc :
C«ng thøc cña c¸c chÊt: Stiren, poli(phenolfomandehit), buta1,3dien, acrilonitrin, poli (etylen terephtalat),
cao su bunaN, to visco
C¸ch viÕt s¶n phÈm ph¶n øng trïng hîp, trïng ng−ng.
Tªn gäi cña polime bao gåm tªn quèc tÕ v tªn th−êng.
+ Trïng hîp Stiren => poli stiren
+ Buta1,3dien + acilonitrin => Cao su bunaN b»ng ph¶n øng trïng hîp
+ Poli (etylen terephtalat) l lo¹i t¬ lapsan ®−îc t¹o ra do ph¶n øng trïng ng−ng gi÷a etylen glicol v axit
tetraphtalic
+ T¬ visco l lo¹i t¬ b¸n tæng hîp hay cßn ®−îc gäi l t¬ nh©n t¹o.
Qua ®ã ®¸p ¸n C l ®¸p ¸n ®óng.
HOOC – – COOH ( axit terephtalic)
nHOOC – C
6
H
4
– COOH + nHO – (CH
2
)
2
– OH (– CO – C
6
H
4
– COO – (CH
2
)
2
– O –)
n
+ nH
2
O
NhËn xÐt:
§©y l mét c©u kh«ng khã

LỚP BỒI DƯỠNG KIẾN THỨC HÓA HỌC 10, 11, 12 18A/88ĐINH VĂN TẢTP.HẢI DƯƠNG
Để tìm hiểu và đăng kí học, hãy gọi điện tới số
09798.17.8.85
(gặp
Thầy Quỳnh
)
Biên soạn và giảng dạy: Thầy
Ngô Xuân Quỳnh (
E_mail:
hoahoc.org@gmail.com –
Website:
hoahoc.org
)
4
C©u 7
: Cho 61,2 gam hçn hîp X gåm Cu v Fe
3
O
4
t¸c dông víi dung dÞch HNO
3
lo:ng, ®un nãng v khuÊy ®Òu.
Sau khi c¸c ph¶n øng x¶y ra hon ton, thu ®−îc 3,36 lÝt khÝ NO (s¶n phÈm khö duy nhÊt, ë ®ktc), dung dÞch Y
v cßn l¹i 2,4 gam kim lo¹i. C« c¹n dung dÞch Y, thu ®−îc m gam muèi khan. Gi¸ trÞ cña m l
A. 151,5. B. 97,5. C. 137,1. D. 108,9.
Gîi ý: ta cã: n
NO
= 0,15 mol v ta chó ý vÒ cÆp oxi hãa khö:
2 2 3
2
+ + +
+
Qua d÷ kiÖn bi ra, ta nhËn sÏ cã : 2,4 gam kim lo¹i ch−a ph¶n øng ®ã l Cu v Fe
3
O
4
t¹o thnh Fe(NO
3
)
2
.
5 2
0,45 0,15
28
2
3
2
3 2 3
3
2
3 2 3
+ +
+
+
+
+ →
− →
+ →
Gäi x, y lÇn l−ît l sè mol Cu v Fe
3
O
4
tham gia ph¶n øng.
¸p dông ®Þnh luËt b¶o ton nguyªn tè v b¶o ton electron ta sÏ cã:
64 2,4 232 61,2 0,375
2 2 0,45 0,15
+ + = =
→
= + =
VËy khèi l−îng muèi thu ®−îc sau ph¶n øng l: 0,375.(64 + 62.2) + 0,15.3.(56 + 62.2) = 151,5 gam
NhËn xÐt:
§©y l mét bi cã thÓ nãi l t−¬ng ®èi l khã, nã ®ßi hái sù t− duy cao v cã kh¶ n¨ng kh¸i qu¸t hãa,
tæng hîp c¸c kiÕn thøc ®Ó lm.
SÏ cã nhiÒu em häc sinh quªn ph¶n øng gi÷a cÆp oxi hãa khö
2 3
2
+ +
+
C©u 8
: Khi nhiÖt ph©n hon ton tõng muèi X, Y th× ®Òu t¹o ra sè mol khÝ nhá h¬n sè mol muèi t−¬ng øng. §èt
mét l−îng nhá tinh thÓ Y trªn ®Ìn khÝ kh«ng mu, thÊy ngän löa cã mu vng. Hai muèi X, Y lÇn l−ît l:
A. KMnO
4
, NaNO
3
. B. Cu(NO
3
)
2
, NaNO
3
. C. CaCO
3
, NaNO
3
. D. NaNO
3
, KNO
3
.
Gîi ý
:
Ta cã c¸c ph−¬ng tr×nh ph¶n øng nhiÖt ph©n muèi:
4 2 4 2 2
3 2 2
3 2 2 2
3 2
3 2 2
2(1)
2 2
(2)
2 ( ) 2 4 (3)
(4)
(5)
2 2
→ + +
→ +
→ + +
→ +
→ +
Qua c¸c ph−¬ng tr×nh trªn ta thÊy r»ng ph−¬ng tr×nh (1), (2) v (5) l c¸c ph−¬ng tr×nh cã sè mol khÝ nhá h¬n sè
mol cña muèi.
=> lo¹i ®¸p ¸n B v C v cã hai ®¸p ¸n cÇn lùa chän l A v D.
+ Tinh thÓ Y khi ®èt trªn ®Ìn khÝ kh«ng my l¹i cã thÊy ngän löa mu vng => tinh thÓ Y ph¶i l muèi chøa ion
kim lo¹i Na => lo¹i ®¸p ¸n D
VËy ®¸p ¸n chÝnh x¸c l ®¸p ¸n A
C©u 9
: Hçn hîp X gåm axit Y ®¬n chøc v axit Z hai chøc (Y, Z cã cïng sè nguyªn tö cacbon). Chia X thnh
hai phÇn b»ng nhau. Cho phÇn mét t¸c dông hÕt víi Na, sinh ra 4,48 lÝt khÝ H
2
(ë ®ktc). §èt ch¸y hon ton phÇn
hai, sinh ra 26,4 gam CO
2
. C«ng thøc cÊu t¹o thu gän v phÇn tr¨m vÒ khèi l−îng cña Z trong hçn hîp X lÇn
l−ît l
A. HOOCCH
2
COOH v 70,87%. B. HOOCCOOH v 60,00%.
C. HOOCCH
2
COOH v 54,88%. D. HOOCCOOH v 42,86%.
Gîi ý
:
Ta cã
2
0,02 0,06
2
CO
v n
= =
(
)
(
)
2 2
22
2 2 2
2
/ 2
+ + +
+
→ →

LỚP BỒI DƯỠNG KIẾN THỨC HÓA HỌC 10, 11, 12 18A/88ĐINH VĂN TẢTP.HẢI DƯƠNG
Để tìm hiểu và đăng kí học, hãy gọi điện tới số
09798.17.8.85
(gặp
Thầy Quỳnh
)
Biên soạn và giảng dạy: Thầy
Ngô Xuân Quỳnh (
E_mail:
hoahoc.org@gmail.com –
Website:
hoahoc.org
)
5
2
0,02
1,5 3 2
2
0,06
2
CO
(1)
n (2) (víi n l sè nguyªn tö C trong axit)
= + =
→ < < => =
= + =
VËy axit Y: CH
3
COOH v axit Z: HOOCCOOH
Thay vo (1), (2)
x = 0,02 , y = 0,01
− = =
+
NhËn xÐt:
§©y l mét bi tËp tÝnh to¸n t−¬ng ®èi ®¬n gi¶n, nã kh¸ quen thuéc víi d¹ng ¸p dông ph−¬ng ph¸p
trung b×nh
C©u 10
: D:y gåm c¸c chÊt ®−îc s¾p xÕp theo chiÒu t¨ng dÇn nhiÖt ®é s«i tõ tr¸i sang ph¶i l:
A. CH
3
CHO, C
2
H
5
OH, HCOOH, CH
3
COOH. B. CH
3
COOH, HCOOH, C
2
H
5
OH, CH
3
CHO.
C. HCOOH, CH
3
COOH, C
2
H
5
OH, CH
3
CHO D. CH
3
COOH, C
2
H
5
OH, HCOOH, CH
3
CHO.
Gîi ý:
Ta dùa vo kh¶ n¨ng liªn kÕt hidro ®Ó s¾p xÕp.
ChÊt no cã liªn kÕt hidro cng m¹nh th× cng cã nhiÖt ®é s«i cao nhÊt:
o o o
s (axit) s (ancol) s (andehit)
t > t > t
M cng lín th× nhiÖt ®é s«i cng lín.
VËy ®¸p ¸n l A.
C©u 11
: Cho dung dÞch chøa 6,03 gam hçn hîp gåm hai muèi NaX v NaY (X, Y l hai nguyªn tè cã trong tù
nhiªn, ë hai chu k× liªn tiÕp thuéc nhãm VIIA, sè hiÖu nguyªn tö Z
X
< Z
Y
) vo dung dÞch AgNO
3
(d−), thu ®−îc
8,61 gam kÕt tña. PhÇn tr¨m khèi l−îng cña NaX trong hçn hîp ban ®Çu l
A. 58,2%. B. 52,8%. C. 41,8%. D. 47,2%.
Gîi ý:
Gi¶ sö hai muèi NaX v NaY ®Òu t¹o kÕt tña víi AgNO
3
=> C«ng thøc chóng cho hai muèi:
3 3
23 108
(23 ) ) 175,66
6,03 8,61
6,03
(108+X
8,61
+ → + + +
+ → = => =
Kh«ng cã halogen tho¶ m¶n
→
cã NaF (AgF kh«ng kÕt tña) cßn l¹i NaCl
Ta dÔ dng tÝnh ®−îc: n
NaCl
= n
AgCl
= 0,06
→
%m
NaF
=
−
=
C©u 12:
Hßa tan hon ton 20,88 gam mét oxit s¾t b»ng dung dÞch H
2
SO
4
®Æc, nãng thu ®−îc dung dÞch X v
3,248 lÝt khÝ SO
2
(s¶n phÈm khö duy nhÊt, ë ®ktc). C« c¹n dung dÞch X, thu ®−îc m gam muèi sunfat khan. Gi¸
trÞ cña m l
A. 52,2. B. 48,4. C. 54,0. D. 58,0.
Gîi ý
:
2
0,145
=
+ C¸ch 01
: §¹i sè + b¶o ton electron
Fe
x
O
y
: a mol
xFe
+2y/x
D (3x – 2y)e
→
xFe
+3
ax a(3x – 2y)
S
+6
+ 2e
→
S
+4
0,29 0,145
(3x 2y)a = 0,29
x = y
(56x + 16y)a = 20,88
→
Oxit sắt: FeO; số mol FeO = 20,88/72 = 0,29 mol
=> Số mol : Fe
2
(SO
4
)
3
= 0,29/2 = 0,145 mol
m = 0,145. 400 = 58,0
+ C¸ch 02
: ¸p dông ph−¬ng ph¸p quy ®æi
Qui Fe
x
O
y
thnh Fe v O
Cho : Fe 3e
Fe
3+
. NhËn: O + 2e
O
2
v S
+6
+ 2e
S
+4
x 3x x y 2y 0,29 0,145






















![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



