
Y Học TP. Hồ Chí Minh * Tập 24 * Số 3 * 2020
Nghiên cứu
B – Khoa học Dược
17
NGHIÊN CỨU TỔNG HỢP CÁC DẪN CHẤT
N’-(1-PHENYLETHYLIDEN) BENZOFURAN-2-CARBOHYDRAZID
Thái Minh Quân*, Nguyễn Đức Tri Thức*, Phạm Ngọc Tuấn Anh*
TÓM TẮT
Đặt vấn đề: Các nghiên cứu trước cho thấy dẫn chất acid carboxylic của 2-salicyloylbenzofuran sở hữu hoạt
tính kháng MRSA với MIC = 32–1024 µg/mL, đặc biệt cho tác động hiệp đồng kháng MRSA khi phối hợp với
gentamicin, ciprofloxacin (FICI = 0,375–1,0). Bên cạnh đó, dẫn chất hydrazid-hydrazon cũng thể hiện nhiều hoạt
tính sinh học tiềm năng, đặc biệt kháng khuẩn, kháng lao, kháng nấm, kháng ký sinh trùng sốt rét. Trên cơ sở đó,
dẫn chất N’-(1-phenylethyliden)benzofuran-2-carbohydrazid được nghiên cứu quy trình tổng hợp nhằm tạo tiền
đề cho việc mở rộng tổng hợp và đánh giá hoạt tính kháng S. aureus trong các nghiên cứu tiếp theo.
Đối tượng - phương pháp nghiên cứu: dẫn chất N’-(1-phenylethyliden)benzofuran-2-carbohydrazid được
tổng hợp dựa trên phản ứng ngưng tụ giữa 5,7-dibromobenzofuran-2-carbohydrazid và dẫn chất acetophenon
theo quy trình 4 bước. Các chất tổng hợp được tinh chế và xác định cấu trúc bằng phổ MS và 1H-NMR.
Kết quả: Tổng hợp được 10 dẫn chất N’-(1-phenylethyliden)benzofuran-2-carbohydrazid với hiệu suất của
mỗi bước 60
–
90%. Các sản phẩm tổng hợp cho kết quả phổ MS và 1H-NMR phù hợp với cấu trúc dự kiến. Kết
quả phổ 1H-NMR có hiện tượng cho tín hiệu đôi của proton CONH chứng tỏ các dẫn chất 7a–h trong dung dịch
DMSO-d6 tồn tại ở 2 cấu dạng anti-E (chính) và syn-E (phụ), trong khi 2 dẫn chất 7i và 7k chỉ ở dạng anti-E.
Kết luận: 10 dẫn chất N’-(1-phenylethyliden)benzofuran-2-carbohydrazid đã được tổng hợp thành công
theo quy trình 4 bước. Trong dung dịch DMSO-d6, các dẫn chất này tồn tại ở 2 kiểu cấu dạng anti-E và
syn-E. Sự hình thành cũng như độ bền của liên kết hydro nội phân tử giữa nitơ C=N và proton 2’–OH làm
tăng độ bền của cấu dạng anti-E. Những kết quả trên là tiền đề để tổng hợp thêm các dẫn chất benzofuran-2-
carbohydrazid hướng tới đánh giá hoạt tính kháng S. aureus trong các nghiên cứu tiếp theo.
Từ khóa: benzofuran-2-carbohydrazid, benzofuran, hydrazid, hydrazon, Staphylococcus aureus, MRSA
ABSTRACT
STUDY ON SYNTHESIS OF N’-(1-PHENYLETHYLIDENE) BENZOFURAN-2-CARBOHYDRAZIDES
Thai Minh Quan, Nguyen Duc Tri Thuc, Pham Ngoc Tuan Anh
* Ho Chi Minh City Journal of Medicine * Vol. 24 - No. 3 - 2020: 17 - 23
Introduction: Previous studies have shown that the carboxylic acid derivatives of 2-
salicyloylbenzofuran possess anti-MRSA activity with MIC = 32–1024 µg/mL, especially for the synergistic
effect against MRSA when combined with gentamicin, and ciprofloxacin (FICI = 0.375–1.0). In addition,
hydrazide-hydrazone derivatives also exhibit many potential biological activities, especially antibacterial,
antituberculosis, antifungal, and antimalarial effect. On that basis, the N'-(1-phenylethylidene)benzofuran-
2-carbohydrazides were studied for the synthetic process to pave the way for further synthesis of benzofuran-
2-carbohydrazide derivatives towards the evaluation of anti-S. aureus activity in subsequent studies.
Method: N’-(1-phenylethylidene)benzofuran-2-carbohydrazides were synthesized by the condensation
reaction between 5,7-dibromobenzofuran-2-carbohydrazide and acetophenone derivatives via a 4-step process. The
synthesized compounds were characterized by using MS and 1H-NMR spectral techniques.
Results: 10 derivatives of N’-(1-phenylethylidene)benzofuran-2-carbohydrazide were successfully
*Khoa Dược, Đại học Y Dược Thành phố Hồ Chí Minh
**Tác giả liên lạc: TS. Phạm Ngọc Tuấn Anh ĐT: 0909704 081 Email: pnta@ump.edu.vn
Nghiên cứu
Y Học TP. Hồ Chí Minh * Tập 24 * Số 3 * 2020
18
synthesized via a 4-step process with the yield of steps ranging 60 – 90%. The structures of synthesized products
that characterized by MS and 1H-NMR spectra, are consistent with the target compounds. 1H-NMR spectral data
of hydrazide-hydrazone 7a–h have unambiguously revealed the presence of duplicated signals of proton CONH as
a mixture of two conformers anti-E (major) and syn-E (minor) in DMSO-d6 solution whereas product 7i and 7k
only exit in anti-E form.
Conclusion: In this study, 10 derivatives of N’-(1-phenylethylidene)benzofuran-2-carbohydrazide were
successfully synthesized via a 4-step process. In DMSO-d6 solution, these derivatives exit in two conformers
anti-E (major) and syn-E (minor). It was concluded that the formation as well as the strength of
intramolecular hydrogen bond (IMHB) between the nitrogen atom of the imino group and the proton of the
2-hydroxy group enhanced the stabilization of the anti-E conformer. The results of this study will be a
premise for further synthesis of benzofuran-2-carbohydrazide derivatives towards the evaluation of anti-S.
aureus activity in subsequent studies.
Keywords: benzofuran-2-carbohydrazide, benzofuran, hydrazide, hydrazone, Staphylococcus aureus, MRSA
ĐẶT VẤN ĐỀ
Staphylococcus aureus kháng methicillin
(MRSA) là tác nhân chính gây các bệnh nhiễm
khuẩn nguy hiểm trên da, mô mềm, xương,
đường hô hấp và máu(1). Việc nhiễm vi
khuẩn này hiện là vấn đề nghiêm trọng trên
lâm sàng với tỉ lệ mắc cũng như tử vong
cao(1). Do đó việc kiểm soát, điều trị, cũng
như tìm kiếm thuốc kháng sinh mới kháng
MRSA được xác định là nhiệm vụ cấp bách của
hệ thống y tế trên toàn thế giới(1). Các nghiên
cứu trước cho thấy dẫn chất acid carboxylic
của 2-salicyloylbenzofuran sở hữu hoạt tính
kháng MRSA với MIC = 32 - 1024 µg/mL(2), đặc
biệt cho tác động hiệp đồng kháng MRSA
khi phối hợp với gentamicin, ciprofloxacin
(FICI = 0,375 - 1,0)(3). Bên cạnh đó, dẫn chất
hydrazid-hydrazon cũng thể hiện nhiều
hoạt tính sinh học tiềm năng, đặc biệt kháng
khuẩn, kháng lao, kháng nấm, kháng ký
sinh trùng sốt rét(4). Trên cơ sở đó, dẫn chất
N’-(1-phenylethyliden)benzofuran-2-carbohydrazid
được nghiên cứu quy trình tổng hợp nhằm tạo
tiền đề cho việc mở rộng tổng hợp và đánh giá
hoạt tính kháng S. aureus trong các nghiên cứu
tiếp theo.
ĐỐI TƯỢNG - PHƯƠNG PHÁP NGHIÊN CỨU
Đối tượng nghiên cứu
Đối tượng nghiên cứu của đề tài là các dẫn
chất N’-(1-phenylethyliden)benzofuran-2-
carbohydrazid (7a-k).
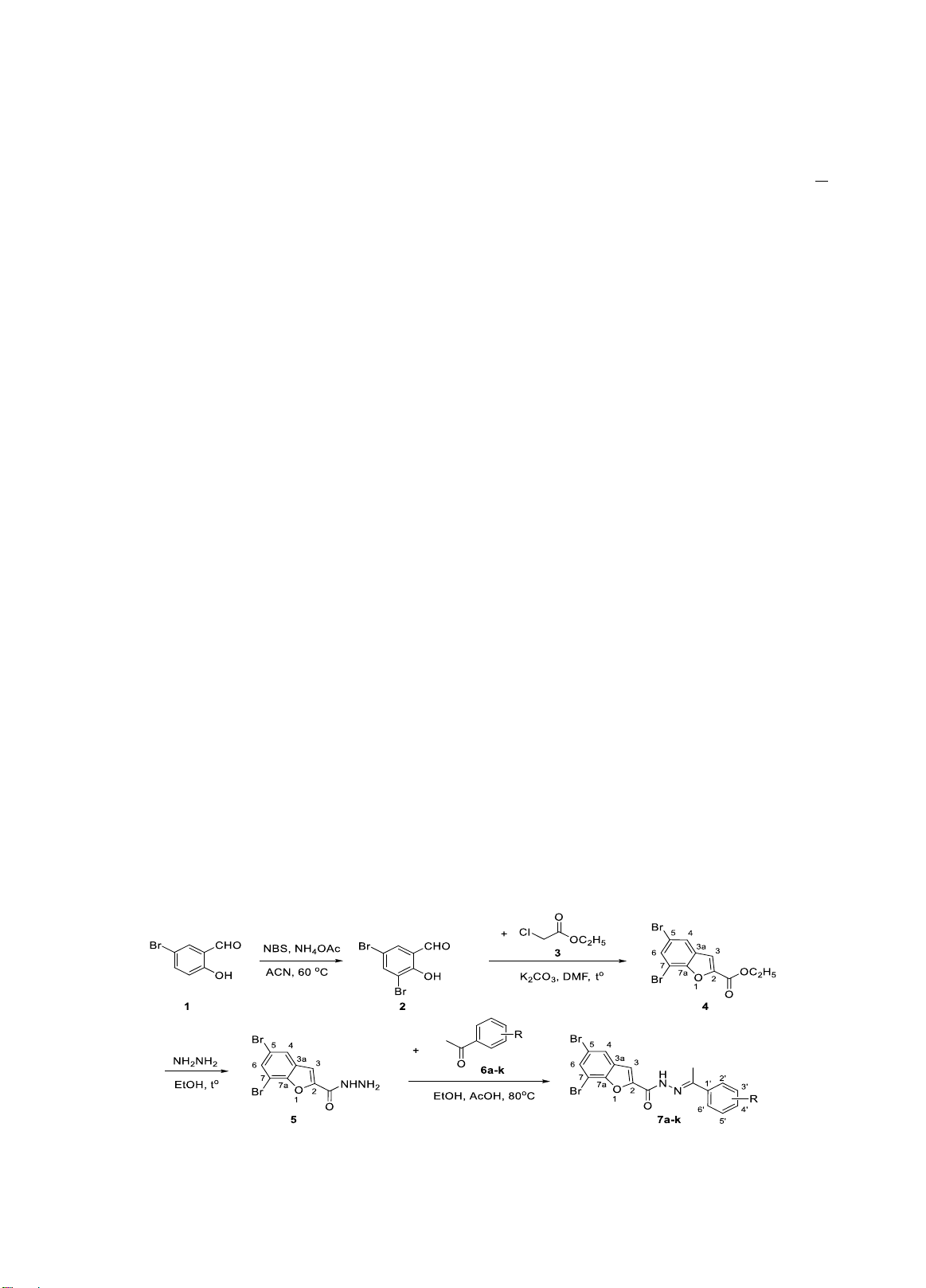
Phương pháp tổng hợp hóa học
Các dẫn chất N’-(1-phenylethyliden)
benzofuran-2-carbohydrazid (7a-k) được tổng
hợp từ dẫn chất acetophenon (6a-k) ngưng tụ với
5,7-dibromobenzofuran-2-carbohydrazid (5)(5,6)
theo Hình 1.
Hình 1. Tổng hợp dẫn chất N’-(1-phenylethyliden)benzofuran-2-carbohydrazid (7a-k)

Y Học TP. Hồ Chí Minh * Tập 24 * Số 3 * 2020
Nghiên cứu
B – Khoa học Dược
19
Tổng hợp 3,5-dibromosalicylaldehyd (2)
Cho từ từ N-bromosuccinimid (NBS) (2,12 g,
11,94 mmol) vào bình cầu 1 cổ 100 mL đã có sẵn
5-bromosalicylaldehyd (1) (2,00 g, 9,95 mmol) và
amoni acetat (0,08 g, 1 mmol) trong acetonitril
(30 mL). Khuấy hỗn hợp phản ứng ở nhiệt
độ 50 0C trong 1 giờ. Sau đó, thêm 10 ml nước
vào hỗn hợp phản ứng để kết thúc phản ứng.
Chiết bằng dicloromethan (DCM) và rửa lại với
nước (10 mL x 3 lần). Tách riêng phần dung môi
hữu cơ, làm khan bằng Na2SO4 và bốc hơi dung
môi bằng máy cô quay áp suất giảm thu được
sản phẩm thô. Phân tán sản phẩm thô trong
nước đá, lọc, sấy sản phẩm trong tủ sấy chân
không(5).
Tổng hợp ethyl 5,7-dibromobenzofuran-2-
carboxylat (4)
Cho 3,5-dibromosalicylaldehyd (2) (0,28 g,
1 mmol) và ethyl cloroacetat (3) (0,24 g, 2 mmol)
vào bình cầu 2 cổ 100 mL. Hòa tan hỗn hợp
trong dimethylacetamid (DMAc) (2 mL) rồi
thêm kali carbonat (0,27 g, 2 mmol) vào hỗn
hợp phản ứng. Lắp sinh hàn, khuấy đều đun
hồi lưu ở nhiệt độ 100 oC, theo dõi phản ứng
bằng sắc ký lớp mỏng (SKLM) với hệ dung
môi DCM-n-hexan (1:1). Sau đó, thêm 10 ml
nước vào bình phản ứng để kết thúc phản ứng.
Chiết bằng DCM (5 mL x 3 lần) và rửa lại với
nước (10 mL x 2 lần). Tách riêng phần dung môi
hữu cơ, làm khan bằng Na2SO4 và bốc hơi dung
môi bằng máy cô quay áp suất giảm thu được
dung dịch sánh màu vàng nâu. Tinh chế bằng
sắc kí cột với hệ dung môi DCM-n-hexan (1:2)(6).
Tổng hợp 5,7-dibromobenzofuran-2-
carbohydrazid (5)
Hòa tan ethyl 3,5-dibromobenzofuran-2-
carboxylat (4) (1,00 g, 2,89 mmol) với ethanol
(12 mL) trong bình cầu 1 cổ 100 mL. Sau đó cho
hydrazin hydrat (0,14 g, 2,89 mmol) vào hỗn hợp
phản ứng. Lắp sinh hàn, khuấy đều, đun hồi lưu
ở nhiệt độ 70 - 80 oC trong 1,5 giờ. Thêm nước
(20 mL) vào bình phản ứng để kết thúc phản
ứng. Làm lạnh trong nước đá để sản phẩm kết
tinh trong 30 phút. Lọc hỗn hợp phản ứng
dưới áp suất giảm để lấy tủa. Rửa bằng ethanol
(10 mL x 3 lần), sau đó rửa lại bằng 10 mL hỗn
hợp DCM-n-hexan tỉ lệ 1:1. Sấy sản phẩm
trong tủ sấy chân không(6).
Tổng hợp dẫn chất N’-(1-
phenylethyliden)benzofuran-2-carbohydrazid
(7a-k)
Lấy 5,7-dibromobenzofuran-2-carbohydrazid
(5) (0,15 g, 0,45 mmol) và dẫn chất acetophenon
(6a-k) (0,45 mmol) cho vào bình cầu 2 cổ 100 mL.
Tiếp tục thêm ethanol (5 mL) và acid acetic băng
(2 giọt) vào hỗn hợp phản ứng. Lắp sinh hàn,
khuấy hỗn hợp phản ứng ở nhiệt độ 80 oC Theo
dõi phản ứng bằng sắc kí lớp mỏng với hệ dung
môi DCM-MeOH (100:1). Khi phản ứng kết thúc,
thêm nước (20 mL) vào bình phản ứng để kết
thúc phản ứng. Làm lạnh trong nước đá để sản
phẩm kết tinh trong 30 phút. Lọc hỗn hợp phản
ứng dưới áp suất giảm để lấy tủa. Rửa tủa bằng
ethanol (5 mL x 2 lần) và hỗn hợp dung môi
DCM-n-hexan (1:3) (5 mL x 2 lần). Sấy sản phẩm
trong tủ sấy chân không để thu được sản phẩm
tinh khiết(6).
Phương pháp xác định cấu trúc sản phẩm
Các sản phẩm tổng hợp được kiểm tra độ
tinh khiết bằng SKLM trên bản mỏng silica gel
60 F254 (Merck 60F 254, Darmstadt, Đức), đo
nhiệt độ nóng chảy bằng máy Gallenkamp
(Sanyo Gallenkamp, Southborough, Anh). Cấu
trúc sản phẩm được xác định bằng phổ khối
(MS) trên máy Shimadzu LCMS-IT-TOF
(Shimadzu Scientific Instruments, Kyoto,
Nhật) và phổ cộng hưởng từ hạt nhân proton
(1H-NMR) trên máy Bruker Avance 500 MHz
(Bruker Corporation, Billerica, MA, USA). Các
từ viết tắt được sử dụng trong biện giải phổ
1H-NMR: singlet (s), broad singlet (brs),
doublet (d), broad doublet (brd), apparent
doublet (app d), triplet (t), apparent triplet
(app t), doublet of doublets (dd), multiplet (m),
broad multiplet (brm).

Nghiên cứu
Y Học TP. Hồ Chí Minh * Tập 24 * Số 3 * 2020
20
KẾT QUẢ
Tổng hợp 3,5-dibromosalicylaldehyd (2)
Phản ứng tổng hợp 3,5-
dibromosalicylaldehyd diễn ra trong 60 phút.
Kết quả thu được 2,4 g sản phẩm, hiệu suất 86%.
Tính chất của sản phẩm
Chất rắn màu vàng sậm, tan tốt trong DCM,
ethyl acetat, không tan trong n-hexan, petroleum
ether (PE). Nhiệt độ nóng chảy: 75 - 80 oC. SKLM:
Rf = 0,47 (hexan - DCM (2:1)); 0,61 (PE - EtOH
(3:1)). Sản phẩm đều phù hợp với chất chuẩn về
cảm quan, nhiệt độ nóng chảy (79 - 81 oC) và
SKLM.
Tổng hợp ethyl 5,7-dibromobenzofuran-2-
carboxylat (4)
Phản ứng tổng hợp ethyl 5,7-
dibromobenzofuran-2-carboxylat (4) diễn ra
trong 5 giờ. Kết quả sau khi tinh chế bằng sắc kí
cột thu được 0,21 g sản phẩm tinh khiết, hiệu
suất 60%.
Tính chất của sản phẩm
Chất rắn màu trắng, tan tốt trong DCM,
ethyl acetat, không tan trong n-hexan, PE. MP:
110 - 113 oC. SKLM: Rf = 0,4 (hexan - DCM (2:1));
0,6 (n-hexan–EtOAc (4:1)).
Kết quả phổ MS và 1H-NMR
Nhiệt độ nóng chảy (ESI) m/z: 370,8798
[M+Na]+, tính toán 370,8717 (C11H8Br2O3Na). 1H-
NMR (500 MHz, CDCl3) δ (ppm): 7,76 (d, 1H,
J = 1,5 Hz, H-4); 7,74 (d, 1H, J = 1,5 Hz, H-6); 7,50
(s, 1H, H-3); 4,46 (q, 2H, J = 7,0 Hz, CH2); 1,43
(t, 3H, J = 7,0 Hz, CH3).
Tổng hợp 5,7-dibromobenzofuran-2-
carbohydrazid (5)
Phản ứng tổng hợp dẫn chất 5 diễn ra trong
thời gian 2 giờ. Thu được 0,85 g sản phẩm, hiệu
suất 86%.
Tính chất của sản phẩm
Chất rắn màu trắng, tan tốt trong
dimethylsulfoxid (DMSO), kém tan trong
DCM, ethyl acetat, methanol, không tan
trong n-hexan, PE. MP: 255–258 oC. SKLM: Rf = 0,4
(PE–CHCl3–aceton (3,5:3,5:1)); 0,4 (n-hexan–
EtOAc (4:1)).
Kết quả phổ MS và 1H-NMR: MS (ESI) m/z
332,8685 [M-H]–, tính toán 332,8697
(C9H5Br2N2O2). 1H-NMR (500 MHz, DMSO-d6) δ
(ppm): 10,14 (s, 1H, NH); 8,03 (d, 1H, J = 2,0 Hz,
H-4); 7,89 (d, 1H, J = 1,5 Hz, H-6); 7,58 (s, 1H,
H-3); 4,63 (s, 2H, NH2).
Tổng hợp dẫn chất N’-(1-
phenylethyliden)benzofuran-2-carbohydrazid
(7a-k)
Các sản phẩm 7a-k thu được ở dạng chất rắn
kết tinh, màu trắng đến vàng nhạt, dễ tan trong
DMSO, tan được trong DCM, ethyl acetat, không
tan trong n-hexan, PE. Kết quả tổng hợp được
trình bày trong Bảng 1.
Bảng 1. Kết quả tổng hợp N’-(1-phenylethyliden)benzofuran-2-carbohydrazid (7a-k)
Sản phẩm
R
Thời gian phản ứng
(giờ)
Hiệu suất
(%)
Nhiệt độ nóng chảy
(oC)
SKLM
Rf (hệ dung môi)a
7a
H
31
76
184–188
0,45 (A); 0,6 (C); 0,34 (D)
7b
4’–Br
18
68
243–245
0,58 (A); 0,28 (B); 0,68 (C)
7c
3’–CH3
32
75
175–177
0,55 (A) ; 0,66 (C); 0,40 (D)
7d
2’–Cl
32
74
170–173
0,43 (A); 0,37 (B); 0,69 (C)
7e
2’–Br
30
60
165–168
0,50 (A); 0,47 (B); 0,68 (C)
7f
3’–Br
27
88
220–224
0,58 (A); 0,32 (B); 0,65 (C)
7g
3’–OCH3
38
78
190–193
0,40 (A); 0,40 (C); 0,20 (D)
7h
4’–OCH3
73
90
179–182
0,3 (A); 0,15 (B); 0,60 (C)
7i
2’–OH; 5’–CH3
33
75
180–182
0,50 (A); 0,51 (C); 0,45 (D)
7k
2’–OH; 5’–Br
90
65
275–278
0,7 (A); 0,48 (C); 0,50 (D)
aHệ dung môi: A = DCM–MeOH (100:1); B = PE–EtOAc (3:1); C = PE–CHCl3–aceton (3,5:3,5:1); D = DCM

Y Học TP. Hồ Chí Minh * Tập 24 * Số 3 * 2020
Nghiên cứu
B – Khoa học Dược
21
Kết quả phổ MS và 1H-NMR
Sản phẩm 7a
MS (ESI) m/z: 436,9254 [M+H]+, tính toán
436,9323 (C17H13Br2N2O2); 434,9068 [M-H]–, tính
toán 434,9167 (C17H11Br2N2O2). 1H-NMR (500
MHz, DMSO-d6) δ (ppm): 11,01 (brs) và 11,02
(brs) (1H, NH); 8,12 (s, 1H, H-4); 7,95 (d, 1H, J =
2,0 Hz, H-6); 7,88 (m, 3H, H-3, H-2’, H-6’); 7,46
(m, 3H, H-3’, H-4’, H-5’); 2,50 (s, 3H, CH3).
Sản phẩm 7b
MS (ESI) m/z: 514,8666 [M+H]+, tính toán
514,8428 (C17H12Br3N2O2); 512,8107 [M-H]–,
tính toán 512,8272 (C17H10Br3N2O2). 1H-NMR
(500 MHz, DMSO-d6) δ (ppm): 11,30 (brs) và
11,05 (brs) (1H, NH); 8,12 (brs, 1H, H-4); 7,94 (d,
1H, J = 1,5 Hz, H-6); 7,87 (brs, 1H, H-3); 7,81 (brd,
2H, J = 7,0 Hz, H-2’, H-6’); 7,65 (d, 2H, J = 8,5 Hz,
H-3’, H-5’); 2,39 (s, 3H, CH3).
Sản phẩm 7c
MS (ESI) m/z: 450,9376 [M+H]+, tính toán
450,9480 (C18H15Br2N2O2); 448,9158 [M-H]–, tính
toán 448,9323 (C18H13Br2N2O2). Phổ 1H-NMR (500
MHz, DMSO-d6) δ (ppm): 11,19 (brs) và 11,01
(brs) (1H, NH); 8,11 (brs, 1H, H-4); 7,94 (d, 1H, J
= 1,5 Hz, H-6); 7,87 (s, 1H, H-3); 7,68–7,65 (brm,
2H, H-2’, H-6’); 7,34 (t, 1H, J = 8,0 Hz, H-5’); 7,27
(brd, 1H, J = 7,5 Hz, H-4’); 2,39 (brs, 3H, N=C–
CH3); 2,37 (s, 3H, C=C-CH3).
Sản phẩm 7d
MS (ESI) m/z: 470,8812 [M+H]+, tính toán
470,8934 (C17H12Br2ClN2O2). 1H-NMR (500 MHz,
DMSO-d6) δ (ppm): 11,29 (brs) và 11,07 (brs) (1H,
NH); 8,09 (s, 1H, H-4); 7,93 (s, 1H, H-6); 7,89 (brs,
1H, H-3); 7,54 (d, 1H, J = 7,5 Hz, H-6’); 7,48–7,42
(m, 3H, H-3’, H-4’, H-5’); 2,38 (s, 3H, CH3).
Sản phẩm 7e
MS (ESI) m/z: 514,8344 [M+H]+, tính toán
514,8428 (C17H12Br3N2O2); 512,8107 [M-H]–, tính
toán 512,8272 (C17H10Br3N2O2). 1H-NMR (500
MHz, DMSO-d6) δ (ppm): 11,29 (brs) và 11,07
(brs) (1H, NH); 8,10 (s, 1H, H-4); 7,94 (s, 1H, H-
6); 7,90 (brs, 1H, H-3); 7,71 (d, 1H, J = 8,0 Hz, H-
6’); 7,49–7,47 (m, 2H, H-3’, H-5’); 7,39–7,36 (m,
1H, H-4’); 2,37 (s, 3H, CH3).
Sản phẩm 7f
MS (ESI) m/z: 514,8431 [M+H]+, tính toán
514,8428 (C17H12Br3N2O2); 512,8214 [M-H]–, tính
toán 512,8272 (C17H10Br3N2O2). 1H-NMR (500
MHz, DMSO-d6) δ (ppm): 11,30 (brs) và 11,09
(brs) (1H, NH); 8,09 (d, 1H, J = 1,5 Hz, H-4); 8,01
(brs, 1H, H-2’); 7,93 (d, 1H, J = 1,5 Hz, H-6); 7,88
(brs, 1H, H-3); 7,85 (d, 1H, J = 8,0 Hz, H-6’); 7,64
(d, 1H, J = 8,0 Hz, H-4’) 7,42 (app t, 1H, J = 8,0 Hz,
H-5’); 2,39 (s, 3H, CH3).
Sản phẩm 7g
MS (ESI) m/z: 466,9345 [M+H]+, tính toán
466,9429 (C18H15Br2N2O3); 464,9224 [M-H]–, tính
toán 464,9272 (C18H13Br2N2O3). 1H-NMR (500
MHz, DMSO-d6) δ (ppm): 11,25 (brs) và 11,05 (brs)
(1H, NH); 8,11 (d, 1H, J = 1,0 Hz, H-4); 7,94 (d, 1H,
J = 1,5 Hz, H-6); 7,88 (s, 1H, H-3); 7,43–7,37 (m, 3H,
H-2’, H-5’, H-6’); 7,04 (brd, 1H, J = 7,0 Hz, H-4’);
3,82 (s, 3H, OCH3); 2,40 (s, 3H, CH3).
Sản phẩm 7h
MS (ESI) m/z: 466,9326 [M+H]+, tính toán
466,9429 (C18H15Br2N2O3); 464,9141 [M-H]–, tính
toán 464,9272 (C18H13Br2N2O3). 1H-NMR (500
MHz, DMSO-d6) δ (ppm): 11,15 (brs) và 10,97
(brs) (1H, NH); 8,11 (brs, 1H, H-4); 7,94 (d, 1H, J
= 1,5 Hz, H-6); 7,85 (s, 1H, H-3); 7,83 (brs, 2H, H-
2’, H-6’); 7,02–6,99 (app d, 2H, J = 9,0 Hz, H-3’, H-
5'); 3,81 (s, 3H, OCH3); 2,36 (s, 3H, CH3).
Sản phẩm 7i
MS (ESI) m/z: 462,9285 [M-H]–, tính toán
462,9293 (C17H13Br2N2O3). Phổ 1H-NMR (500
MHz, DMSO-d6) δ (ppm): 12,78 (s, 1H, OH);
11,58 (s, 1H, NH); 8,13 (d, 1H, J = 1,0 Hz, H-4);
7,97 (d, 1H, J = 2,0 Hz, H-6); 7,95 (s, 1H, H-3); 7,46
(s, 1H, H-6’); 7,14 (d, 1H, J = 7,5 Hz, H-4’); 6,82 (d,
1H, J = 8,5 Hz, H-3’); 2,50 (s, 3H, N=C–CH3); 2,28
(s, 3H, C=C-CH3).























![Giáo trình Bệnh học nội khoa - Trường Cao đẳng Y dược Hà Nội [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251209/laphong0906/135x160/51721770719192.jpg)


