
Page 1 of 11
NƯỚC NỒI HƠI VÀ CÁC BIỆN PHÁP XỬ LÝ
Vi mc đch lm ti liu tham kho l thuyt v bn cht nưc ni hơi trong quá trình vận hành
ni hơi cho cc đng nghip cng công tc trên tu. Vic biên son mt cch ngắn gọn và thực
dng dựa vo nhng kin thc cơ bn, cc ti liu cp nht ca cc nh ch to, cc nh sn xut
m ngưi vit đ c thực t s dng cng vi kin thc tm kim trên Internet - Wiki. đây ch
yu ch đ cập đn loi ni hơi thp đn trung áp dưi 6MPa. Bi vit ln đu 2012 đ đưc sa
cha v b sung ln th 2 vo 2017, 2021.
V trnh đ c hn s không th trnh đưc sai st, rt mong nhận đưc cc gp đ hoàn thin.
Xin chân thành cm ơn.
M/V DOUBLE PRIDE /2012
M/V IKAN TAMBAN/2017
C/E Đ Đc Thch
(http://hoahocngaynay.com/en/nghien-cuu-giang-day/quy-trinh-hoa-hoc/1820-nuoc-noi-hoi-va-
cac-bien-phap-xu-ly.html; doducthach@yahoo.com)
I) Cc tc đng ca môi trưng gây hi cho ni hơi - Pha nưc, hơi:
Ni hơi s chu nhng nh hưng, hư hng do ph hy bi ăn mn ha học v cu cn gây ra. Cc
tc nhân ny cng đưc chuyn ti theo hơi nưc hoc do bọt bùng sôi cuốn đi gây tc hi cho c
h thống nhận hơi công tc.
1. Ăn mn ha hc: Gây mc g, mn bc,nt v cn tr trao đi nhit.
+) Kh Oxy O2 (có trong không khí hoc ha tan trong nưc):
Fe + O2 => Fe2O3
Fe2O3 + O2 => Fe3O4 ( Mu đen – C tc dng lm lp bo v chống acid thâm nhập)
Do giu Oxy nên:
Fe3O4 + O2 => Fe2O3 (Mu đ – gây mc g phát trin – cn tr trao đi nhit)
Cu + O2 => Cu2O (Mu đ – Không chống acid, gây mc g phát trin).Nhưng:
Cu2O + O2 => CuO ( Mu nâu đen – C tc dng lm lp bo v chống Oxy, acid thâm nhập)
+) Kh Hydro H2: Ch tc hi đối vi ni hơi cao p (trên 6Mpa), H2 tc đng vi Cacbon C cc t
chc tinh th thp gây vt nt t vi ti nt Carbon b mt, khi c ng sut cc b tập trung dn
dn đn nt vch ni, ống.
H2 + C (To,P cao) => CH4
+) Ăn mn do Acid: (#)
-Kh CO2, SO2, H2S… c trong không kh khi ha tan vi nưc (H+ OH-) to: H2CO3, H2SO4, H2S, …cng
như lưng nh cc Acid khc đ sn c trong nưc n tc đng vi Fe, Cu to cc muối, gây ăn
mn không nhng vch ống ni hơi m cn c thit b nhận hơi công tc.

Page 2 of 11
Fe + CO2 + H2O => FeCO3 + H2
+) Ăn mn do muối natri NaCl c trong nưc cp hoc nưc bin nu b r t bu ngưng.
NaCl < = > Na+ + Cl- ; H2O <=> H+ + OH-
Cl- + H+ <=> HCl tnh acid – gây ăn mn.
+) Ăn mn do g muối đng Cu++ (CO3 -- ,SO4 ++, Cl - ..) dn v t cc bu hâm, bu ngưng gây ăn
mn.vd:
CuSO4 + Fe => FeSO4 + Cu
+) Ăn mn đim do sự co gin cc b ti cc v tr gây nt v lp Fe3O4 bo v – Xut hin khi đốt
ni cn đang ngui vi tốc đ qu nhanh không theo qui trnh đốt hâm nóng (xem phn tham
kho); Cc tp cht vô cơ (ct, đt…) hay hu cơ (vi khun, t bo…) to cực pin gây ăn mn đin
ha.
Đc bit g phn trên và sát mt nưc khi ni hơi không s dng trong thi gian dài- Cch bo
qun: Đin đy nưc vào bu ni,cp dư hóa cht kh oxy v đ cc ha cht khc, đng kn van.
2. Cu cn ni hơi: Cn tr trao đi nhit – To ng sut nhit cao cc b gây nt, chy ống v
vch ni; lm “t” cho cc cực pin ion gây ăn mn đin ha. (Rt nguy him khi lp cu bm dy
hơn 2mm)
Cc thnh phn ha học chnh gây cu cn c trong nưc – Nhm khim th Ca++, Mg++, SiO2 to
nưc cng, đc bit vi nưc nhận t trên b.Ch ý: S dng nưc chưng ct đ tiêu chun t
my chưng ct nưc ngt trên tu l tt nht cho cc h thng trao đi nhit (lưu ý thit b đo đ
mn ca my chưng ct cn phi hot đng tt).
2.1 Cc hp cht to cu cn tn ti khi cc tinh th đ vôi CaCO3, đ gan g magie MgCO3 ha
tan, v cc muối khc (Vd. MgCl, CaCl2, ...) tc đng vi cc acid tự nhiên mc (#) trên to ra:
- Muối bn:
CaCO3 + H2SO4 => H2O + CO2+ CaSO4 (Thch cao – Ha tan tốt nu bm dnh th to cu mm –
Không ty đưc bằng acid, ch làm sch bằng cơ học)
MgCO3 + H2SO4 => H2O + CO2 + MgSO4 (Ha tan tốt; kt ta bm dnh nu môi trưng giu Ca++)
MgCl2 => Mg++ +Cl-
Mg++ nu gp nhm OH- th Mg++ + OH- => Mg(OH)2 ( kt ta dng huyn ph, không kt ta nu
môi trưng giu Ca++)
- Muối không bn:
Ca++ + H(HCO3) => Ca(HCO3)2
Mg++ + H(HCO3) => Mg(HCO3)2
Dưi tc đng ca nhit đ cao:
Ca(HCO3)2 => CO2 + H2O + CaCO3
Mg(HCO3)2 => CO2 + H2O + MgCO3
CaCO3, MgCO3 Khi b mt nhit đ cao tự bm vo thnh ni, vch ống to cu cng - Ty đưc
bằng acid.
2.2 Silica (SiO2) : t gp, c mt số vng nưc đc bit, to cu cực cng. C th b cuốn theo hơi
bm vo thit b công tc Vd: cnh tua-bin. Vi ni hơi cao p n to Acid Silicic bay hơi, bm dnh
to cu cực cng v ăn mn kim loi, ch có th làm sch bằng cơ học.
Page 3 of 11
2.3 Cc Oxide sắt: C trong nưc cp hoc to ra do sắt b g trong ton b h thống, n bm lên
b mt hoc kt hp vi cc cht khc to hn hp bm dnh hnh thnh cu cn.
2.4 Sulfate Nhôm: Al2SO4 c trong nưc cp cng to cu cn.
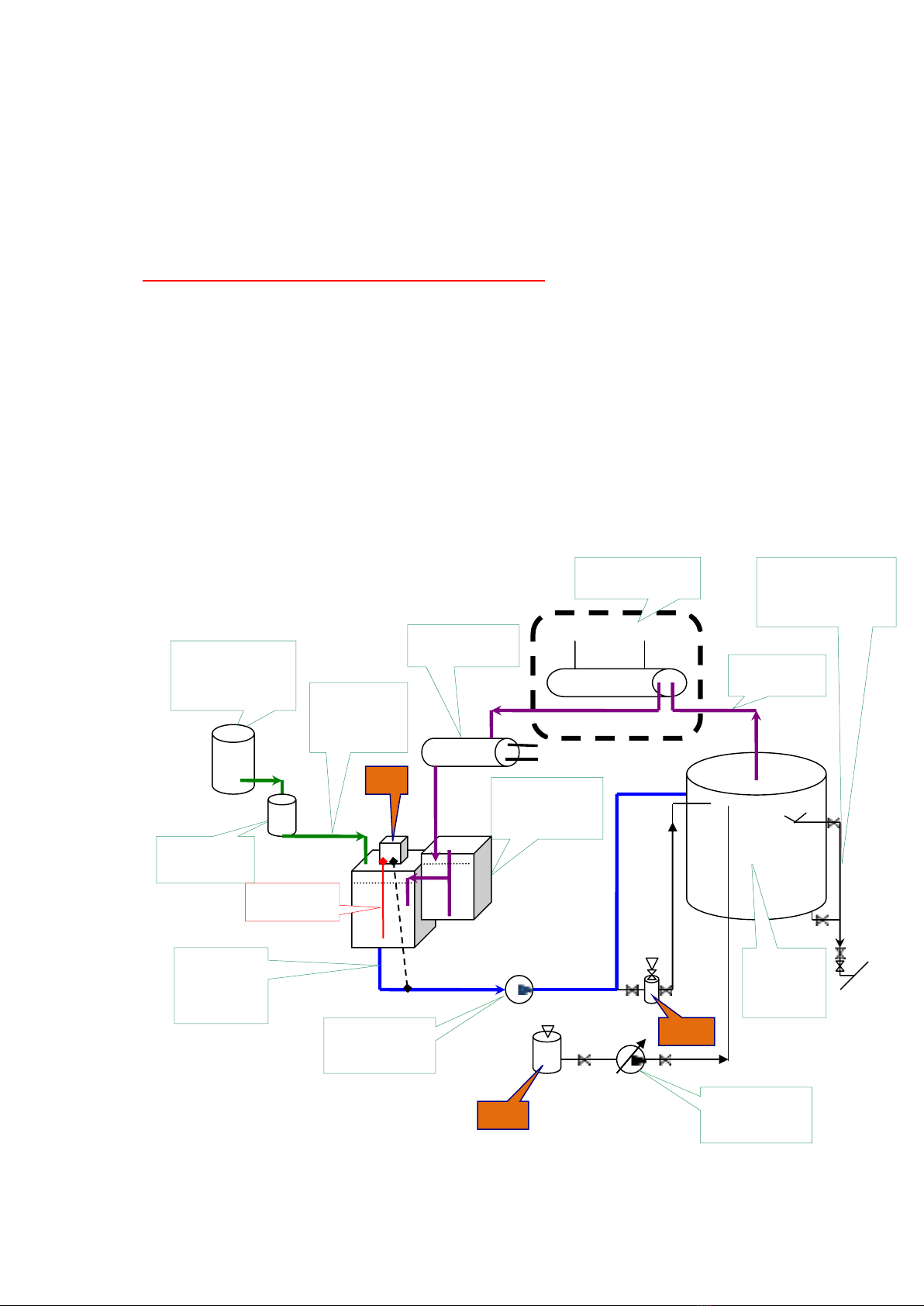
II) Sơ đ khi tng qut h thng nưc ni hơi : Vi tng loi ni hơi c th c th
c nhng thay đi hoc thêm bt cc chi tit khc nhau.
Phân chia cc nhm nưc cho ni nơi:
1, Nưc b sung( Make up Water): t ngun cp l kt nc ngọt (Fresh Water Tank)
2, Nưc ngưng t ( Condensate): Bên ngăn nưc ngưng (Hotwell)
3, Nưc cp ( Feed Water) = Nưc b sung + Nưc ngưng t : Bên ngăn nưc cp (Cascade Tank )
4, Nưc ni (Boiler Water): Trong bu ni.
5, Nưc bay hơi – hơi (Steam): Hơi đi công tc.
`
ng gn mt, x đy
(S,/B Blow down)
Nưc b
sung( Make up
Water)
Nưc cp ( Feed
Water)
Nưc ngưng t
( Condensate)
Bnh lm mm nưc
(Softener Device)
Nưc ngun(Fresh Water )
Bơm cp nưc ni (Boiler
Water Feed Pump)
Bơm cp ha cht - điu
chnh lưu lưng
Nưc ni:
(Boiler Water)
(*)
(**)
(***)
Bu ngưng
( Condenser)
ng dn . Cm sâu
hơn 80cm
Thit b nhn hơi công tc
Hơi (Steam)
NI
HƠI

Page 4 of 11
(*) Bnh ha cht cp nh giọt: Cp Hydrazine N2H4; C4H9NO... C6H11NH2
(**)Bnh ha cht cho Bơm cp ha cht - điu chnh đưc lưu lưng: : Cp N2H4; C4H9NO... C6H11NH2
(***)Bnh ha cht: cho Na2SO3 hoc cc ha cht khc: Cp NaOH; Na3PO4; Ha cht kh du ….
Ty thuc vào thit k cc ni hơi c ln c th dng cc thit b cp ha cht theo 1 hoc 2 kiu
loi như trên hoc không th vi ni hơi c nh ch đ trực tip vo kt nưc cp.
III) Cc bin php gim thiu tc hi v cc loi ha cht đưc s dng ph bin
hin nay:
1. Bin php cơ hc:
- Lọc Nưc b sung (Make up Water) - lm mm nưc bằng bnh lọc trao đi ion (Water Softener
device) – thit b loi mi rt đơn gin v tin dng gim cu cn cực tốt (Dng mt loi ht lọc c
c tui thọ cao tối thiu dng đưc 5 năm. C kh năng ti sinh sau mt thi gian s dng bằng
cch rt đơn gin l thao tc đng m van cho nưc bin đi ngưc li, sau đ x sch bằng nưc
ngọt ).
- Nâng nhit đ Nưc cp (Feed Water) nên 80 oC đ đui kh O2, H2, CO2...ha tan trong nưc.
-X không kh trong bu ni (đnh ni) khi mi đốt ni hơi cho đn khi thy hơi nưc trắng đ thot
ra ngoi th đng li.
- Ngn mt, x đy: Khi nng đ Cl- (Chloride ion) cao hay nng đ tp cht hòa tan cao - đo bằng
đ dn đin (Conductivity) xem c th mc IV.
- Dng kt đm tách khí trưc bơm cp theo nguyên lý hút chân không cho ni hơi loi cao áp.
-Đnh k bắt buc gn mt, x đy: * M nh van*
Do cc qu trnh ha học xy ra liên tc to kt ta đy ni, vng trên b mt nưc, ri muối
hnh thnh cn phi x đi (qui trnh gn mt, x đy – xem mc VI).
Tối đa khong 3 ngy 1 ln vi vi cc ni hơi v đc bit khi cc ni hơi dng nưc nhận t trên
b c th cn phi tin hnh hng ngy; Ngn mt lưng nh trong 5 giây, x đy lưng nh trong
15 giây cho ni hơi nh dng nưc chưng ct n đnh hoc x đi a centimeter(?) t mực nưc trên
kính thy (Xem khuyn co ca cc nh ch to);
Thnh thong x đy, v sinh các phin lọc (cc tm vi n) trong cc kt nưc nu có, làm sch các
kt nưc nu c cơ hi; x b nưc hi bn đ v kt nưc ngưng (Hot Well) khi va m hơi đi
công tác tc b nưc trng ống; - Nhng vic này rt cn thit đ ngăn tp cht đưa vo ni hơi
gây ăn mn, cáu cn. V sinh bu ni, ống nưc bằng my bơm phun cao p hay ha cht ty cu
cn mi khi tu lên đ.
2. Bin php ha hc - S dng ha cht:
Ch ý: Hm lưng ha cht s dng trên 1m3 nưc, cho 1 ngày phi tuân theo hưng dn ca
nh sn xut mt cch trit đ, nồng đ dư tha đều có hi.
2.1 Chng ăn mn:
2.1.1 Kh Oxy ( Oxygen Scavenger):
* Dng Hydrazine N2H4

Page 5 of 11
N2H4 + O2 => H2O + N2
N2H4 cng to môi trưng c tnh kim rt c li pha hơi công tc .
Tc dng ph c hi khi nng đ qu cao:
N2H4 (To > 270oC) => NH3 cng O2, H2O to môi trưng c tnh acid.
CuO + N2H4(bay hơi) = > Cu2O (mu đ, g phát trin) + H2O + N2
Phương php b sung:
- Ha vi nưc cp vo bnh cha – cho chy nh giọt liên tc vo kt Nưc cp (Feed
Water) [xem h.v (*) mc II .]. Ống dn phi cắm gn ming hút ca bơm, sâu dưi mt
nưc hơn 80cm (trnh tc dng trực tip vi O2 trong không kh trên b mt) hoc nối
trực tip vo đưng hút ca bơm.
- Ha vi nưc, cp vo bnh cha, dng bơm hóa cht điu khin đưc lưu lưng bơm liên
tc trực tip vo bu ni [xem h.v (**) mc II.]
Ch ý: Tuyt đi không đưc đ thẳng toàn b mt ln lưng dùng cho c mt ngày vào két
Nưc cp (Cascade Tank).
* Dng Sodium Sunfit Na2SO3 (nhóm Sunfit – ch dng cho ni hơi dưi 4MPa)
Na2SO3 + O2 => Na2SO4
Phương php b sung: Dng bt,dung dch ha tan v bơm trực tip vo bu ni qua bnh ha
cht. [xem h.v (***) mc II.]
* Dùng Diethylhydroxylamine (hay N-ethyl-N-hydroxyl) R-N-(OH)-R: Đây l hóa cht mi rt tiên
tin có tính kim, có kh năng kh Oxy, chống ăn mn, chống kt bm dính.
Phương php b sung: b sung như vi Hydrazine trên .
2.1.2 Trung ha Acid - To môi trưng c tnh kim trong:
2.1.2.1 Nưc ni (Boiler Water):
* Dng Sodium hydroxide NaOH hoc Potassium hydroxide KOH hoc Na2CO3
Phương php b sung: Đ vo kt Nưc cp (Feed Water).
Tc dng ph c hi:
Vi ni hơi cao p(trên 6Mpa) to lp mng bm vo thnh vch trao đi nhit, ăn mn xung
quanh biên dng tinh th sắt gây nt v – hin tưng “ dn kim”. Trưng hp ny phi dng
cht khống ch ‘Coordinated PO4’ v hm lưng NaOH, KOH dng thp hơn ni hơi thp p.
Vi ni hơi dưi cao p: Nng đ kim qu cao cng s b “dn kim” như trên khi c đ pH >> 12
Phương php b sung: Đ trực tip vo kt Nưc cp ( Feed Water). Ch ý: Ch b sung khi nng
đ gim thp.
* Dng Octadecylamine - ha cht to lp mng bo v chống ăn mn, t gp.
2.1.2.2 Hơi đi công tc (steam) - Nưc ngưng ( Condensate Water):
*Dng Morpholine C4H9NO: Cht bay hơi, c ch ăn mn, thưng thy trong hóa cht hn hp.
* Dùng Ethanolamine hay 2-Aminoethanol,tên vit tắt là ETA hoc MEA, [H2NCH2CH2OH] H2N-R-
(OH): Có tính kim – Cht điu pH, dễ bay hơi, trung hòa cac acid do CO2, H2S…














![Bài tập trắc nghiệm Kỹ thuật nhiệt [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250613/laphong0906/135x160/72191768292573.jpg)
![Bài tập Kỹ thuật nhiệt [Tổng hợp]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250613/laphong0906/135x160/64951768292574.jpg)

![Bài giảng Năng lượng mới và tái tạo cơ sở [Chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2024/20240108/elysale10/135x160/16861767857074.jpg)








