Ngày nhận bài: 29-07-2024 / Ngày chấp nhận đăng bài: 23-09-2024 / Ngày đăng bài: 28-09-2024
*Tác giả liên hệ: Ngô Thị Thanh Diệp. Bộ môn Phân tích - Kiểm nghiệm - Khoa Dược, Đại học Y Dược Thành phố Hồ Chí Minh, Thành phố
Hồ Chí Minh, Việt Nam. E-mail: ngothithanhdiep@ump.edu.vn
© 2024 Bản quyền thuộc về Tạp chí Y học Thành phố Hồ Chí Minh.
27 | https://www.tapchiyhoctphcm.vn https://doi.org/10.32895/hcjm.p.2024.03.04
ISSN : 1859-1779
Nghiên cứu Dược học
Tạp chí Y học Thành phố Hồ Chí Minh - Dược học; 27(3):27-35
https://doi.org/10.32895/hcjm.p.2024.03.04
Tổng hợp tạp F và tạp G của aripiprazol
Nguyễn Anh Vũ1, Tạ Công Minh Huy2, Ngô Thị Thanh Diệp3,*
1Đại học Upssala, Thụy Điển
2Công ty Cổ Phần Dược Phẩm 2/9 Thành phố Hồ Chí Minh, Thành phố Hồ Chí Minh, Việt Nam
3Khoa Dược, Đại học Y Dược Thành phố Hồ Chí Minh, Thành phố Hồ Chí Minh, Việt Nam
Tóm tắt
Đặt vấn đề: Aripiprazol N-oxid (tạp F) và dehydro aripiprazol (tạp G) là hai tạp quá trình, đồng thời là tạp phân hủy của
aripiprazol, một thuốc tương đối mới thuộc nhóm chống loạn thần thế hệ 1. Dược điển Mỹ 2024 quy định phải kiểm tra
tạp F và tạp G trong cả nguyên liệu và thành phẩm aripiprazol. Hiện nay, trong ngân hàng chất đối chiếu tại Việt Nam
vẫn chưa có các tạp chuẩn F và G, điều này gây khó khăn không nhỏ cho công tác kiểm nghiệm. Cho đến nay, trong
nước cũng chưa có nghiên cứu nào công bố quy trình tổng hợp tạp F và tạp G, do đó việc nghiên cứu tổng hợp tạp F và
tạp G có độ tinh khiết cao làm cơ sở để thiết lập chất đối chiếu của hai tạp chất này có nhiều ý nghĩa cho công tác kiểm
tra đánh giá chất lượng nguyên liệu và chế phẩm chứa aripiprazol tại Việt Nam.
Mục tiêu: Tổng hợp tạp F và tạp G có độ tinh khiết cao đủ điều kiện thiết lập làm chất đối chiếu.
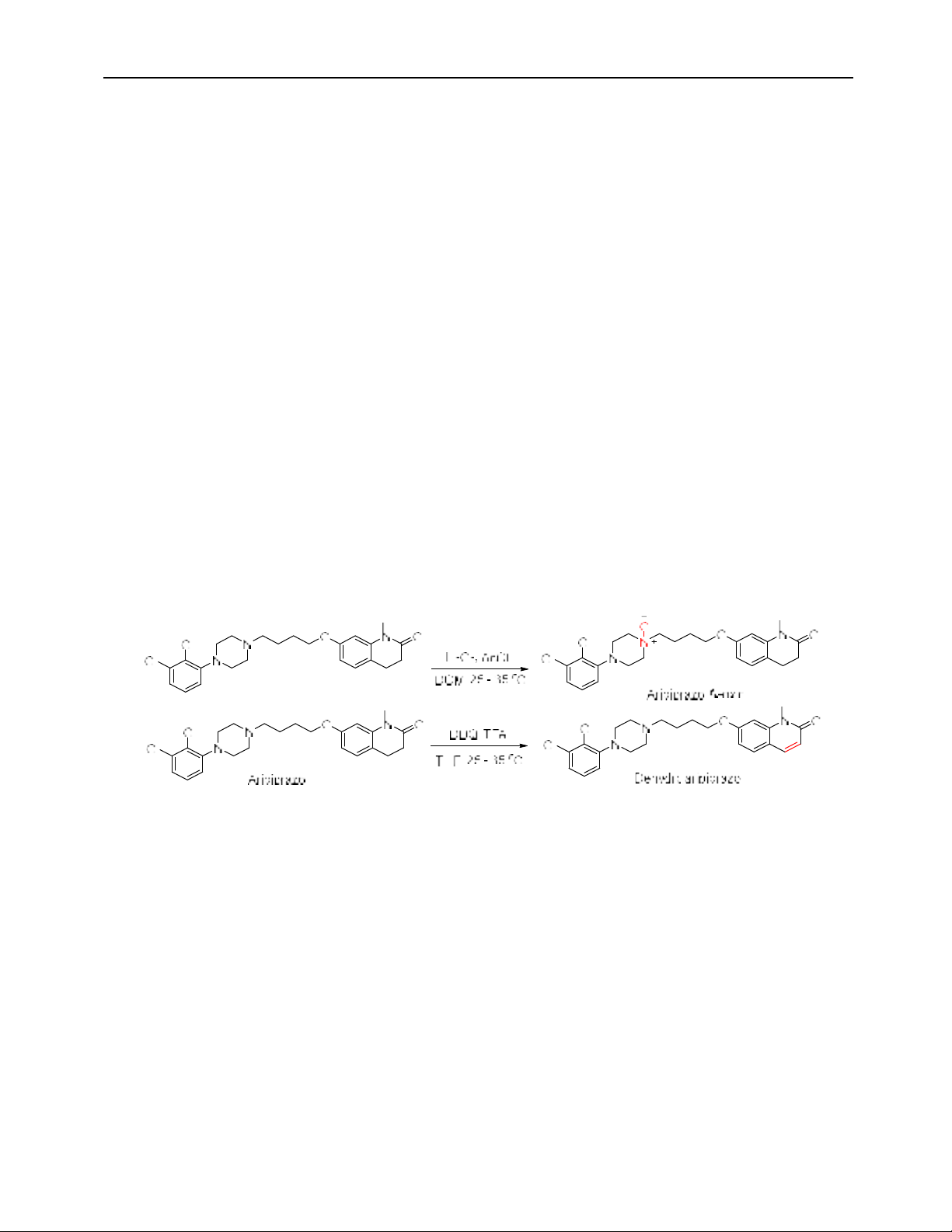
Đối tượng và phương pháp nghiên cứu: Tạp F và tạp G được tổng hợp bằng phản ứng oxy hóa và phản ứng dehydro
hóa aripiprazol. Sản phẩm được tinh chế và được xác định cấu trúc bằng các phương pháp phổ nghiệm. Độ tinh khiết
được xác định theo phương pháp chuẩn hóa diện tích pic bằng HPLC-PDA.
Kết quả: Tạp F và tạp G được tổng hợp với hiệu suất toàn quá trình 64,35% và 64,04%, độ tinh khiết sắc ký của cả 2
sản phẩm đều đạt trên 99%, đủ điều kiện để có thể thiết lập làm chất đối chiếu.
Kết luận: Tổng hợp thành công tạp F và tạp G có độ tinh khiết cao, đủ điều kiện thiết lập làm chất đối chiếu.
Từ khoá: aripiprazol N-oxid, dehydro aripiprazol
Abstract
SYNTHESIS OF IMPURITY F AND G OF ARIPIPRAZOLE
Nguyen Anh Vu, Ta Cong Minh Huy, Ngo Thi Thanh Diep
Background: In Vietnam, aripiprazole is a relatively new drug used to treat bipolar disorder and schizophrenia.
Aripiprazole N-oxide (impurity F) and dehydro aripiprazole (impurity G) are process-related and degradation impurities
of aripiprazole. Current regulations, as outlined by the United States Pharmacopeia 2024, require the testing of these
impurities in both raw materials and finished products. However, Vietnam's reference material bank does not have these