
1
Các loại phân kali:
Nguyên liệu sản xuất: khoáng Silvinit, khoáng
Carnalit, khoáng kainit,
khoáng langbeinit, phèn alunit
CHƯƠNG 3: SẢN XUẤT PHÂN KALI
K2SO4(48-52% K2O)
KCl (40-60%K2O)
KNO3, KHCO3,
K2SO4+ MgSO4
2
3.1. Chế tạo phân KCl
3.1.1 Chế tạo phân kali từ Silvinit
• Khoáng Silvinit có màu trắng nâu, hồng… tùy tạp
chất mang màu.
• Khối lượng riêng 1,97 – 1,99 g/cm3
• Độ cứng 1,5 – 2,0
• Hàm lượng các muối: 22-31% KCl (thường 25%);
71% NaCl; 1,8% CaSO4; 0,2% MgCl2; khoảng 2%
sét không tan.

3
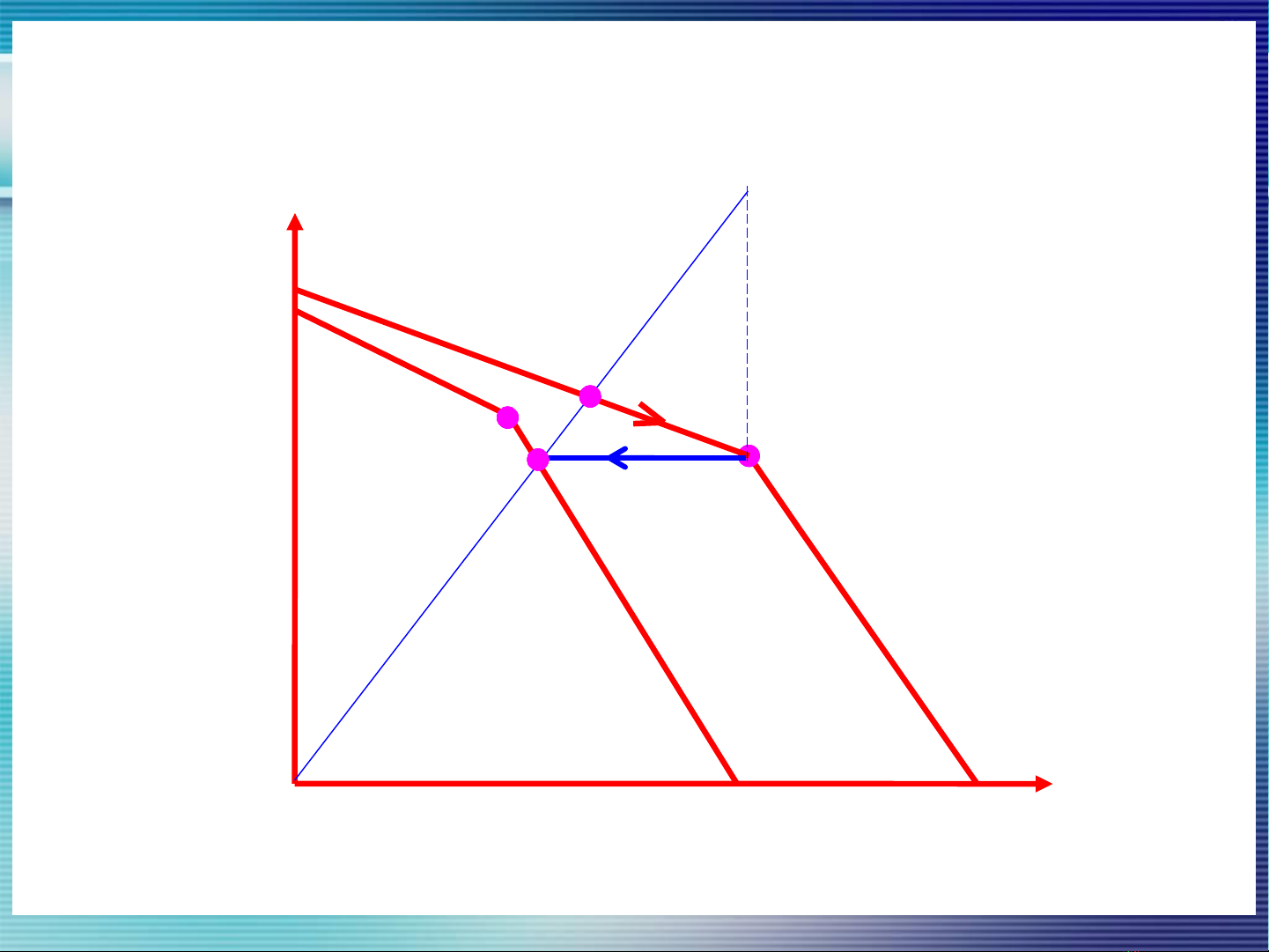
3.1.1.1 Phương pháp kết tinh riêng
•Nguyên tắc:Dựa vào độ tan khác nhau của các
muối ở cùng nhiệt độ (bảng độ tan g/100gH2O):
00C100C200C300C400C500C600C700C800C900C1000C
KCl 27,6 31,0 34,0 37,0 40,0 42,6 45,5 48,1 51,1 54,0 56,7
NaCl 35,7 35,8 36,0 36,3 36,6 37,0 37,3 37,8 38,4 39,0 39,8
4
a•Giản đồ độ tan đẳng nhiệt hệ NaCl-KCl-H2O
a'
25°C
A’
100°C
Số g KCl/100g H2O
2
W(H O) b
KCl
NaCl
E
1
a
E2
b'
Số g NaCl/100g H2O
B
A
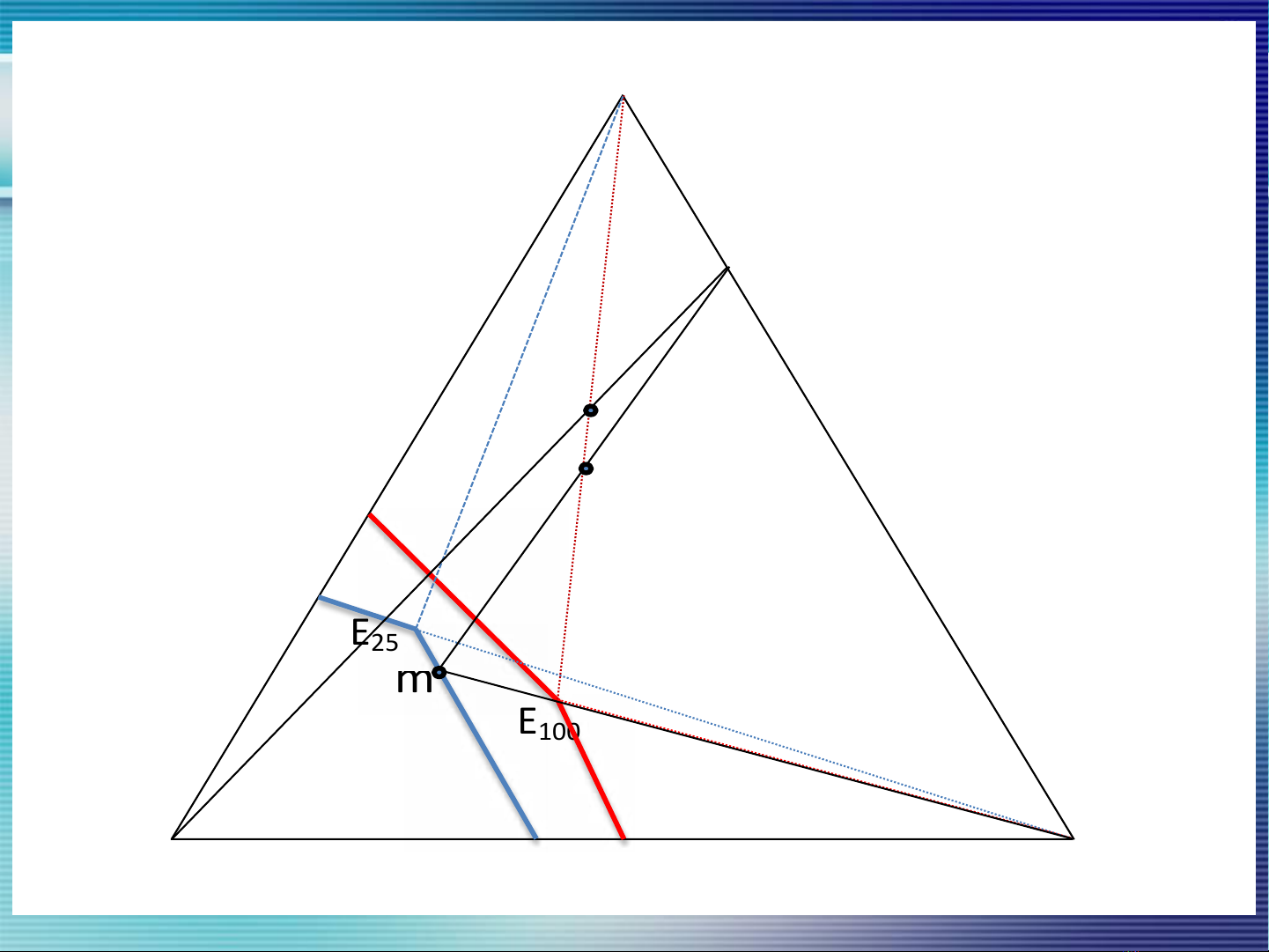
a
5
d
c
b
m
E25
E100
a
N
L
H2O
K
NaCl
KCl


























