nvhoa102@yahoo.com Chương 7 1
CHƯƠNG 7 – PHÂN NHÓM VII A
Nhận xét chung
I. Đơn chất
II. Hợp chất có số oxh (-1)
III. Hợp chất có số oxh
(+1, +3, +5, +7)
nvhoa102@yahoo.com Chương 7 2
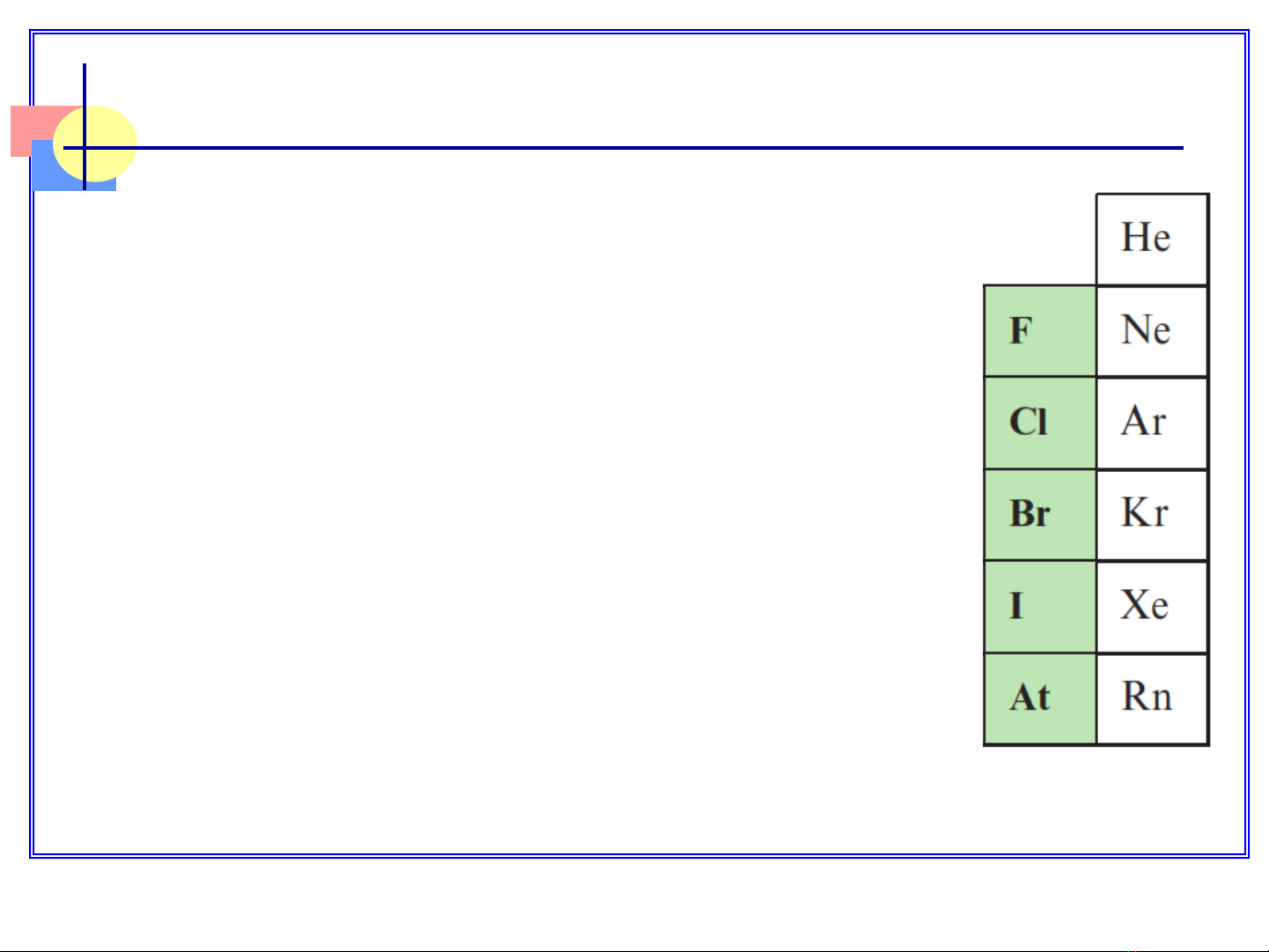
Phân nhóm VIIA gồm: F , Cl , Br , I , At (nhân tạo)
Cấu trúc electron hóa trị: ns2np5
•Tính phi kim, oxi hóa giảm từ đầu cuối nhóm
• Tạo được hợp chất có số Oxh dương từ +1 +7
(trừ F). Chúng kém bền tính Oxh mạnh.
•I2tạo được các ion +1 (ICl, ICN, IClO4); +3 (IPO4,
I(CH3COO)3)
X + 1 e-X-Tính oxi hóa mãnh liệt (PK)
Dễ tạo ion hoặc LK CHT (-1)
Nhận xét chung:
nvhoa102@yahoo.com Chương 7 3
1.Lý tính
-Điều kiện thường tồn tại ở dạng phân tử X2
-Có mùi xốc, khó chịu, rất độc
-Có nhiệt độ nóng chảy, nhiệt độ sôi thấp và tăng
dần từ F2I2. Riêng I2bị thăng hoa khi đun nóng.
- Halogen tan ít trong nước, và tan nhiều trong dung
môi hữu cơ (rượu, ete, benzen, CS2, CCl4 …)
-Nhiệt phân ly X-X giảm dần từ Cl2I2:
F2(4500C), Cl2(8000C); Br2(6000C); I2(4000C)
I. ĐƠN CHẤT

nvhoa102@yahoo.com Chương 7 4
2.Hóa tính
-Là những phi kim điển hình, có tính oxihóa mạnh
-Với cùng một nguyên tố phản ứng của halogen xảy
ra theo mức độ giảm dần từ F2I2:
I. ĐƠN CHẤT
Với nước
F2+ H2O 2HF + O
X2+ H2O ⇌HXO + HX (K= 3.10-4; 4.10-9; 5.10-23)

nvhoa102@yahoo.com Chương 7 5
Với chất khử khác
4Cl2+ Na2S2O3+ 5H2O 2NaHSO4+ 8HCl
4Br2+ Na2S2O3+ 5H2O 2NaHSO4+ 8HBr
I2+ 2Na2S2O3Na2S4O6+ 2NaI
Phản ứng đẩy: halogen trước đẩy halogen đứng sau
F2+ 2NaCl 2NaF + Cl2
Cl2+ 2NaBr 2NaCl + Br2
Br2+ 2NaI 2NaBr + I2
I. ĐƠN CHẤT












![Đề thi kết thúc học phần Nguyên lí Hóa học 2 [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251014/anhinhduyet000/135x160/69761760428591.jpg)













