
CH NG 3: ƯƠ
H NG S D C TR NG C A CÁC CÂN B NG HÓA Ằ Ố Ặ Ư Ủ Ằ
H C Đ N GI N TRONG N CỌ Ơ Ả ƯỚ
Trong hóa phân tích, các ph n ng đ c s d ng ả ứ ượ ử ụ
ph i x y ra hoàn toàn (ch ng 1)ả ả ươ
Đa s các P HH x y ra thu n ngh ch => k/n hoàn ố Ư ả ậ ị
toàn ch có tính t ng đ iỉ ươ ố
M c đ phàn ng x y ra đ c đánh giá theo ứ ộ ứ ả ượ
h ng s cân b ng K (xem Nguy n Đ c Chung - ằ ố ằ ễ ứ
Hóa đ i c ngạ ươ - trang 237-252, NXB ĐHQG
2002)

3.1 BÁN CÂN B NG VÀ H NG S D C Ằ Ằ Ố Ặ
TR NG T NG NGƯ ƯƠ Ứ
1. Cân b ng trao đ i đi n tằ ổ ệ ử
1.1 Bán cân b ng trao đ i đi n t (bán cbằ ổ ệ ử oxhk): là
cân b ng c a các ph n ng 1hoa h c x y ra gi a ằ ủ ả ư ọ ả ữ
hai d ng oxh và d ng kh (trao d i đi n t x y ra ạ ạ ử ổ ệ ử ả
dung môi là trong n c)ướ
Đ d c tr ng cho kh năng oxh hay kh c a hai ể ặ ư ả ử ủ
d ng liên h p Ox/Kh => khái ni m Eạ ợ ệ o (th oxh ế
chu n)ẩ
Eo cho bi t c ng đ oxh c a d ng oxh, Eế ườ ộ ủ ạ o càng l n ớ
thì tính oxh c a d ng Ox càng m nh và tính kh ủ ạ ạ ử
c a c a d ng càng y uủ ủ ạ ế
V i m i dd ch a h n h p 2 d ng oxh và kh có ớ ỗ ứ ỗ ợ ạ ử
n ng đ cân b ng [ox] và [kh] thì th oxh kh ồ ộ ằ ế ử
c a dd s đ c tính theo pt NERNST ủ ẽ ượ

Walther Hermann Nernst was born in Briesen,
West Prussia, on June 25, 1864
The Nobel Prize in Chemistry 1920
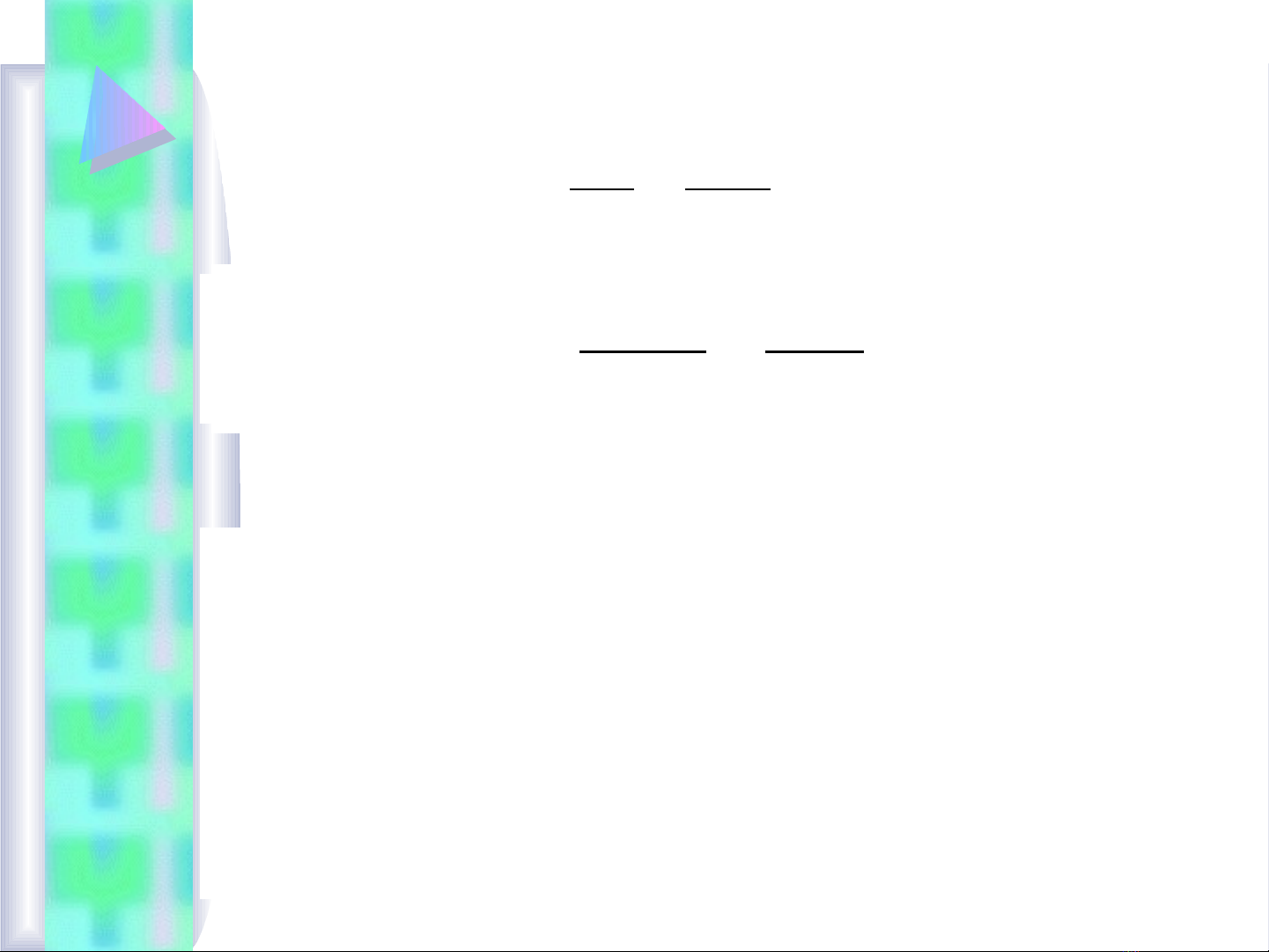
E = EO +
[ ]
ln [ ]
RT ox
nF Kh
Trong đó: R = 8,3144J/molK
T = 298,16oK
F = 96493Cb/mol
n = s đi n t trao đ iố ệ ử ổ
Eo = th đi n c c chu n (tra theo b ng ph l c)ế ệ ự ẩ ả ụ ụ
E = EO +
0,059 [ ]
ln [ ]
ox
n Kh
Hay

1.2. Cân b ng trao đ i đi n t : ằ ổ ệ ử là quá trình cho
nh n đi n t x y ra gi a hai đôi oxh/kh khác ậ ệ ử ả ữ
nhau
H ng s cân b ng vàằ ố ằ D đoán chi u ph n ngự ề ả ứ
Xét hai đôi Ox1/Kh1 (cho nh n n1e, có Eậo1) và Ox2/Kh2
(cho nh n n2e, có Eậo2). Khi tr n hai đôi này v i nhau, các ộ ớ
ph n ng có th x y ra theo 2 chi u:ả ứ ể ả ề
n2Ox1 + n1Kh2 n1Ox2 + n2Kh1
tr ng thái cân b ng các h ng s cân b ng K(1) và K(2) Ở ạ ằ ằ ố ằ
tuân theo đ nh lu t tác d ng kh i l ngị ậ ụ ố ượ
Và K(1) = 1/ K(2) . Ta c/m đ c:ượ
(1)
(2)
ネ ネ ネネ
ネ ネ ネネ
K(1) =
0 0
1 2( )
1 2
0,059
10
n n E E−







![Bài giảng Hóa phân tích TS. Lê Thị Hải Yến: Tổng hợp kiến thức [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230607/phuong3129/135x160/2361686125460.jpg)


















