
1
PHƯƠNG PHÁP KẾT TỦA
Antoine Lavoisier
(1743 – 1794)
ĐL bảo toàn khối lượng

2
MỤC TIÊU
1. Giải thch được biu thc tính tch s tan, đ tan và
ngha ca n trong phân tch.
2. Trnh bày được cc yu tố ảnh hưng đn đ tan ca
cht đin ly t tan và tnh được đ tan ca cht đ trong
cc điu kin c th.
3. Trnh bày được hin tượng hp ph khi chun đ theo
phương php bc.
4. Trnh bày được nguyên tc, điu kin tin hành và ng
dng ca 3 phương php: Mohr, Fajans, Volhard.

3
NỘI DUNG
1. LÝ THUYẾT VỀ SỰ KẾT TỦA
1.1. Tch số tan.
1.2. Đ tan – Cch tnh đ tan
1.3. Cc yu tố ảnh hưng đn đ tan
2. ĐỊNH LƯỢNG BẰNG PHƯƠNG PHÁP KẾT TỦA
2.1. Nguyên tc chung
2.2. Phân loi
2.3. Yêu cầu đối với phản ng trong phương php kt ta
2.4. Phương php bc
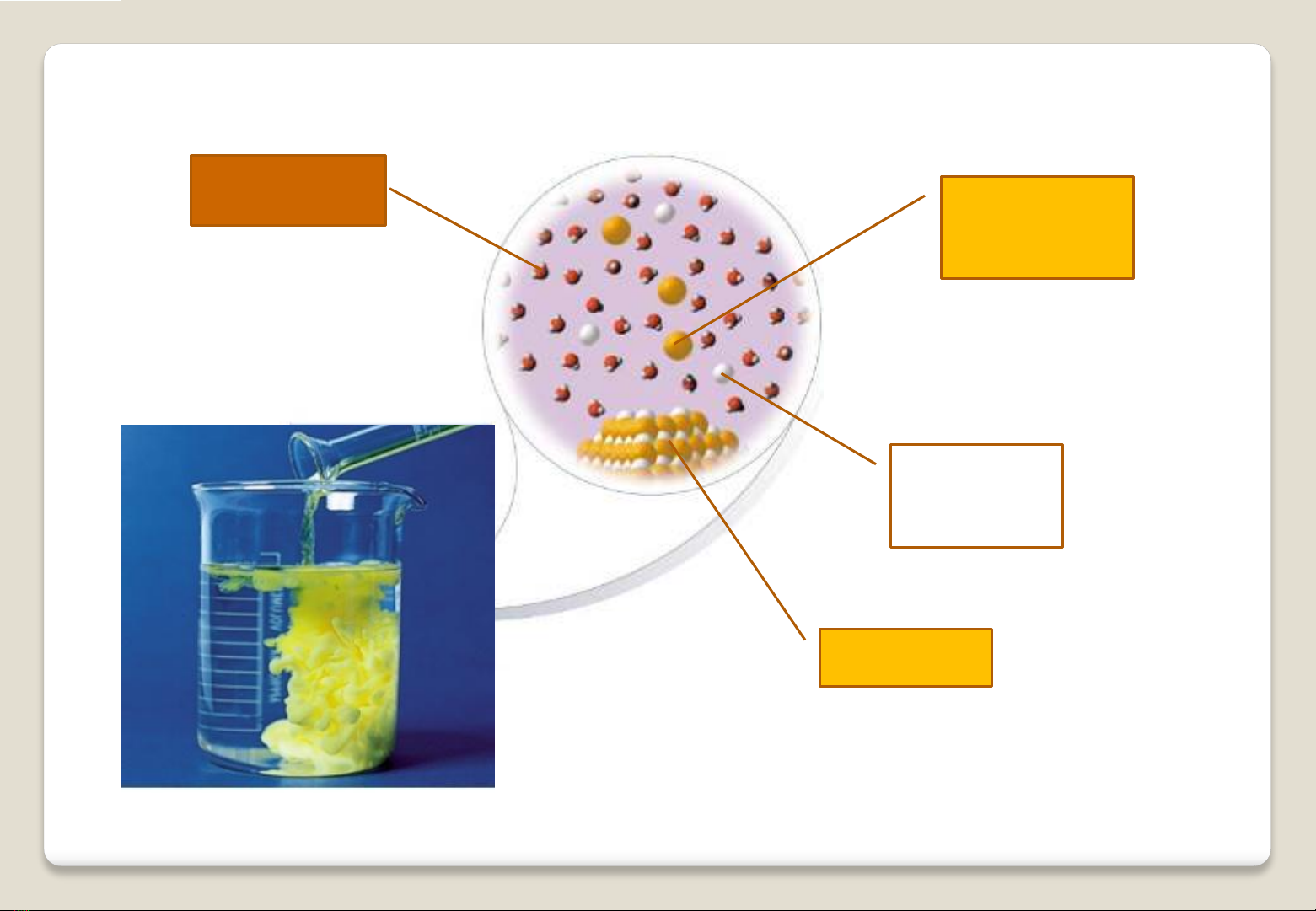
4
Anion
phân ly
Cation
phân ly
Kết tủa
Dung môi
PHƯƠNG PHÁP KẾT TỦA

5
oPhn ng kết tủa l phn ng to thnh cht rn
(cht kết tủa ít tan) t cc cht tan trong dung dch.
o Những phn ng to thnh kết tủa được dùng trong
phương php kết tủa phi thỏa mãn cc điều kiện
sau:
Kết tủa phi rt ít tan.
Sự kết tủa phi xy ra nhanh.
Kết tủa to thnh trong qu trình đnh lượng không
b phân hủy.
Phi có kh năng xc đnh được điểm tương đương






![Bài giảng Hóa phân tích TS. Lê Thị Hải Yến: Tổng hợp kiến thức [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230607/phuong3129/135x160/2361686125460.jpg)




![Bài tập trắc nghiệm môn Hoá đại cương [kèm đáp án chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260310/hoaphuong0906/135x160/41041773198743.jpg)
![Giáo trình Thực hành Hoá lý Trường Đại học Bà Rịa - Vũng Tàu [Mới Nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260310/hoaphuong0906/135x160/54151773283867.jpg)



![Tài liệu bồi dưỡng giáo viên Hoá đại cương [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260310/hoaphuong0906/135x160/47881773287371.jpg)
![Bài giảng Hoá học đại cương Trường Đại học Nam Cần Thơ [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260310/hoaphuong0906/135x160/53091773287379.jpg)








