
PHỨC CHẤT CỦA NGUYÊN TỐ d
GV: TS. Lê Tiến Khoa
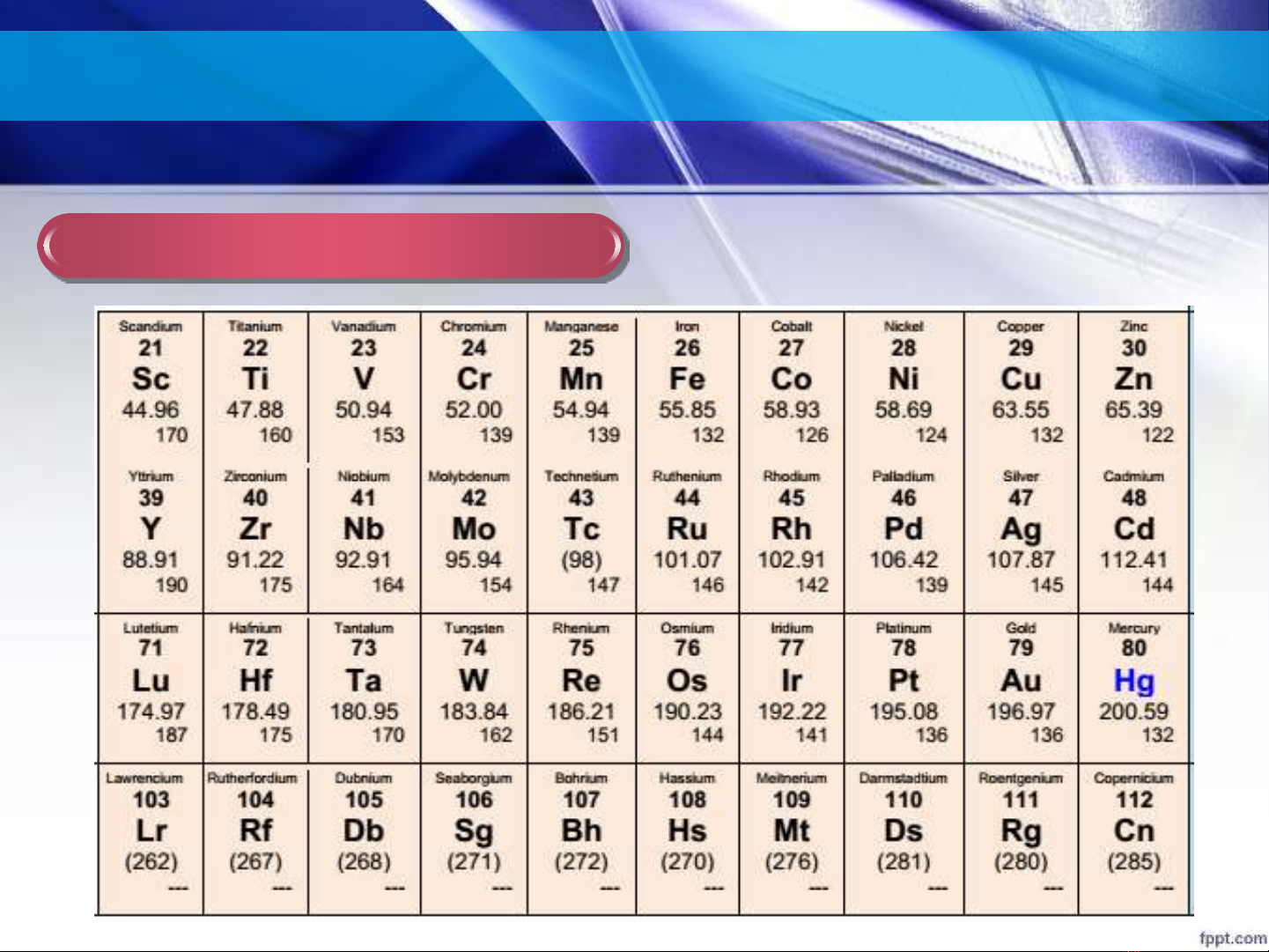
Một số tính chất của phức chất d
Phức của các nguyên tố d

Nhận xét chung
Ngtố d sớm: thường phức bát diện, một số ít tạo phức tứ diện
Ngược lại, các ngtố d muộn:
Khác biệt giữa ngtố d sớm và d muộn
• Điện tích hạt nhân lớn hơn
• Bán kính nhỏ hơn
Tạo ra nhiều loại phức chất
Sự tạo phức có thể làm bền hóa một số số oxh không bền
Ảnh hưởng của việc tạo phức
Ví dụ: Mn3+ không bền trong mtrường acid/ [MnF4]-, [Mn(CN)6]3- bền hơn
Cu+ không bền trong nước/ [CuCl2]- bền hơn

Tính chất quan trọng
Nhiều nguyên tố d sớm có khả năng tạo phức có liên kết đôi M=O
Phức chất của các nguyên tố d sớm
Để phức bền hơn
Ví dụ: TiOCl2, [VO(H2O)5]2+, [VO2(Ox)2]3–, [CrOX4]–...
•Có sự hình thành liên kết πO→M giữa O và kim loại trung tâm
• Phức bền, khả năng thủy phân ít
• Tên gọi: có đuôi nyl: titanyl, vanadyl...

Liên kết Pi trong phức chất
Liên kết Pi cho
Trong phức bát diện: orbital dxy, dxz và dyz có thể
tạo liên kết pi
• Các orbital dxy, dxz và dyz còn nhiều chỗ trống
để nhận e
Sự che phủ giữa dxy của
Co3+ với 4 orbital p của F-
•Ligand có orbital p có: (i) định hướng
phù hợp để xen phủ hông, (ii) có nhiều
e để cho
Ví dụ: Ti4+, Cr3+, Co3+...
Ví dụ: F-, Cl-, Br-...












![Đề thi kết thúc học phần Nguyên lí Hóa học 2 [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251014/anhinhduyet000/135x160/69761760428591.jpg)













