
CHƢƠNG 2: PHỨC CHẤT
TS. Lê Tiến Khoa
1

GIỚI THIỆU PHỨC CHẤT KIM LOẠI
2

www.themegallery.com
Lịch sử về phức chất
Khái quát lịch sử
Hợp chất phối trí đầu tiên: phẩm nhuộm (alizarin đỏ, xanh Prussian….)
Alizarin đỏ
Xanh prussian
KFe[Fe(CN)6]
[Cu(NH3)4]2+
Andreas Libavius
3
www.themegallery.com
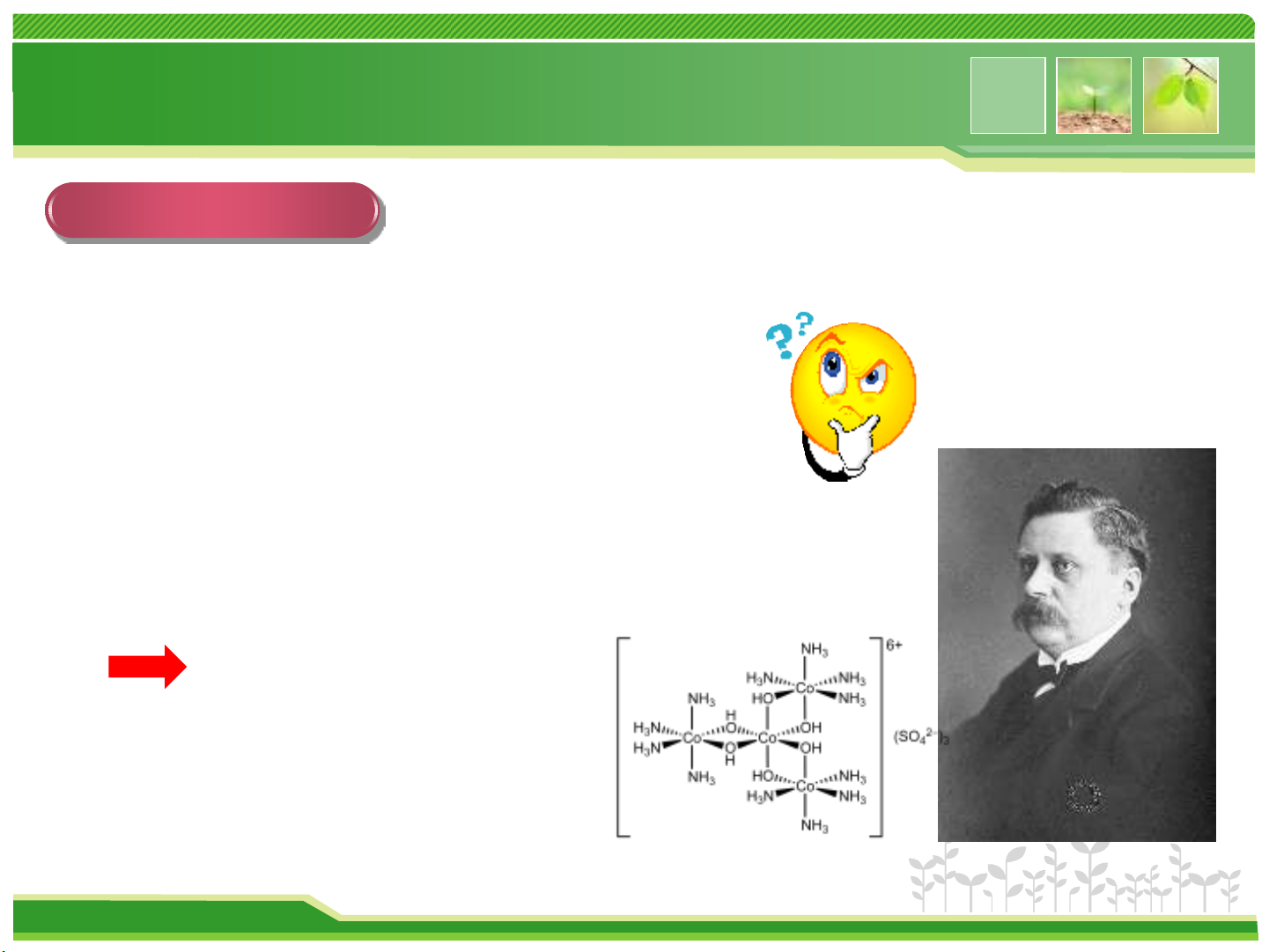
Lịch sử về phức chất
Vài thế kỷ trước: khái niệm hóa trị không giải thích được vài hợp chất
Khái quát lịch sử
CoCl3.6NH3 CoCl3.4NH3
Ví dụ: Co3+ được tin là có hóa trị 3
1869: lý thuyết chuỗi của Christian Wilhelm Blomstrand
1893: lý thuyết phối trí của Alfred Werner ra đời
Giải thích thành công hexol
4

www.themegallery.com
Đại cƣơng về phức chất
Phức chất: sản phẩm của phản ứng acid-baz theo quan điểm Lewis
Khái niệm về phức chất của KL
Acid: nguyên tử trung tâm (NTTT) có vân đạo trống
Baz là tiểu phân có e hóa trị tự do: ligand (phối tử)
Liên kết giữa NTTT – ligand: liên kết phối trí
NTTT có số phối trí > hóa trị
5


























