
Hồ Thị Cẩm Hòai, PhD
htchoai@hcmus.edu.vn

C I: Ôn lại về tóan học (tự học)
C II: Các đặc trưng của chất khí (Khí lý tưởng và
khí thật)
C III: Thuyết động học của khí
C IV: Nguyên lý thứ nhất nhiệt động học và áp
dụng.
C V: Khái niệm về entropy.
C VI: Nguyên lý thứ hai và thứ ba của nhiệt động
học.
C VII: Năng lượng khả dụng A.
Năng lượng tự do G

Chương I : Các đặc trưng của chất khí
(Khí lý tưởng và khí thật)
KHÍ LÝ TƯỞNG
Không có trong thực tế (không thể hóa lỏng và rắn)
Là khí mẫu, đơn giản hóa để tiện khảo sát (để áp dụng
vào khí thật).
Về phương diện cơ cấu, khí lý tưởng gồm những phân
tử KHÔNG KÍCH THƯỚC và KHÔNG CÓ LỰC HÚT LIÊN
PHÂN TỬ giữa các phân tử khí.
Trong điều kiện thích hợp, người ta cho rằng khí lý
tưởng luon nghiệm đúng các định luật thực nghiệm ở bất
cứ điều kiện thực nghiệm nào.
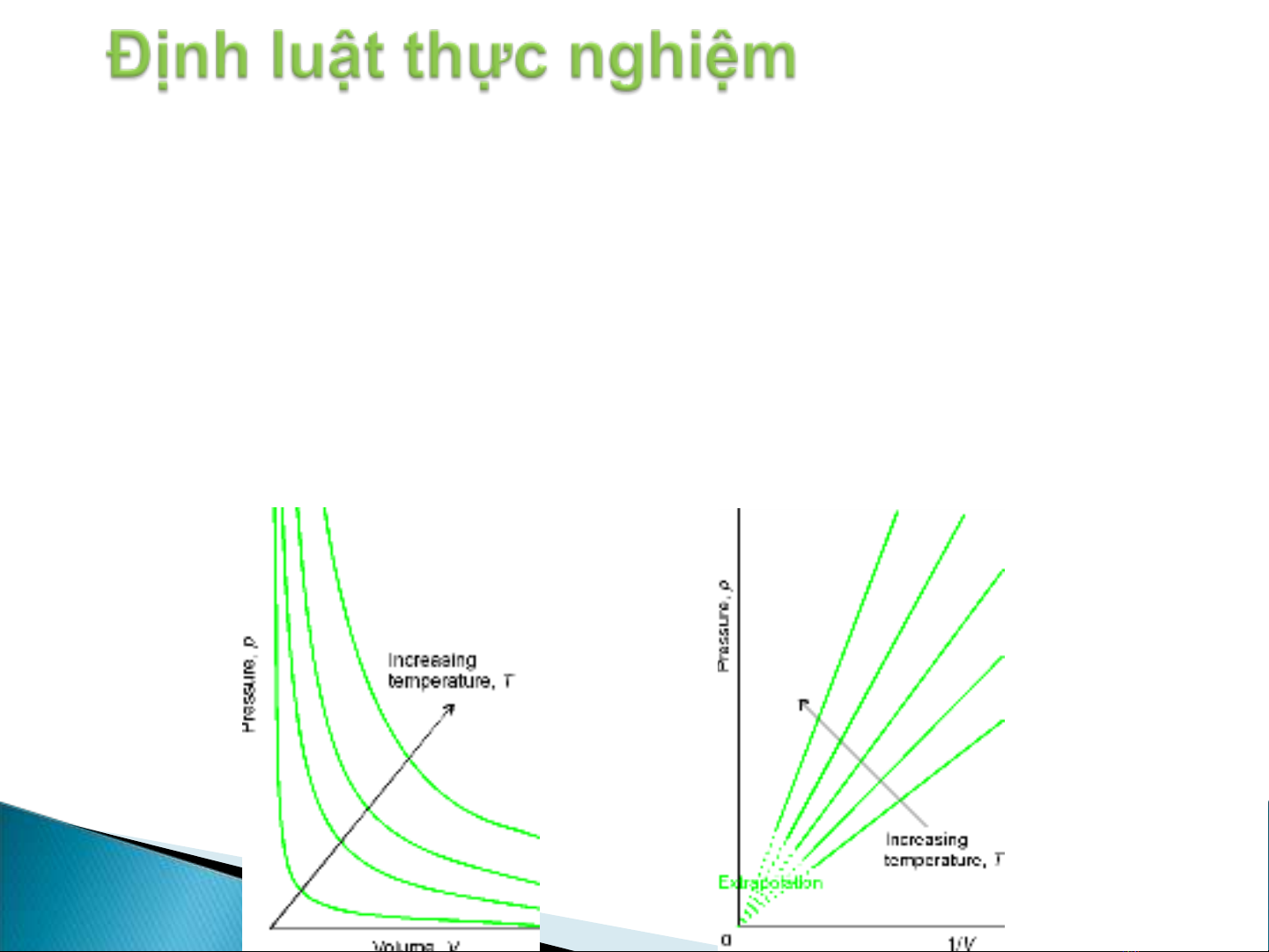
Định luật Boyle-Mariotte
Ở nhiệt độ không đổi, thể tích V của một khối khí W xác định tỷ lệ nghịch
với áp suất p
pV = const hay pV = K
với K = K(T,W) = K(T,n)
Khi n = const, ứng với một nhiệt độ xác định,
đường biểu diễn V theo p được gọi là đường đẳng nhiệt (isotherm)
Chapter 12 4

Một cách biểu diễn khác của đl B-M là vẽ đường pV theo
p ở T=const ứng với một khối khí W xác định. Lúc này ta
có một đường thẳng ngang (Hình 2.2, tr26).
Với các khí thông thường, hệ thức này chỉ đúng trong
trường hợp áp suất thấp (=< áp suất khí quyển) và ở nhiệt
độ thường (không có biến đổi hóa học khi p thay đổi)
5




![Bài giảng Hóa lý thực phẩm [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250716/kimphuong1001/135x160/849_bai-giang-hoa-ly-thuc-pham.jpg)
![Câu hỏi ôn tập Hóa lý [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/kimphuong1001/135x160/51111752043440.jpg)
![Bài giảng Hóa lý 1: Tổng hợp kiến thức [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250704/tiepnguyen438@gmail.com/135x160/6631751621117.jpg)




![Bài giảng Vật lý đại cương Chương 4 Học viện Kỹ thuật mật mã [Chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250925/kimphuong1001/135x160/46461758790667.jpg)














