
HồThịCẩm Hòai, PhD
htchoai@hcmuns.edu.vn

Xem phản ứng đơn giản : A ↔B
(đồng phân hóa alcol cis và trans)
Giả sử một lượng rất nhỏ dξ của A biến thành B, khi đó ta có:
dnA= - dξ
dnB= dξ
Với ξ là tiến độ phản ứng (extent of reaction)
Năng lượng Gibbs được định nghĩa là độ dốc của đường G theo
ξ
Mà :dG = μAdnA+ μBdnB= -μAdξ+ μBdξ= (μB-μA)dξ
Nên ta có:
Tp
r
G
G
,
ABr
Tp
G
G
,
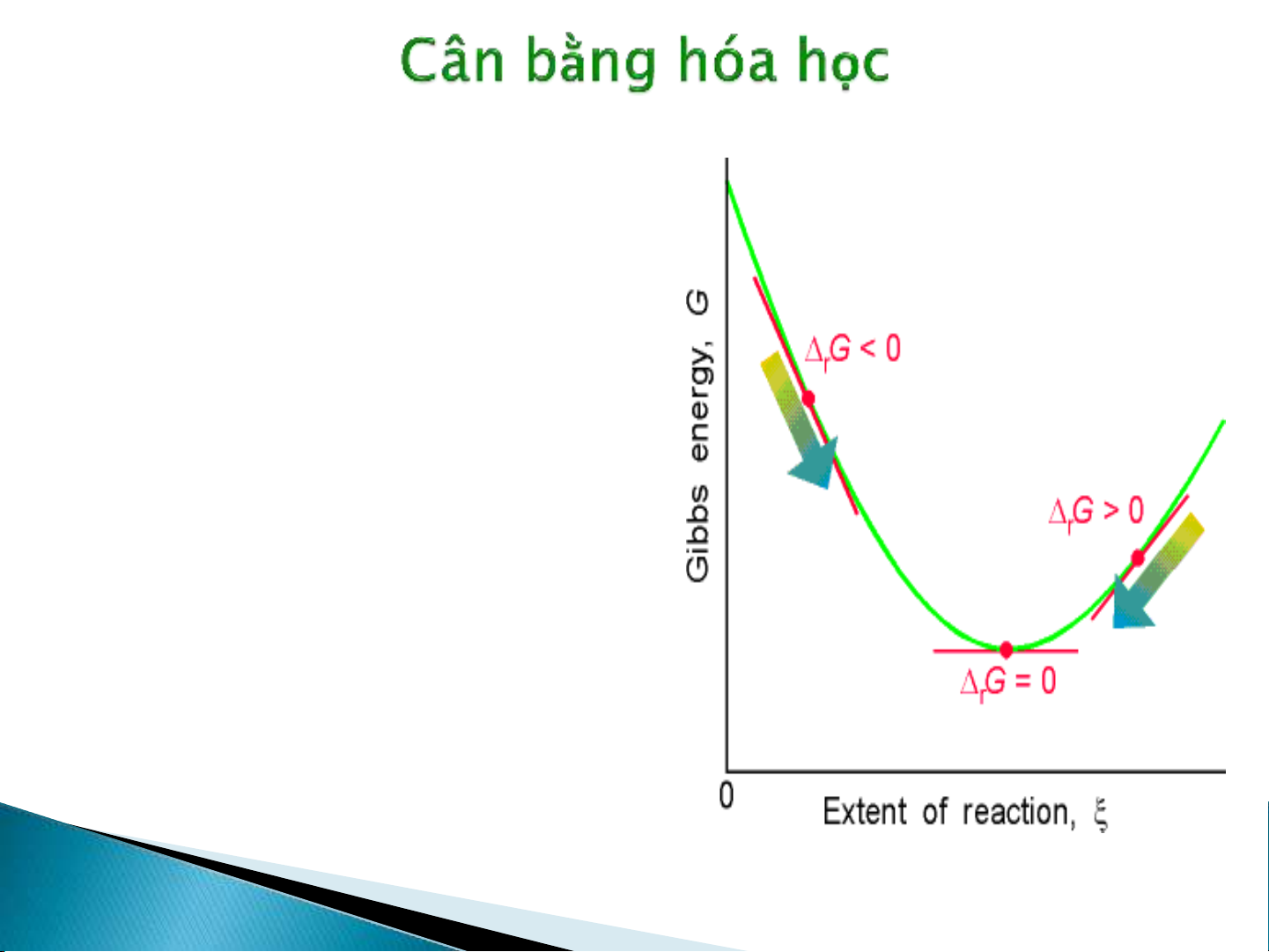
Phản ứng xảy ra theo chiều
làm giảm năng lượng tự do.
Phản ứng thuận xảy ra tự
nhiện khi μB< μA(ΔG <0).
Phản ứng nghịch xảy ra tự
nhiện khi μB> μA. (ΔG <0).
Khi μB= μAhay ΔG =0, phản
ứng đạt cân bằng. Lúc này,
nếu ta xác định được thành
phần hỗn hợp thỏa điều
kiện μB= μAtức là ta biết
được thành phần hỗn hợp
phản ứng tại cân bằng.

Giả sử A, B là khí lý tưởng, ta có:
μA= μoA+ RTlnpA
μB= μoB+ RTlnpB
ΔG = μB-μA= μoB+ RTlnpB–(μoA+ RTlnpA) = ΔGo+ RTln(pB/pA)
Đặt (pB/pA) = Q
Ta có: ΔG = ΔGo+ RTlnQ
Q chính là thương số phản ứng
Tại cân bằng, ta có: ΔG = = μoB-μoA+ RTlnQ = μB-μA
ΔGo = μoB-μoA= - RTlnKp
Vậy: Kp= (pB/pA)cân bằng
Kplà hằng số cân bằng, chỉ phụ thuộc T
Lý luận tương tự, cho phản ứng tổng quát cho khí lý tưởng:
Cho khí thật:
p
o
ii
oKRTGln
i
cbip pK
)(
f
oKRTGln
i
cbif fK
)(

Lý luận tương tự, cho phản ứng trong dung dịch.
Thay áp suất bằng nồng độ cho dung dịch lý tưởng/dung dịch
loãng
Thay áp suất bằng hoạt độ cho dung dịch thật.
Ta có: μi= μoi+ RTlnai
a
o
ii
oKRTGln
c
o
ii
oKRTGln




![Bài giảng Hóa lý thực phẩm [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250716/kimphuong1001/135x160/849_bai-giang-hoa-ly-thuc-pham.jpg)
![Câu hỏi ôn tập Hóa lý [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/kimphuong1001/135x160/51111752043440.jpg)
![Bài giảng Hóa lý 1: Tổng hợp kiến thức [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250704/tiepnguyen438@gmail.com/135x160/6631751621117.jpg)




![Bài giảng Vật lý đại cương Chương 4 Học viện Kỹ thuật mật mã [Chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250925/kimphuong1001/135x160/46461758790667.jpg)














