
PHÂN TÍCH VSV


I. PHNG PHÁP M
TRC TIP
- Dùng xác nh các loi vi sinh vtn bào có
kích thc ln: nm men, ton bào, bào tmc
- Quy trình cho phép xác nh nhanh chóng slng
vi sinh vt
-Không phân bitc tbào sng và cht
-Không phân bitc các tbào vi sinh vt và ht
vt th
-Hn ch i vi huyn phù có mt thp

Bung m vi sinh vt
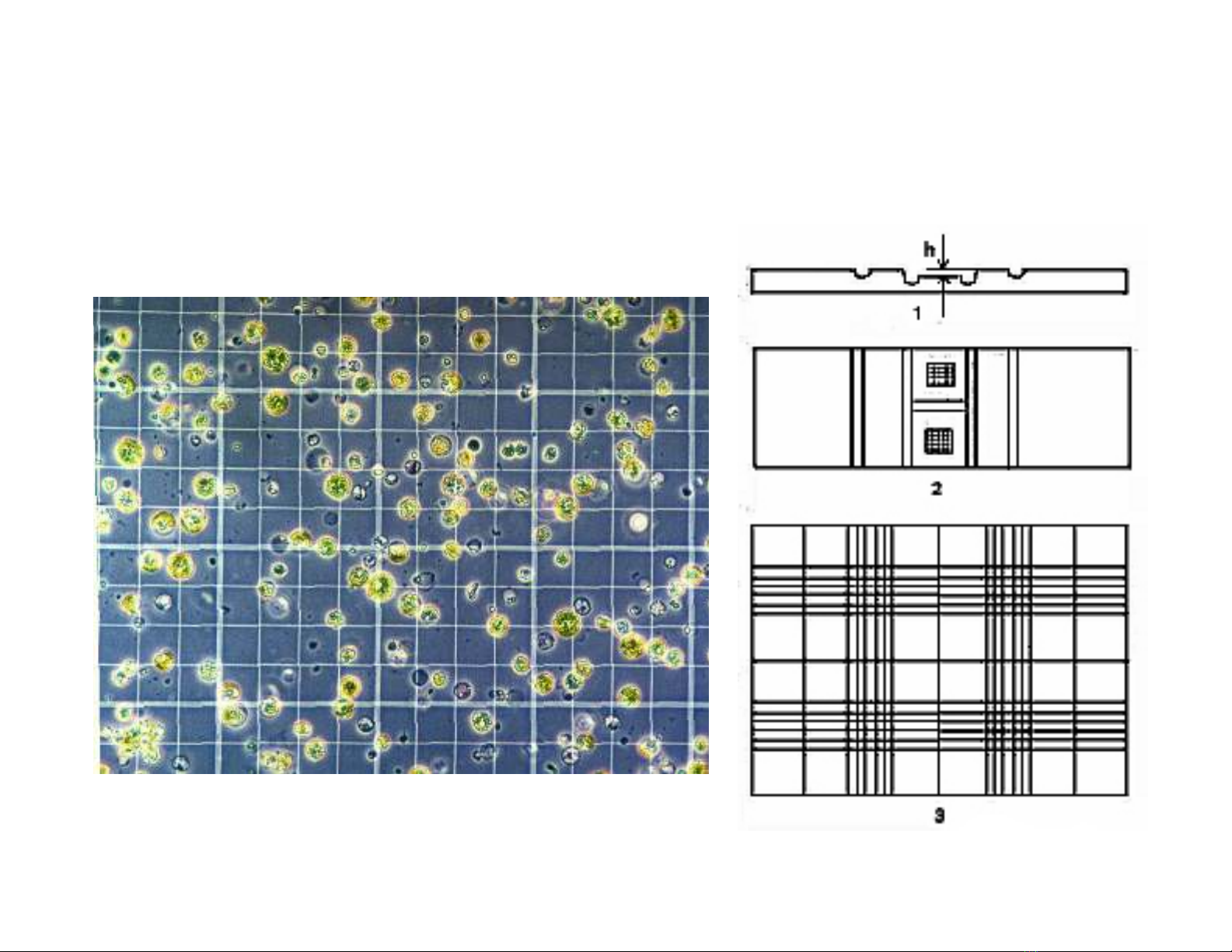
m tr
c ti
p b
ng bu
ng
m h
ng c
u
I.
PHNG PH
Á
P
M
TRC TIP




![Bài giảng Xử lý dụng cụ ăn uống [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2021/20210317/trinhthamhodang10/135x160/7251615979093.jpg)
![Bài giảng Xử lý đồ vải [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2021/20210317/trinhthamhodang10/135x160/3471615979095.jpg)




















