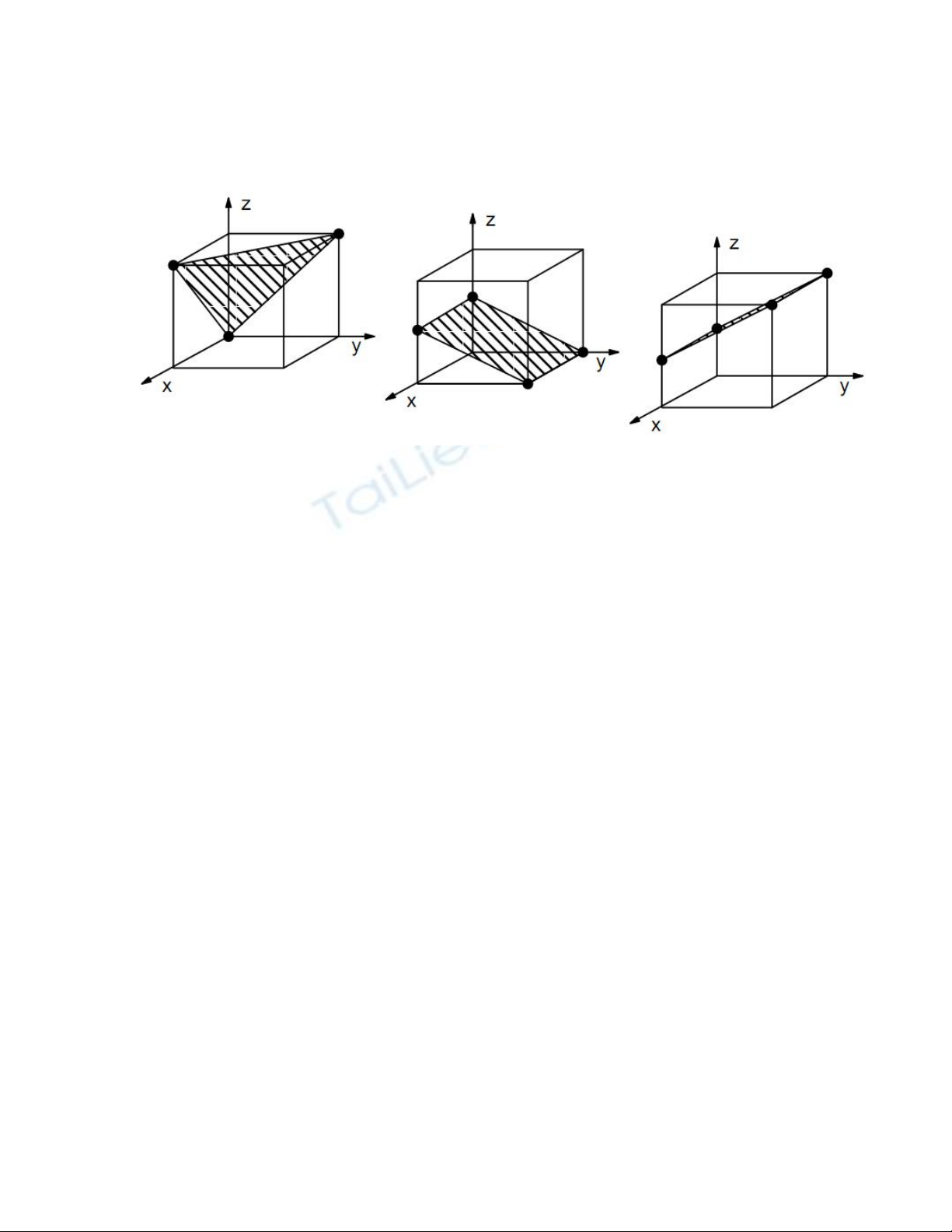
1. Gọi tên (chỉ số Miller) của các mặt tinh thể dưới đây:
2. Xác định khoảng cách lặp lại của các mặt tinh thể thường thấy trong cấu trúc vật liệu như (0
2 0), (1 1 0), (1 1 1), (2 1 1), (3 2 1), ( 3 1 1), (4 0 0).
3. Có bao nhiêu nguyên tử Pb cho 1mm2 ở mặt (1 0 0) và (1 1 1)?
ĐS: 8,2.1012 nguyên tử/mm2 và 9,4.1012 nguyên tử/mm2
4. Bằng phương pháp nhiễu xạ tia X, người ta xác định được khoảng cách d110 của kim loại M
có cấu trúc bcc là 2,03 Å. Tính thông số mạng a và bán kính nguyên tử kim loại M ?
ĐS: a = 2,86 Å và rM = 1,24 Å.
5. Tính hằng số mạng a của Vanadi biết AW =50.94 g/mol, ρ =5.8 g/cm3, biết Vanadi có cấu
trúc BCC.
ĐS: 3.08x10-10 m
6. Mg kết tinh theo mạng lục phương chặt khít. Biết a = b = 0,320 nm.
Tính c, bán kính nguyên tử
Từ kết quả thu được hãy tính tỉ khối của Mg.
Mg = 24,3 g/mol.
ĐS: c = 0,523.10-7 cm
d = 1.74 g/cm3
7. Biết Cu thuộc mạng lập phương tâm diện và có thông số mạng là a = 0,361nm. Tính mật độ
nguyên tử Cu theo phương [1 1 0].
ĐS: 3,9.106 nguyên tử/mm

8. Một kim loại A có thể tồn tại ở 2 dạng thù hình với cấu trúc tinh thể là BCC và FCC. Hãy
tính độ thay đổi thể tích khi kim loại A chuyển từ cấu trúc tinh thể BCC sang cấu trúc tinh
thể FCC ((Vf – Vb) / Vb x 100% ?
ĐS: ΔV = – 8.1%
9. Cho bán kính ion của K+, Cs+, Br- lần lượt là 1,33 Å, 1,65 Å và 1,96 Å. Trên cơ sở bán kính
ion hãy dự đoán xem KBr và CsBr thuộc nhóm mạng tinh thể nào? Từ đó tính toán thông số
mạng a và độ đặt khít của tinh thể.
ĐS: KBr thuộc mạng tinh thể NaCl với a = 6,58 Å và độ đặt khít là 58%
CsBr thuộc mạng tinh thể CsCl với a = 4,17 Å và độ đặt khít là 69%
10. Trong tinh thể CaF2 các ion Ca2+ nằm trên một mạng lập phương tâm diện, còn các ion F-
chiếm tất cả các lỗ trống tứ diện. Bán kính của các ion Ca2+ và F- tương tứng bằng 0,099 và
0,133 nm.
Tính:
- Thông số mạng a.
- Độ đặc khít PF(Packing Factor).
- Khối lượng riêng của CaF2
CaF2 = 78 g/mol.
ĐS: a = 0,536 nm
PF = 0,62
d =3,377 g/cm3
11. Xác định dung sai τ của các cấu trúc perovskit sau đây:
a) SrTiO3
b) BaTiO3
Biết bán kính các ion Sr2+, Ti4+, O2-, Ba2+ lần lượt là (bán kính Goldschmidt-đơn vị pm) 158,
74.5, 140, 135.
Dự đoán kiểu biến dạng của các cấu trúc này.
ĐS: SrTiO3 τ = 0.98 cấu trúc lập phương
BaTiO3 τ = 0.91 biến dạng vuông phẳng
12. Xác định năng lượng mạng lưới tinh thể của NaCl, biết (kJ/mol):
ΔH (NaCl) = -411,2;
ΔHo (thăng hoa Na) = 107,3;

ΔHo (phân ly Cl2) = 240;
ΔHo (ion hóa Na) = 496;
ΔHo (tạo anion Cl) = -349.
ĐS: Ui = -788,5 kJ/mol
13. Tính năng lượng mạng tinh thể LiF biết:
- Nhiệt thăng hoa của Li là 155,2 kJ/mol
- Năng lượng liên kết của Flo là 150,6 kJ/mol
- Năng lượng ion hóa thứ nhất của Li là 520 kJ/mol
- Ái lực điện tử của Flo là -333 kJ/mol
- Nhiệt tạo thành của LiF là -594,1 kJ/mol
ĐS: Ui = -1011,6 kJ/mol














![Bài tập tối ưu trong gia công cắt gọt [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251129/dinhd8055/135x160/26351764558606.jpg)











