
LOGO
NHÓM 4A
GVHD:Tr n T. Ng c Maiầ ọ
Trường Đại Học Công Nghiêp Thực Phẩm
TP. Hồ Chí Minh
Khoa: CNSH & KTMT
MÔN: CƠ SỞ MÔI TRƯỜNG
B ng phân công công vi cả ệ
H và tênọMSSV Công vi cệ
Đ ng Hoàng Y nặ ế 2009120168 Quá trình trung hòa
và trung hòa n c ướ
th iả
Nguy n T Kim ễ
Ngân
2009120121 Quá trình trung hòa
và trung hòa n c ướ
th iả
Đinh Th Ng cị ọ 2009120163 n đ nh hóa n cỔ ị ướ
Vòng Công Thành 2009120174 Quá trình trao đ iổ
www.themegallery.
com
Company Logo

Tài li u tham kh oệ ả
vNguy n Đ c L ng, công ngh sinh h c môi ễ ứ ượ ệ ọ
tr ng NXB ĐH Qu c gia TP HCM.ườ ố
vL ng Đ c Ph m, c s khoa h c trong công ươ ứ ẩ ơ ở ọ
ngh môi tr ng(t p 3),NXB Giáo d c Vi t ệ ườ ậ ụ ệ
Nam.
vTr n Văn Nhân, Ngô Th Nga, Giáo trình công ầ ị
ngh x lý n c th i, NXB KH&KT.ệ ử ướ ả
www.themegallery.
com
Company Logo

www.themegallery.
com
Company Logo
N i dungộ
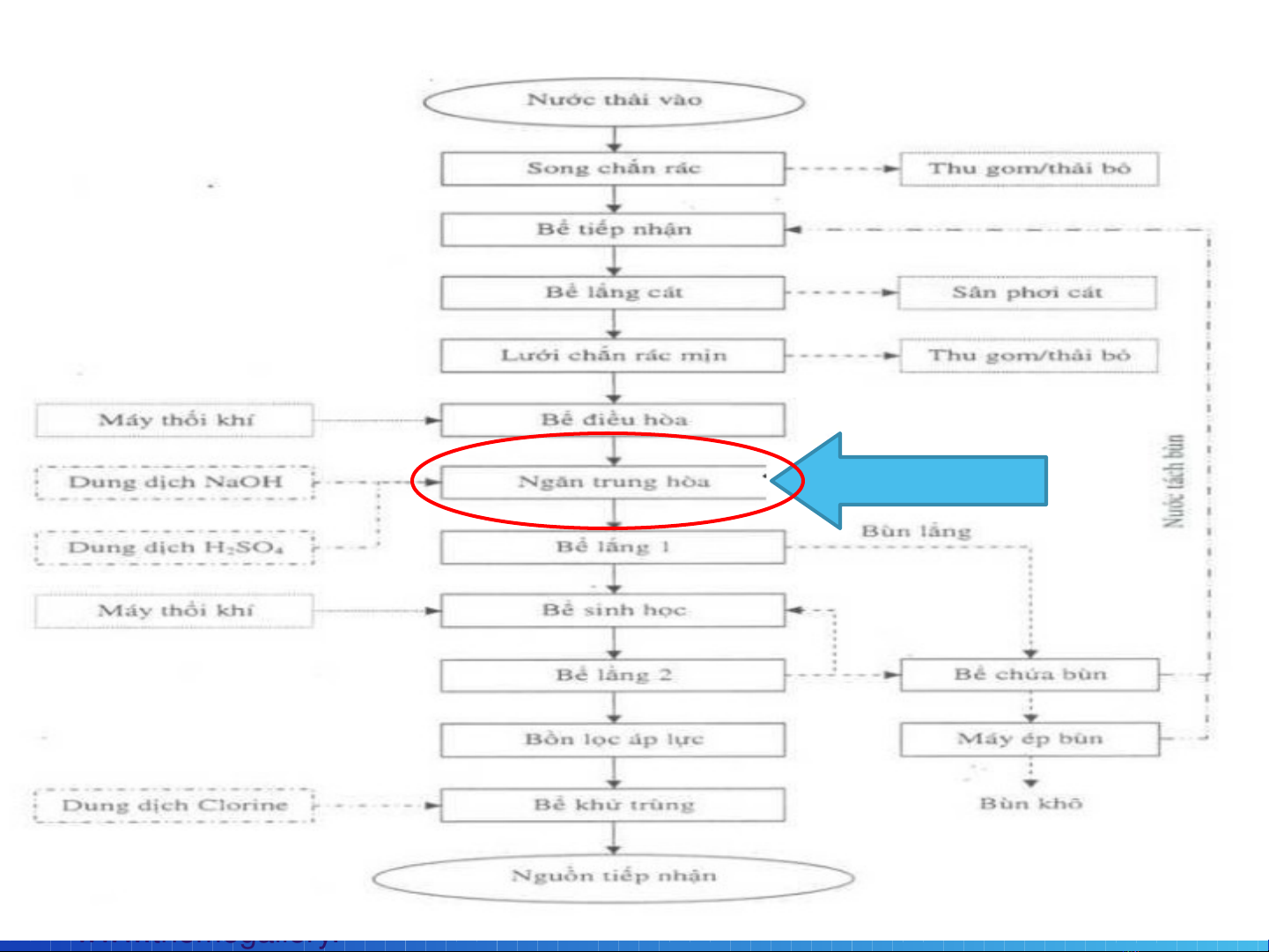
Quá trình trung hòa
1
Trung hòa n c th iướ ả
n đ nh hóa n cỔ ị ướ
Quá trình trao
đ iổ
2
www.themegallery.
com
Company Logo


























