TẠP CHÍ Y HỌC VIỆT NAM TẬP 478 - THÁNG 5 - SỐ 2 - 2019
13
(2011). The effect of diabetes on incidence and
mortality in end-stage renal disease in Germany.
Nephrol Dial Transplant, 26(5), pp. 1634-40.
5. Nguyễn An Giang, Lê Việt Thắng (2013). Khảo
sát tình trạng dinh dưỡng bệnh nhân suy thận mạn
tính lọc máu chu kỳ bằng thang điểm đánh giá
toàn diện. Tạp chí Y học thực hành Bộ Y tế.
6. Vũ Thị Loan (2013). Nghiên cứu nồng độ Kali máu
ở bệnh nhân suy thận mạn chưa lọc máu. Luận văn
tốt nghiệp bác sỹ nội trú, Học Viện Quân Y.
7. Sarafidis P.A., Blacklock R., Wood E., et al.
(2012). Prevalence and factors associated with
hyperkalemia in predialysis patients followed in a
low clearance clinis. Clin J Am Soc Nephrol, 7, pp.
1234 - 1241.
8. Phạm Xuân Thu, Nguyễn Đình Dương, Lê Việt
Thắng (2012). Nghiên cứu tỷ lệ, đặc điểm rối
loạn lipid máu ở bệnh nhân suy thận mạn tính thận
nhân tạo chu kỳ. Tạp chí Y học thực hành, Bộ Y tế,
840: 47- 51.
ĐÁNH GIÁ HIỆU QUẢ LI GIẢI TẾ BÀO UNG THƯ BIỂU MÔ VẢY
ĐẦU CỔ CỦA VIRUS VACCINE SỞI VÀ KHÁNG THỂ ĐƠN DÒNG
NIMOTUZUMAB DÙNG PHỐI HỢP IN VITRO
Ngô Thu Hằng**, Hồ Anh Sơn*, Nguyễn Lĩnh Toàn*
TÓM TẮT4
Mục tiêu: Đánh giá hiệu quả li giải tế bào ung thư
biểu mô vảy đầu cổ Hep2 của virus vaccin sởi và
Nimotuzumab in vitro. Đối tượng và phương pháp:
Virus vaccine sởi (MeV) và Nimotuzumab được sử
dụng để đánh giá khả năng ly giải tế bào. Tế bào
Hep2 nhiễm virus được thu thập ở thời điểm 72 giờ,
96 giờ để làm nghiệm pháp MTT, tính liều ức chế 50%
tế bào Hep2 (IC50) của Nimotuzumab. Kết quả: Tỉ lệ
tế bào sống ở các nhóm điều trị với MeV thấp hơn có
nghĩa thống kê (p<0,001) so với nhóm chứng. Tỉ lệ tế
bào sống ở nhóm điều trị kết hợp MeV và
Nimotuzumab thấp hơn có nghĩa thống kê (p<0,001)
so với nhóm điều trị đơn với MeV hoặc Nimotuzumab.
Kết luận: Phối hợp vaccine MeV và Nimotuzumab có
tác dụng gây li giải tế bào Hep2 tăng cao rõ rệt so với
điều trị đơn in vitro.
Từ khóa:
Ung thư đầu cổ, MeV, Nimotuzumab,
nghiệm pháp MTT
SUMMARY
EVALUATING THE ONCOLYTIC EFFECT OF
VACCINE-STRAIN MEASLES VIRUS AND
NIMOTUZUMAB COMBINATION AGAINST
HEAD AND NECK SQUAMOUS-CELL
CARCINOMA IN VITRO
Objectives: This study aims to evaluate of
oncolytic effects of vacine-strain measles virus and
Nimotuzumab combination against head and neck
squamous-cell carcinoma in vitro. Materials and
methods: Vaccin-strain measles virus (MeV) and
Ninotuzumab were used to evaluated the oncolytic
effects against head and neck squamous-cell
carcinoma cell line (Hep2). Hep2 cells treated with
*Học viện Quân y;
**Trường Cao đẳng Y tế Hà Đông
Chịu trách nhiệm chính: Nguyễn Lĩnh Toàn.
Email: toannl@vmmu.edu.vn
Ngày nhận bài: 24/3/2019
Ngày phản biện khoa học: 29/4/2019
Ngày duyệt bài: 5/4/2019
MeV, Nimotuzumab and MeV+Nimotuzumab were
collected at 72 hours and 96 hours to perform MTT
assay. Results: The proportion of living cells in
treated groups was significantly lower compared to
control group (p<0.001). The proportion of living cells
in the group treated with MeV+Nimotuzumab
combination was significantly lower compared to
single treatment with MeV or Nimotuzumab
(p<0.001). Conclusion: Combination of Vaccine-Strain
Measles virus and Nimotuzumab increases oncolytic
activity against head and neck cancer cell line Hep2.
Keywords:
Head and neck squamous-cell
carcinoma, measles virus, Nimotuzumab, MTT assay.
I. ĐẶT VẤN ĐỀ
Ung thư đầu cổ (UTĐC) là thuật ngữ dùng cho
nhiều khối u ác tính phát triển trong khu vực này
của cơ thể bao gồm: xoang mũi, xoang cạnh mũi,
vòm mũi họng, thanh quản, hạ họng, khoang
miệng và hầu họng. Khoảng 90% ung thư đầu cổ
có mô bệnh học là ung thư biểu mô tế bào vảy
[1]. Trên thế giới, UTĐC đứng hàng thứ bẩy và
chiếm tỷ lệ khoảng 4,8% tổng số các ca ung thư
mới chẩn đoán. Ở Việt Nam hàng năm có khoảng
7,8% bệnh nhân được chẩn đoán là UTĐC trong
tổng số các bệnh nhân ung thư [2].
Trị liệu bằng virus li giải tế bào ung thư
(Oncolytic virus -OLV) dựa trên cơ chế là các OLV
có khả năng xâm nhập đặc hiệu vào các tế bào
ung thư của khối u, nhân lên, giải phóng và gây li
giải tế bào ung thư; kích thích các tế bào ung thư
chết theo chương trình; kích thích đáp ứng miễn
dịch chống ung thư [3]. Các nghiên cứu đã cho
thấy virus vaccine sởi (Measles virus vaccine; MeV)
là một OLV an toàn, có khả năng phân giải tế bào
ung thư in vitro, in vivo và đang tiến hành các thử
nghiệm lâm sàng trên người [4, 5]
Nimotuzumab là kháng thể đơn dòng kháng
thụ thể EGFR (epidermal growth factor receptor)
gắn vào miền ngoại bào của EGFR, ngăn cản hai

vietnam medical journal n02 - MAY - 2019
14
tiểu phần của EGFR gắn kết để hoạt hoá nội bào
gây cản trở truyền tín hiệu vào trong tế bào có
tác dụng chống tăng sinh mạch, kìm hãm tăng
sinh tế bào, cảm ứng tế bào chết theo chương
trình (apoptosis), làm tế bào tăng nhạy cảm với
xạ trị và hóa trị liệu [6].
Tuy nhiên, đến nay chưa có nghiên cứu đánh
giá hiệu quả li giải tế bào ung thư biểu mô vảy
đầu cổ của vaccine MeV và Nimotuzumab. Do
đó, chúng tôi tiến hành đề tài này nhằm đánh
giá khả năng li giải tế bào ung thư biểu mô vảy
đầu cổ (Hep 2) của virus vaccin sởi và
Nimotuzumab in vitro.
II. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng, vật liệu nghiên cứu: Tế
bào ung thư biểu mô vảy đầu cổ người Hep-2
(ATCC CCL-23, laryngeal SCC) được cung cấp bởi
công ty ATCC (American Type Culture Collection,
P.O. Box 1549, Manassas, VA 20108 USA) được
bảo quản tại labo nghiên cứu ung thư của Bộ
môn Sinh lý bệnh - Học viện Quân y.
Virus vaccine Sởi (MeV) chủng Edmonton
được phân lập, tăng sinh từ vaccine Priorix
(GlaxosmithKline, Anh). Chế phẩm kháng thể
đơn dòng Nimotuzumab được nhập khẩu từ Cu
Ba, dưới tên CIMAher, hàm lượng 5mg/ml.
2.2. Phương pháp nghiên cứu
2.2.1. Thiết kế nghiên cứu. Nghiên cứu
được thiết kế là nghiên cứu thực nghiệm, mô tả
cắt ngang có đối chứng.
2.2.2. Các kỹ thuật s dụng trong
nghiên cứu
- Kỹ thuật nuôi cấy các dòng tế bào ung
thư: Tế bào thận khỉ (Vero cells) được nuôi
bằng môi trường M199, phục vụ cho mục đích
tăng sinh virus. Tế bào Hep2 được nuôi cấy trên
chai nuôi cấy tế bào có bổ sung 10% FBS, 1%
Penicillin và Streptomycin, nhiệt độ 37oC, CO2
5%. Thu tế bào Hep2 bằng Trypsin EDTA, sau
đó li tâm để loại bỏ môi trường thu tế bào.
- Phương pháp chuẩn độ virus (TCID50):
Tế bào Vero được gieo vào các giếng trên đĩa 96
giếng với nồng độ tế bào 104 TB/200l/1 giếng
(370C, 5% CO2). Sau 24 giờ kiểm tra tế bào trên
đĩa 96 giếng dưới kính hiển vi, tế bào Vero bám
đáy tốt. Tiến hành nhiễm virus vào các giếng
trên đĩa 96 giếng bằng dịch virus theo hàng B, C,
D, E, F, G tương ứng với nồng độ pha loãng
stock virus từ 10-2 đến 10-7. Kiểm tra tế bào Vero
nhiễm virus ở các giếng trên đĩa 96 giếng hàng
ngày dưới kính hiển vi. Đến ngày thứ 7 nhiễm
virus, các giếng có hình ảnh nhiễm virus rõ, tiến
hành nhuộm xanh thylen và tính TCID50 theo
công thức:
I: Khoảng tỉ lệ (PD) = (% CPE trên 50%) – (50%)
(% CPE trên 50%) – (% CPE dưới 50%)
II: Log của nồng độ pha loãng có CPE trên
50% (nghĩa là 10-3 sẽ là 3)
III: [(PD)+(-log của nồng độ pha loãng có
CPE trên 50%)]
IV: TCID50 = 10III/ml (CPE là hiệu ứng gây
độc tế bào)
- Nghiệm pháp MTT. Tế bào Hep2 được lấy
từ tủ âm sâu -800C, gieo vào đĩa nuôi cấy
100x20mm, thêm môi trường nuôi cấy (RPMI,
10% FBS, 1% kháng sinh). Khi tế bào bám đáy
và phát triển tốt, tiến hành tách thu tê bào, điều
chỉnh để đạt nồng độ 104 tế bào/mL. Gieo tế bào
Hep2 vào 2 đĩa 96 giếng (mỗi giếng chứa 200 µl
môi trường nuôi cấy chứa tế bào tương ứng với
2000 tế bào) cho 2 thời điểm (nhiễm virus 72 giờ
và 96 giờ).
Sau 24 giờ kiểm tra tế bào Hep2 ở các đĩa 96
giếng dưới kính hiển vi, nếu tế bào bám đáy tốt,
tiến hành hút bỏ môi trường nuôi cấy cũ thay
bằng 200 µl môi trường nuôi cấy mới ở nhóm
chứng; 200 µl môi trường nuôi cấy mới có bổ
sung MeV với 7 nồng độ pha loãng từ 10-2 đến
10-8 liều gây nhiễm tối ưu (MOI) ở nhóm MeV;
200 µl môi trường nuôi cấy mới có bổ sung
Nimotuzumab với liều 100µg/mL ở nhóm
Nimotuzumab; 200 µl môi trường nuôi cấy mới
có bổ sung Nimotuzumab với liều 100 µg/mL và
MeV với 7 nồng độ pha loãng từ 10-2 đến 10-8
liều MOI. Kiểm tra tế bào đã nhiễm virus ở đĩa
96 giếng hàng ngày, đến ngày thứ 3, 4 (72 giờ
và 96 giờ) thì tiến hành làm nghiệm pháp MTT
và tính kết quả tỉ lệ tế bào sống ở các nhóm.
Loại bỏ hết dịch nuôi cấy tế bào ở các giếng
trên đĩa 96 giếng. Cho 100 l dung dịch nuôi cấy
có 10% MTT vào trong mỗi giếng, ủ trong 4 giờ.
Sau đó, loại hút bỏ nhẹ hàng toàn bộ dịch nổi
trong mỗi giếng ở đĩa 96 giếng (tránh hút cả các
tinh thể formazan màu tím), cho 100 l dung
dịch M-8910 vào từng giếng. Lắc nhẹ để hòa tan
hết các tinh thể MTT. Đo hấp thụ OD ở bước
sóng 490 nm, tính kết quả theo công thức:
%OD=OD nhóm điều trị/OD nhóm chứng.
- Tính liều ức chế 50% tế bào Hep2
(IC50) của Nimotuzumab. Dựa trên tỷ lệ tế
bào sống trong các nhóm nghiên cứu ở các nồng
độ Nimotuzumab khác nhau (400, 200, 100, 50
và 25 µg/mL) lập phương trình hồi quy tuyến
tính tính giữa tỷ lệ tế bào sống (Y,%) và nồng
độ Nimotuzumab (X,mg/mL). Phương trình hồi
quy tuyến tính có dạng: Y=a+bX. Từ phương
trình hồi quy tuyến tính để tính liều ức chế 50%
tế bào (IC50) của Nimotuzumab ở các thời điểm

TẠP CHÍ Y HỌC VIỆT NAM TẬP 478 - THÁNG 5 - SỐ 2 - 2019
15
72 giờ, 96 giờ trên dòng tế bàoHep2 theo công
thức: IC50=(50-a)/b.
2.3. X l thống kê: So sánh trung bình của
2 nhóm độc lập bằng T-test, so sánh trung bình
của 3 nhóm bằng phân tích phương sai ANOVA.
Số liệu được xử lý bằng phần mềm SPSS 20.0 và
GraphPad Prism 6. Sự khác biệt có ý nghĩa thống
kê khi p< 0,05.
III. KẾT QUẢ NGHIÊN CỨU
3.1. Kết quả chuẩn độ virus TCID50 và
liều ức chế 50% tế bào Hep2 (IC50) của
Nimotuzumab. Ngày thứ 7 nhiễm virus MeV vào
các giếng 96 chứa tế bào Vero, các giếng có hình
ảnh nhiễm virus rõ, tiến hành nhuộm xanh thylen
và tính TCID50. Chuẩn độ TCID50 của MeV ở hàng
tương ứng với nồng độ pha loãng 10-6 của virus
có số giếng có hiệu ứng bệnh lý tế bào là 7/10
>50%. Ở hàng tương ứng với nồng độ pha loãng
10-5 của virus với số giếng có hiệu ứng bệnh lý tế
bào là 3/10 <50%. Như vậy: khoảng tỉ lệ
(PD)=(7/10-5/10):(7/10-3/10)=0,5. Log của nồng
độ pha loãng có CPE trên 50%: -log (10-6)=6.
TCID50 của MeV= 106+0,5/0,2 mL = 5x106,5/mL.
Liều ức chế 50% tế bào (IC50) của
Nimotuzumab trên dòngtế bào ung thư Hep2 sau
72 giờ là: IC50=2146µg/mL; 96 giờ là: IC50 =
876.9 µg/mL (Hình 1).
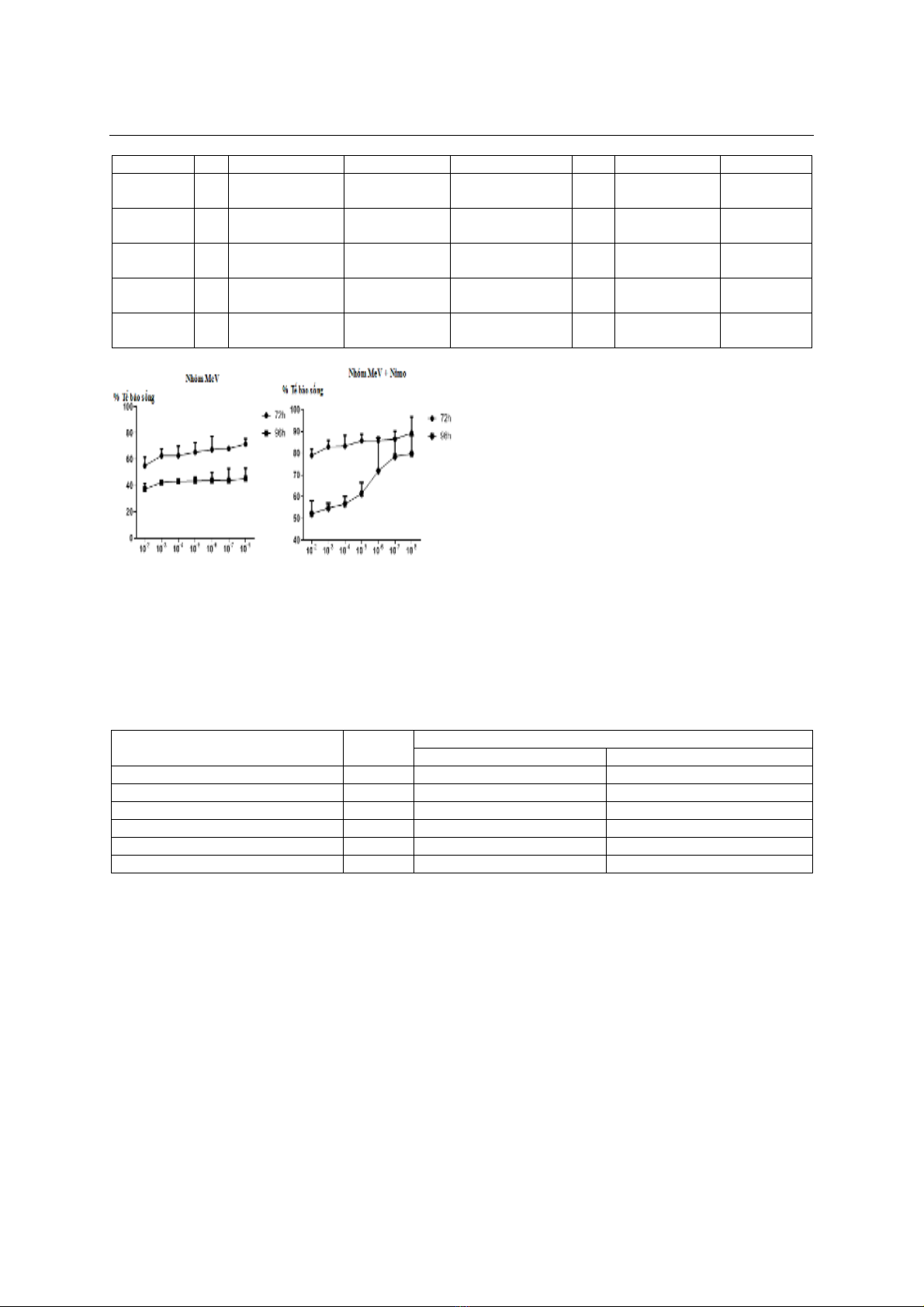
Hình 1. Mối liên quan giữa tỷ lệ tế bào Hep2
sống (Y,%) và nồng độ Nimotuzumab (X, µg/ml)
sau 72 giờ, 96 giờ
3.2. Tế bào Hep2 nhiễm virus tạo hợp
bào in vitro. Tế bào Hep2 được nuôi cấy và
nhiễm virus nồng độ 1 MOI. Kiểm tra hình ảnh tế
bào nhiễm virus hàng ngày bằng kính hiển vi
thường cho thấy hình ảnh biến đổi của tế bào
Hep2 nhiễm virus theo thời gian. 24 giờ sau
nhiễm virus tế bào Hep2 có xu hướng thu nhỏ,
co cụm lại. Ngày 2 nhiễm virus, tế bào co nhỏ
lại, tập hợp lại thành từng đám tế bào (hợp
bào), có xu hướng bong ra tách khỏi bề mặt nuôi
cấy. Đến ngày thứ 3 tế bào Hep2 nhiễm virus đã
hình thành hợp bào rất rõ, bong ra khỏi bề mặt
nuôi cấy. Ngày thứ 4, các hợp bào ngày càng lớn
và nổi rõ trên nuôi trường nuôi cấy, số lượng tế
bào bám đáy còn lại ít. Ngày 5, tế bào Hep2
bong khỏi đáy hình thành hợp bào gần hoàn
toàn, các hợp bào có xu thế phân hủy kèm theo
tế bào chết để lại hình ảnh xác và các mảnh vỡ
tế bào (hình 2).
Hình 2. Hình ảnh tế bào Hep2 nhiễm virus tạo
hợp bào
3.3. Tác dụng kháng ung thư của MeV và
Nimotuzumab bằng nghiệm pháp MTT
Tỉ lệ tế bào sống ở ba nhóm điều trị: nhóm
điều trị bằng MeV, Nimotuzumab và phối hợp
MeV/Nimotuzumab thấp hơn có ýnghĩa thống kê
(p<0,001) so với nhóm chứng ở tất cả các nồng
độ pha loãng của MeV từ 10-2 đến 10-8 (hình 4,
hình 5). Ở tất cả nồng độ pha loãng MeV, tỉ lệ tế
bào sống của nhóm điều trị phối hợp
MeV/Nimotuzumab (Nimotuzumab nồng độ
100µg/mL) đều thấp hơn ở nhóm nhiễm đơn
MeV và nhóm nhiễm Nimotuzumab nồng độ
100µg/mL, sự khác biệt này có ý nghĩa thống kê
(p<0,001) ở tất cả các nồng độ pha loãng từ 102
-10-8 (Bảng 1).
Bảng 1. Kết quả tỷ lệ tế bào Hep2 sống của thử nghiệm MTT ở thời điểm 72 giờ và 96 giờ
Nhóm
n
% OD
Nhóm
n
% OD
72 giờ (%)
96 giờ (%)
72 giờ (%)
96 giờ(%)
Chứng
(0)
12
100%
100%
Nimotuzumab
100µg/mL
8
89,96 ±3,75
58,45
±3,87
MeV 10-2
MOI
4
78,99 ± 2,88
52,08
±6,09
MeV 10-2/
Nimotuzumab
4
55,08 ±6,55
37,28
±4,08
MeV 10-3
4
82,93 ± 3,65
54,70 ±2,26
MeV 10-3/
4
62,60 ±5,19
42,25
vietnam medical journal n02 - MAY - 2019
16
MOI
Nimotuzumab
±1,33
MeV 10-4
MOI
4
83,28 ± 4,90
56,65 ±3,55
MeV 10-4/
Nimotuzumab
4
62,67 ±7,23
43,12
±1,89
MeV 10-5
MOI
4
85,74 ±2,92
61,42 ±5,06
MeV 10-5/
Nimotuzumab
4
65,35 ±7,30
43,51
±2,85
MeV 10-6
MOI
4
85,81 ±1,61
71,84±15,06
MeV 10-6/
Nimotuzumab
4
67,39±10,02
43,90
±5,82
MeV 10-7
MOI
4
86,45 ±3,72
78,55 ±8,18
MeV 10-7/
Nimotuzumab
4
68,02 ±1,31
43,80
±9,02
MeV 10-8
MOI
4
89,33 ±7,34
79,72 ±8,43
MeV 10-8
/Nimotuzumab
4
71,54 ±4,04
45,26
±7,84
Hình 3. So sánh kết quả MTT ở thời điểm 72 và 96 giờ
Tỷ lệ tế bào sống tăng dần ở tất cả những
nồng độ pha loãng MeV từ 10-2 đến 10-8, sự khác
biệt có ý nghĩa thống kê ở hầu hết các nồng độ
pha loãng từ 10-2 đến 10-8 (p<0,05). Kết quả
nghiệm pháp MTT còn cho thấy tỉ lệ tế bào sống
giảm theo thời gian nhiễm MeV. Tỷ lệ tế bào
sống ở thời điểm các giếng nhiễm MeV ở thời
điểm 96 giờ đều thấp hơn ở thời điểm 72 giờ ở
tất cả các nồng độ từ 10-2 đến 10-8, sự khác biệt
này có ý nghĩa thống kê với p<0,0001. Nồng độ
càng cao sự khác biệt về tỷ lệ tế bào sống càng
khác biệt rõ rệt (Hình 3).
Thử nghiệm MTT cho kết quả ở nồng độ
Nimotuzumab càng cao thì số lượng tế bào Hep2
sống sót càng giảm (mật độ quang chất màu
giảm). Tỷ lệ tế bào sống tăng dần ở tất cả
những nồng độ pha loãng Nimotuzumab từ 400
µg/mL đến 25 µg/mL ở cả thời điểm 72 giờ và 96
giờ. Ở cả hai thời điểm 72 giờ và 96 giờ, sự khác
biệt chỉ có ý nghĩa thống kê (p<0,05) ở nồng độ
400 µg/mL và 25 µg/mL. Tỉ lệ tế bào sống giảm
theo thời gian, tỷ lệ sống ở tất cả các nồng độ
Nimotuzumab từ 400 µg/mL đến 25 µg/mL ở
thời điểm 72 giờ cao hơn ở thời điểm 96 giờ,
khác biệt ý nghĩa thống kê (p<0,0001) (Bảng 2).
Bảng 2. Kết quả tỷ lệ tế bào Hep2 sống của thử nghiệm MTT ở nhóm Nimotuzumab
Nhóm
n
% OD
Thời điểm 72 giờ (%)
Thời điểm 96 giờ (%)
Chứng (0)
12
100
100
Nimotuzumab 400cmg/mL
4
85,53 ±2,38
58,11 ±3,32
Nimotuzumab 200cmg/mL
4
87,92 ±7,47
61,23 ±6,60
Nimotuzumab 100cmg/mL
8
89,96 ±3,75
58,45 ±3,87
Nimotuzumab 50cmg/mL
4
92,57 ±3,31
62,49 ±14,40
Nimotuzumab 25cmg/mL
8
93,13 ±2,09
67,21 ±8,84
IV. BÀN LUẬN
MeV chủng Edmonston sử dụng các thụ cảm
thể đặc hiệu CD46, có ở bề mặt tất cả các tế bào
có nhân của người, nhưng thường biểu hiện quá
mức ở các tế bào ung thư, đặc biệt là các tế bào
ung thư trong ung thư tế bào vảy [7]. CD46
không chỉ là nơi MeV gắn và xâm nhập vào tế
bào, mà còn thúc đẩy quá trình virus tạo ra sự
hợp bào giữa tế bào bị nhiễm virus và các tế bào
ung thư lân cận [3]. Khi gắn vào thụ thể trên tế
bào khối u, các protein hợp màng HN hay H của
MeV thay đổi cấu hình làm cho màng virus và tế
bào sát lại và hợp nhất với nhau. Các protein
hợp màng của MeV còn kích hoạt quá trình hợp
nhất màng tế bào nhiễm virus với màng tế bào
bình thường lân cận tạo thành hợp bào (một
khối tế bào khổng lồ có nhiều nhân, có nguồn
gốc từ nhiều tế bào [8]. Đây là một cơ chế lây
lan virus mà không cần giải phóng các hạt virus
trưởng thành ra khỏi tế bào. Quá trình hợp nhất
tế bào làm cho virus giảm tiếp xúc với kháng thể
trung hòa của cơ thể vật chủ, tránh được sự
kiểm soát của hệ miễn dịch. Thông thường, các
hợp bào tồn tại không quá 4-5 ngày. Kết quả
quá trình nhiễm MeV vào tế bào Hep2 dựa trên
quan sát bằng kính hiển vi cho thấy từ ngày thứ

TẠP CHÍ Y HỌC VIỆT NAM TẬP 478 - THÁNG 5 - SỐ 2 - 2019
17
2 sau nhiễm virus, tế bào đã co nhỏ lại, tập hợp
lại thành từng đám tế bào, có xu hướng bong ra
tách khỏi bề mặt nuôi cấy, và hình thành các
hợp bào rất rõ ở các ngày tiếp theo.
Nghiệm pháp MTT thường được sử dụng để
đánh giá khả năng lý giải tế bào ung thư của các
OLV in vitro. Trong nghiệm pháp MTT của
nghiên cứu này, chúng tôi khảo sát trên dải nồng
độ nhiễm MeV từ 10-2-10-8, mỗi nồng độ 4 mẫu
thử tại hai thời điểm 72 và 96 giờ. Kết quả đánh
giá tỉ lệ tế bào sống bằng nghiệm pháp MTT của
chúng tôi đã khẳng định khả năng li giải tế bào
Hep2 in vitro của MeV và Nimotuzumab. Ở cả hai
thời điểm khảo sát 72 và 96 giờ thì tỉ lệ tế bào
sống ở ba nhóm điều trị: nhóm điều trị với MeV,
Nimotuzumab và phối hợp MeV/Nimotuzumab
thấp hơn so với nhóm chứng ở tất cả các nồng
độ pha loãng của MeV từ 10-2 đến 10-8. Tỷ lệ tế
bào sống tăng dần ở tất cả những nồng độ pha
loãng MeV từ 10-2 đến 10-8, điều này cho thấy
nồng độ MeV càng thấp thì khả năng li giải tế
bào ung thư càng ít. Tuy nhiên, ngay cả ở nồng
độ pha loãng MeV 10-8- MOI thì tỷ lệ sống ở
nhóm nhiễm MeV và nhóm phối hợp vẫn thấp
hơn so với nhóm chứng, điều này chứng mình
hiệu quả li giải tế bào u Hep2 của MeV in vitro.
Tỉ lệ tế bào sống giảm theo thời gian nhiễm MeV
và Nimotuzumab. Kết quả này cũng tương đồng
với kết quả của một số nghiên cứu đánh giá khả
năng li giải tế bào u của OLV tăng theo nồng độ
và thời gian nhiễm virus. Kết quả của thử
nghiệm MTT cho thấy kết hợp MeV và
Nimotuzumab làm tăng khả năng li giải tế bào
khối u so với điều trị đơn MeV hoặc
Nimotuzumab ở tất cả các nồng độ khảo sát từ
10-2-10-8. Do vậy, việc phối hợp MeV và
Nimotuzumab là một định hướng tốt, nhiều tiềm
năng trong điều trị HNSCC.
V. KẾT LUẬN
Nghiên cứu của chúng tôi cho thấy khả năng
li giải tế bào ung thư đại tràng Hep2 của vaccine
MeV và Nimotuzumab in vitro. Việc phối hợp
vaccine MeV và Nimotuzumab gây li giải tế bào
HEP2 tốt hơn hẳn so với điều trị đơn cả về con
đường trực tiếp (tạo tế hợp bào) và làm tăng tế
bào chết in vitro.
TÀI LIỆU THAM KHẢO
1. Vigneswaran, N. and M.D. Williams,
Epidemiologic trends in head and neck cancer and
aids in diagnosis. Oral Maxillofac Surg Clin North
Am, 2014. 26(2): p. 123-41.
2. Ferlay, J., et al., Cancer incidence and mortality
worldwide: sources, methods and major patterns
in GLOBOCAN 2012. Int J Cancer, 2015. 136(5):
p. E359-86.
3. Msaouel, P., et al., Oncolytic measles virus
strains as novel anticancer agents. Expert Opin Biol
Ther, 2013. 13(4): p. 483-502.
4. Galanis, E., et al., Oncolytic measles virus
expressing the sodium iodide symporter to treat
drug-resistant ovarian cancer. Cancer Res, 2015.
75(1): p. 22-30.
5. Son, H.A., et al., Combination of Vaccine-Strain
Measles and Mumps Viruses Enhances Oncolytic
Activity against Human Solid Malignancies. Cancer
Invest, 2018. 36(2): p. 106-117.
6. Qu, Y.Y., et al., Nimotuzumab enhances the
radiosensitivity of cancer cells in vitro by inhibiting
radiation-induced DNA damage repair. PLoS One,
2013. 8(8): p. e70727.
7. Suominen, E., et al., Head and neck cancer cells
are efficiently infected by Ad5/35 hybrid virus. J
Gene Med, 2006. 8(10): p. 1223-31.
8. Matveeva, O.V., et al., Oncolysis by
paramyxoviruses: multiple mechanisms contribute to
therapeutic efficiency. Mol Ther Oncolytics, 2015. 2.
KẾT QUẢ BƯỚC ĐẦU NỘI SOI CẮT TÚI MẬT KẾT HỢP NỘI SOI
MẬT TỤY NGƯỢC DÒNG (ERCP)
Nguyễn Hoàng Linh*, Nguyễn Khắc Vui*, Nguyễn Đức Vũ*
TÓM TẮT5
Mục tiêu: bước đầu đánh giá kết quả phương
pháp phẫu thuật nội soi cắt túi mật kết hợp với nội soi
mật tụy ngược dòng trong mổ điều trị sỏi túi mật và
sỏi ống mật chủ Phương pháp: Tất cả bệnh nhân sỏi
*Bệnh viện Đa khoa Sài Gòn
Chịu trách nhiệm chính: Nguyễn Hoàng Linh
Email: linhnguyen1967@gmail.com
Ngày nhận bài: 14/3/2019
Ngày phản biện khoa học: 17/4/2019
Ngày duyệt bài: 3/5/2019
ống mật chủ kèm sỏi hoặc polyp túi mật được thực
hiện phẫu thuật nội soi cắt túi mật kết hợp nội soi mật
tụy ngược dòng (ERCP) trong mổ tại khoa Ngoại Tổng
hợp bệnh viện đa khoa Sài Gòn từ tháng 1/ 2014 đến
tháng 12/2018 Kết quả: Tổng cộng có 46 trường hợp
sỏi hoặc polyp túi mật kèm sỏi ống mật chủ được chẩn
đoán và phẫu thuật cắt túi mật nội soi kết hợp nội soi
mật tụy ngược dòng tại Bệnh Viện đa Khoa Sài Gòn từ
1/1/2015 đến 31/12/2018 Kết luận: Việc điều trị có
thể qua nội soi, qua da, mổ nội soi hay mổ mở. Tốt
nhất nên chọn kỹ thuật điều trị mà tại cơ sở các
chuyên gia thông thạo và có nhiều kinh nghiệm nhất
để an toàn cho bệnh nhân hoặc chuyển bệnh nhân











![Tài liệu Triệu chứng học nội khoa [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251204/oanhlahet@gmail.com/135x160/5231764900514.jpg)


![Bài giảng Vi sinh vật: Đại cương về miễn dịch và ứng dụng [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251124/royalnguyen223@gmail.com/135x160/49791764038504.jpg)