UBND HUYỆN AN LÃO
TRƯỜNG THCS LÊ KHẮC CẨN
ĐỀ KIỂM TRA HỌC KỲ II NĂM HỌC 2017-2018
MÔN:HÓA HOC 8
Thời gian làm bài: 45 phút
Giáo viên ra đề: Ngô Xuân Hải
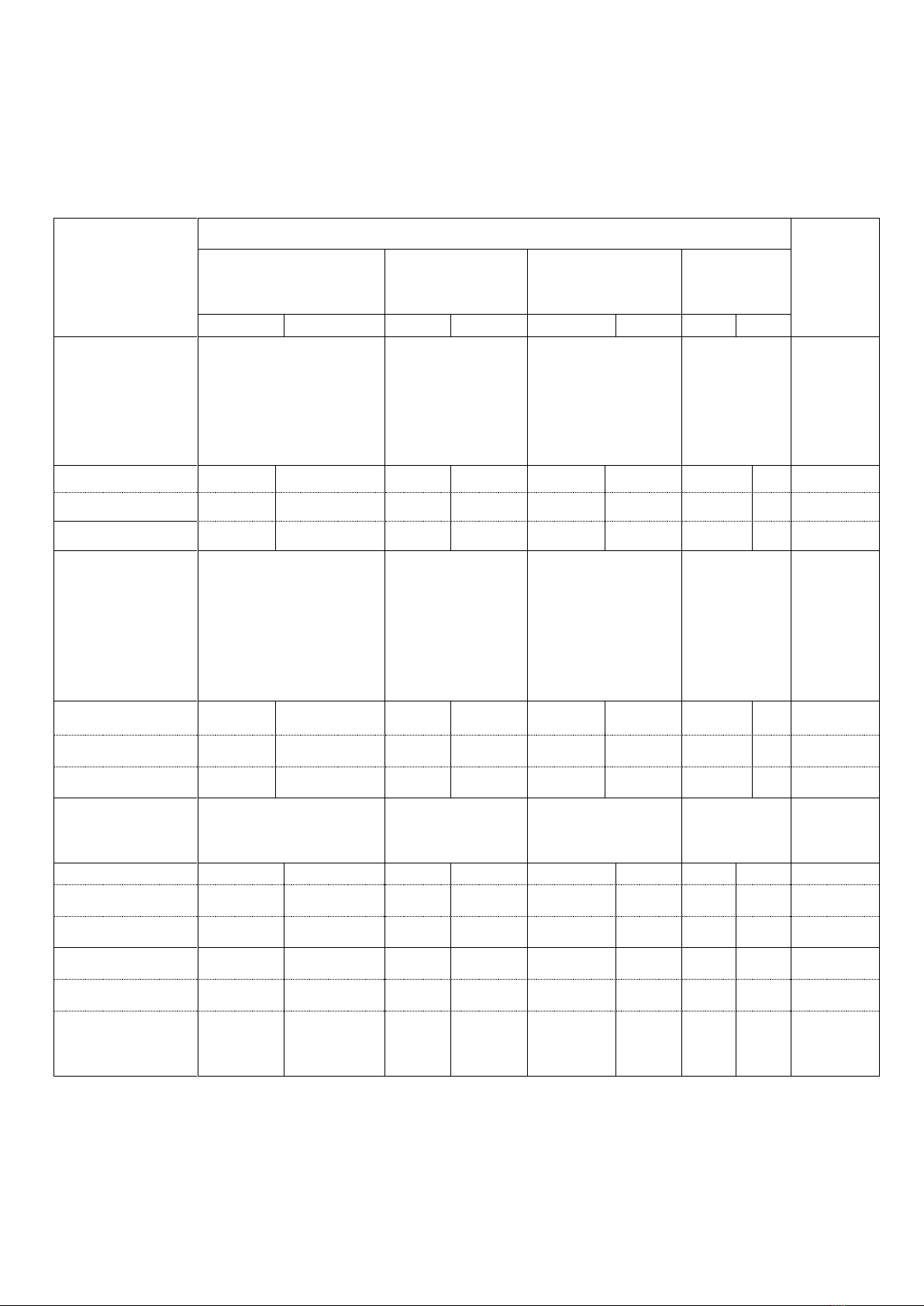
I/ Ma trận
Nội dung kiến
thức
Mức độ nhận thức
Cộng
Nhận biết
Thông hiểu
Vận dụng
Vận dụng ở
mức cao
hơn
TN
TL
TN
TL
TN
TL
TN
TL
o i - không
kh
- iết ph ơng ph p
điều chế o i trong
phòng th nghiệm;
kh i niệm phản ứng
phân hủy Sự o i
hóa,sự o i hóa chậm
- Phân biệt đ ợc
a it ,bazơ, muối
Số câu hỏi
2
1
3
Số điểm
0,5
1,0
1,5
Tỉ lệ
5%
10%
(15%)
Hidro, n c,
phản ứng thế,
phân o i hợp
ch t vô cơ
- iết đ ợc t nh ch t
hóa học của hiđro;
- iết phân biệt đâu à
o it,a t,bazơ ,muối
- T nh ch t hóa học
của n c - T nh thể
t ch kh H2 (đktc)
-Viết các
ph ơng trình
phản ứng theo
dãy chuyển hóa
Số câu hỏi
4
1
5
Số điểm
2,75
2,0
4,75
Tỉ lệ
27,5%
(20%)
(47,5%)
ung d ch và
n ng độ dung
d ch
- iết phân biệt dung
môi,ch t tan,dung
d ch- n ng độ C ,CM.
- Làm bài tập t nh
theo ph ơng trình
hóa học
iết àm bài
tập t nh theo
PTHH.
Số câu hỏi
3
1
1
5
Số điểm
0,75
2,0
1,0
3,75
Tỉ lệ
7,5%
20%
10%
37,5%
Tổng số câu hỏi
9
2
1
1
13
Tổng số điểm
4,0
3,0
2,0
1,0
10,0
Tổng tỉ lệ
(40%)
30%
(20%
)
(10
%)
(100%)
II/ĐỀ BÀI:

UBND HUYỆN AN LÃO
TRƯỜNG THCS LÊ KHẮC CẨN
ĐỀ KIỂM TRA HỌC KỲ II NĂM HỌC 2017-2018
MÔN:HÓA HOC 8
Thời gian làm bài: 45 phút
Giáo viên ra đề: Ngô Xuân Hải
Phần A. Trắc nghiệm(4 điểm)
Câu I. Khoanh tròn vào một trong c c ch , , C ho c đứng tr c ph ơng n đ ng nh t
trong các câu sau:
1 Sự o i ho chậm à:
Sự o i ho toả nhiệt mà không ph t s ng
Sự oxi hoá mà không phát sáng.
C. Sự oxi hoá mà không toả nhiệt.
D. Sự tự bốc cháy.
2. Phản ứng nào d i đây thuộc o i phản ứng phân hủy
A. CO2 + Ca(OH)2 CaCO3 + H2O B. CaO + H2O Ca(OH)2
C. 2KClO3 t0 2KCl + 3O2 D. CuO + H2 t0 Cu + H2O
3. Cho phản ứng sau: HgO + H2
0
t
Hg + H2O Kh Hiđro thể hiện t nh gì trong phản
ứng trên:
A. Kh Hiđro à ch t o i ho B. Kh Hiđro ch t tan
C. Kh Hiđro à ch t ch y D. Kh Hiđro à ch t khử
4 Khử hết , g đ ng (II) o it b ng kh hiđro ở nhiệt độ cao Thể t ch kh hiđro(ở đktc) c n
d ng à:
A. 56 lít B. 5,6 lít C. 0,56 lít D.0,056 lít
5. Nhóm các ch t nào sau đây đều là oxit ?
A. Na2O, CO2 , FeO, P2O5 B. Ca(OH)2, Al2O3, H2SO4, NaOH
C. MgCl2, NaHCO3, K2SO4, Ca(NO3)2 D. NaOH, Ca(OH)2, Mg(OH)2, KOH
6. Khi hòa tan muối CuSO4 vào n c thì
A. muối CuSO4 à dung môi n c là dung d ch.
C. muối CuSO4 là ch t tan n c là ch t tan.
7. Để tính n ng độ mol của dung d ch NaOH, ng ời ta làm thế nào?
A. Tính số gam NaOH có trong 100g dung d ch
B. Tính số gam NaOH có trong 1 lít dung d ch
C. Tính số gam NaOH có trong 1000g dung d ch
D. Tính số mol NaOH có trong 1 lít dung d ch
8. Câu nào đ ng khi nói về n ng độ ph n trăm?
N ng độ ph n trăm là n ng độ cho biết:
A.Số gam ch t tan có trong 100g dung d ch
B. Số gam ch t tan có trong 100g dung d ch bão hoà
C. Số gam ch t tan có trong 100g n c
D. Số gam ch t tan có trong 1 lít dung d ch
Câu II.d ng cụm từ “ oxit axit;o it bazơ; nguyên tố; hiđrô; nguyên tử hiđrô; o i; kim o i;
gốc a it” đề điền vào chỗ trống:

N c à hợp ch t t o bởi hai ( ) à ( ) và ( ) N c t c dụng v i một số (4) ở nhiệt độ
th ờng và một số (5) t o ra bazơ ; t c dụng v i nhiều (6) t o ra axit.
it à hợp ch t mà phân tử g m có một hay nhiều (7) iên kết v i (8)
Phần B. T luận: (6 điểm)
Câu III ( đ)Hoàn thành c c ph ơng trình hóa học sau:
KClO3 (1) O2 (2) FeO (3) Fe (4) FeSO4
Câu IV ( đ)
Nhận biết c c dung d ch sau đựng riêng biệt trong c c ọ m t nhãn: NaOH; HC ; NaC
Câu V. ( đ)Cho 5,6 g Canxi o it t c dụng v i n c thu đ ợc m dung d ch Can i
hiđro it
a. Viết ph ơng trình hóa học cho phản ứng ảy ra
b. T nh n ng độ mo của dung d ch thu đ ợc
c. T nh thể t ch kh CO2 (đktc) vừa đủ t c dụng v i dung d ch Can i hiđro it trên để
t o thành muối trung hòa
Cho biết: Na= 23; O= 16; H =1; C= 12; Fe =56; Cl= 35,5; Ca= 40.

Đ P N
Phần A. Trắc nghiệm(4 điểm)
CÂU I ( điểm)
Câu
1
2
3
4
5
6
7
8
Đ p n
A
C
D
C
A
C
D
A
Điểm
0,25
0,25
0,25
0,25
0,25
0,25
0,25
0,25
Câu II. ( điểm)mỗi đ p n đ ng đ ợc , 5 điểm
1. nguyên tố; hiđrô; o i;4 kim o i; ;5 o it bazơ;6 o it a it;7 nguyên tử hiđrô;7; 8 gốc
axit
Phần B. T luận: (6 điểm)
Câu
Nội dung h ng dẫn ch m
Điểm
CâuIII
( đ)
KClO3 (1) O2 (2) FeO (3) Fe (4) FeSO4
2KClO3 t0 2KCl + 3O2
,5 điểm
O2 + 2Fe t0 2FeO
,5 điểm
FeO + H2 t0 Fe + H2O
,5 điểm
Fe + H2SO4 t0 FeSO4 + H2
(Nếu HS không cân b ng,thiếu điều kiện thì đ ợc , 5 đ/pt)
,5 điểm
CâuIV
( đ)
-L y mỗi ọ một t vào ống nghiệm và đ nh d u
- L n ợt thử b ng quỳ t m nếu:
+ Quỳ t m -> xanh -> dd NaOH
+ Quỳ t m -> đỏ -> dd HCl
+ Q y t m không đổi màu à NaC
, 5 điểm
, 5 điểm
, 5 điểm
, 5 điểm
CâuV
( đ)
a Viết PTHH: CaO + H2O -> Ca(OH)2 (1)
0,5 điểm
b. n CaO = 0,1 mol
- Theo PTHH (1) ta có:
nCa(OH)2 = n CaO = 0,1 mol
=> CM Ca(OH)2 = 0,1/ 0,2 = 0,5 M
,5 điểm
,5 điểm
,5 điểm
c. – PTHH: CO2 + Ca(OH)2 -> CaCO3 + H2O (2)
Theo (1) và (2) => n CO2 = nCa(OH )2=0,1 mol
=> V CO (đktc) = 0,1. 22,4 = 2,24 (l)
,5 điểm
, 5 điểm
, 5 điểm






















![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)




![Đề thi học kì 2 Vật lý lớp 11: Đề minh họa [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/linhnhil/135x160/711752026408.jpg)








