
THI HỌC KÌ I
MÔN HOÁ HỌC - LỚP 10
A. Phần chung cho tất cả học sinh (từ câu 1 đến câu
6): (8 điểm)
Câu 1: (1điểm) R là nguyên tố thuộc chu kì 3, nhóm IIA
trong bảng tuần hoàn. Hãy viết công thức oxit và hidroxit ứng
với hoá trị cao nhất của R. Các oxit, hidroxit có tính axit hay
bazơ?
Câu 2: (1điểm) Xác định số oxi hoá của nguyên tố Nitơ trong
các chất sau: NH4NO3, N2O , NO2.
Câu 3: (3điểm) Cho các nguyên tố X, Y, Z, T có số hiệu
nguyên tử lần lượt là: 8, 9, 15, 16.
a> Viết cấu hình electron nguyên tử và xác định vị trí
của mỗi nguyên tố trong bảng tuần hoàn.
b> Viết công thức electron, công thức cấu tạo của hợp
chất tạo bởi X và Z (Z có hoá trị cao nhất).
c> Sắp xếp các nguyên tố đó theo chiều tính phi kim
giảm dần.

Câu 4: (1điểm) Brom có 2 đồng vị là Br
79
35 và Br
81
35 . Trong đó
Br
79
35 chiếm 50,7% số nguyên tử. Hãy tính nguyên tử khối trung
bình (
A
) của brom.
Câu 5: (1điểm) Nguyên tử M có tổng số hạt các loại là 46.
Trong hạt nhân, tỉ lệ giữa số hạt mang điện và hạt không
mang điện là 0,9375. Hãy xác định số hạt cơ bản mỗi loại có
trong nguyên tử M và viết kí hiệu nguyên tử.
Câu 6: (1điểm) Dựa vào hiệu độ âm điện của các nguyên tố,
hãy cho biết loại liên kết trong các phân tử sau đây: PH3 , HCl
, AlCl3, CaCl2.
(Cho độ âm điện: Ca: 1,00 ; Al: 1,61 ; P: 2,19 ;
H: 2,20 ; Cl: 3,16)
B. Phần riêng (Học sinh học chương trình nào làm
theo phần riêng của chương trình đó)
I. Chương trình nâng cao:
Câu 7: (2điểm) Cho 224 ml khí Clo sục chậm qua bình chứa
dung dịch natri hidrocacbonat dư, người ta nhận thấy có 33,6
ml khí cacbonic thoát ra. Giả thiết khí clo được hấp thụ hoàn
toàn, các thể tích khí đo ở điều kiện chuẩn.

a> Viết các phương trình phản ứng xảy ra.
b> Xác định phần trăm lượng khí clo đã hòa tan trong
dung dịch.
II. Chương trình chuẩn:
Câu 7: (2điểm) Cho Cu tác dụng với dung dịch HNO3 đặc,
nóng thu được muối đồng (II) nitrat, NO2 và H2O.
a> Lập phương trình phản ứng oxi hoá khử xảy ra.
b> Xác định khối lượng dung dịch HNO3 40% đem dùng
để hòa tan hết 3,2 gam Cu. Biết axit được lấy dư 10% so với
lượng phản ứng. (Cho H: 1 ;N: 14 ;O: 16 ;Cu: 64)
--- Hết ---
(Lưu ý: Học sinh không được sử dụng bảng tuần hoàn các
nguyên tố hoá học)
ĐÁP ÁN VÀ BIỂU ĐIỂM
Câ Nội dung đáp án biểu

u điểm
1 Công thức oxít: RO ; là oxit bazơ.
Công thức hidroxit: R(OH)2 ; là một bazơ
0,25*
2
0,25*
2
2 Số oxi hoá: N-3H4N+5O3 ; N+12O , N+4O2 0,25*
4
3 a> Cấu hình electron và vị trí nguyên tố trong
BTH:
X(z=8): 1s2 2s22p4 ; X thuộc chu kì 2 nhóm
VIA.
Y(z=9): 1s2 2s22p5 ; X thuộc chu kì 2 nhóm
VIIA.
Z(z=15): 1s2 2s22p6 3s23p3 ; X thuộc chu kì 3
nhóm VA.
T(z=16): 1s2 2s22p6 3s23p4 ; X thuộc chu kì 3
nhóm VIA.
b> Công thức electron: ; CTCT:
0,25
0,25
0,25
0,25
0,5*2
1,0
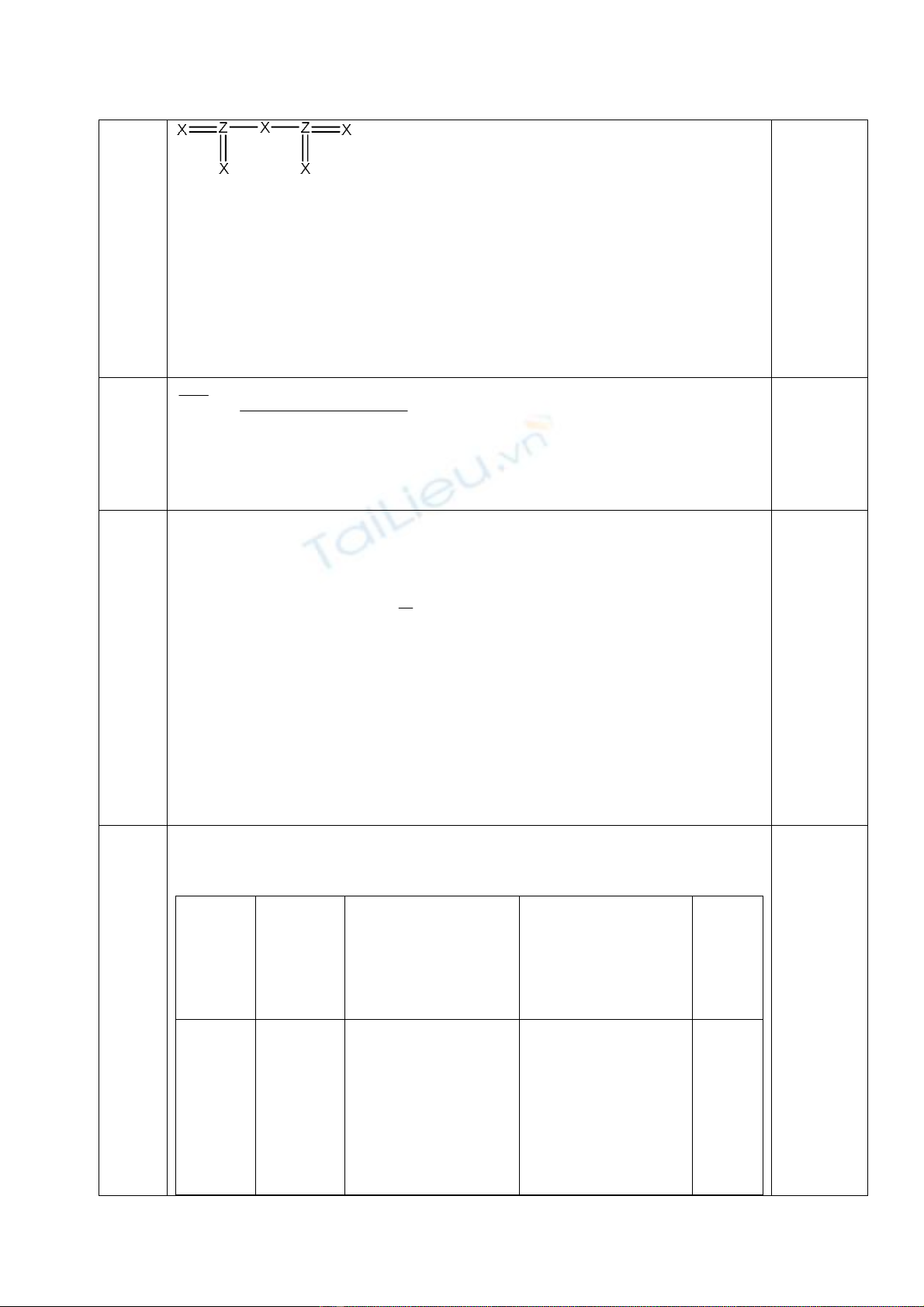
(HS có thể biểu diễn theo qui tắc bát tử)
c> Sắp xếp theo chiều tính phi kim giảm dần: Y
> X > T > Z
4 Br
A=
100
)3,49*81()7,50*79(
= 79,986
1,0
5 Tổng số hạt: p + n + e = 46 2p + n = 46 (1)
Trong hạt nhân:
n
p= 0,9375 ; thay vào (1) ta
được: p = 15 ; n = 16 ; e = p =15.
Kí hiệu nguyên tử: M
31
15 (HS có thể viết chính xác
kí hiệu nguyên tố)
0,25
0,25
0,5
6 Dựa vào độ âm điện:
Liên
kết
P-H Cl-H Al-Cl Ca-
Cl
Hiệu
ĐA
Đ
0,01
< 0,4
0,4<0,96<1,
7
0,4<1,55<1,
7
2,16
>
1,7
0,25*
4




![Đề thi học kì 1 môn Hóa học 10 trường THPT Krông Nô [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2013/20130614/mtvhuydao/135x160/6811371197124.jpg)






![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)




![Đề thi học kì 2 Vật lý lớp 11: Đề minh họa [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/linhnhil/135x160/711752026408.jpg)








