
ĐỀ THI OLYMPIC HOÁ HỌC MĨ
Nguyễn Hữu Thọ - Trường CĐSP Gia Lai
Trong tạp chí Hoá Học & ứng Dụng số 9 (57) năm 2006 chúng tôi đã giới thiệu đề thi
Olympic môn Hóa học của Mĩ năm 2005 (2005 U. S. National Chemistry Olympiad) theo
kiểu trắc nghiệm khách quan nhiều lựa chọn (single-answer multiple-choice). Trong số
này, chúng tôi xin tiếp tục được giới thiệu 4 bài toán đầu tiên (chiếm 54% số điểm) trong
tổng số 8 bài ở phần II (phần tự luận - problem-solving, explanations) của đề thi này.
Bài 1 Các câu hỏi sau đây xét đến các phản ứng của kim loại đồng và các hợp chất của
nó. a. Một mẩu kim loại đồng được hoà tan vào dung dịch HNO3 6M trong một bình
đáy tròn. Phản ứng tạo ra dung dịch màu xanh và có khí không màu nitơ oxit
thoát ra. Viết phương trình phản ứng.
b. Làm bay hơi nước dung dịch màu xanh được chất rắn màu xanh. Khi nung
nóng chất rắn màu xanh tạo ra hỗn hợp khí nitơ dioxit, oxi và một oxit màu
đen của đồng.
i. Hỗn hợp khí trên có khối lượng là 0,205 gam được nén vào bình có thể
tích 125 ml ở 350C, 725 mmHg. Tính khối lượng mol trung bình của hỗn
hợp khí và tỉ lệ số mol NO2/O2 trong hỗn hợp.
ii. Các dữ kiện sau đây nhận được từ chất rắn màu đen.
Khối lượng bình rỗng: 39,49g
Khối lượng bình + kim loại đồng: 40,86g
Khối lượng bình + oxit của đồng: 41,21g
Xác định công thức oxit của đồng.
c. Nếu một phần dung dịch màu xanh bị mất mát trong quá trình bay hơi, điều
này sẽ ảnh hưởng đến thành phần phần trăm của đồng trong oxit màu đen như
thế nào?
d. Nếu chất rắn màu xanh không chuyển hoàn toàn thành chất rắn màu đen trong
quá trình đun nóng, điều này sẽ ảnh hưởng đến thành phần phần trăm của
đồng trong oxit như thế nào?
Bài 2
Chất lỏng hidrazin N2H4 có thể dùng làm nhiên liệu đẩy tên lửa.
a. Viết phương trình phản ứng hình thành hidrazin từ các đơn chất và dùng các
phương trình đốt cháy sau đây để tính nhiệt hình thành của hidrazin lỏng
thông qua H1, H2, H3.
1/2N2 (k) + O2(k) NO2 (k) H1
H2 (k) + 1/2O2(k) H2O (k) H2
N2H4 (l) + 3O2(k) 2NO2 (k) + 2H2O (k) H3
b. Trong nhiên liệu đẩy tên lửa, hidrazin lỏng phản ứng với hidropeoxit lỏng tạo
ra nitơ và hơi nước. Viết phương trình phản ứng ?
c. Tính hiệu ứng nhiệt H của phản ứng ở câu 2b?
Nhiệt hình thành H kJ.mol
N2H4 (l) 50,6
H2O2 (l) -187,8
H2O (k) -285,8
d. Tính hiệu ứng nhiệt H của phản ứng ở câu 2b bằng cách dùng các dự kiện
về năng lượng phân li liên kết sau.
Năng lượng phân li liên kết kJ/mol
N-N 167 O-O 142
N=N 418 O=O 494
NN 942 O-H 459
N-H 386
e. Giá trị H của phản ứng ở câu 2b tính được ở câu c hay câu d chính xác hơn?
Giải thích?
f. Tính nhiệt độ lớn nhất của khí đốt đạt được nếu xem tất cả năng lượng giải
phóng trong phản ứng dùng để cung cấp cho việc nâng nhiệt độ của khí. Nhiệt
dung của N2(k) và H2O (k) tương ứng là 29,1 J/mol.0C và 33,6 J/mol.0C.
Bài 3
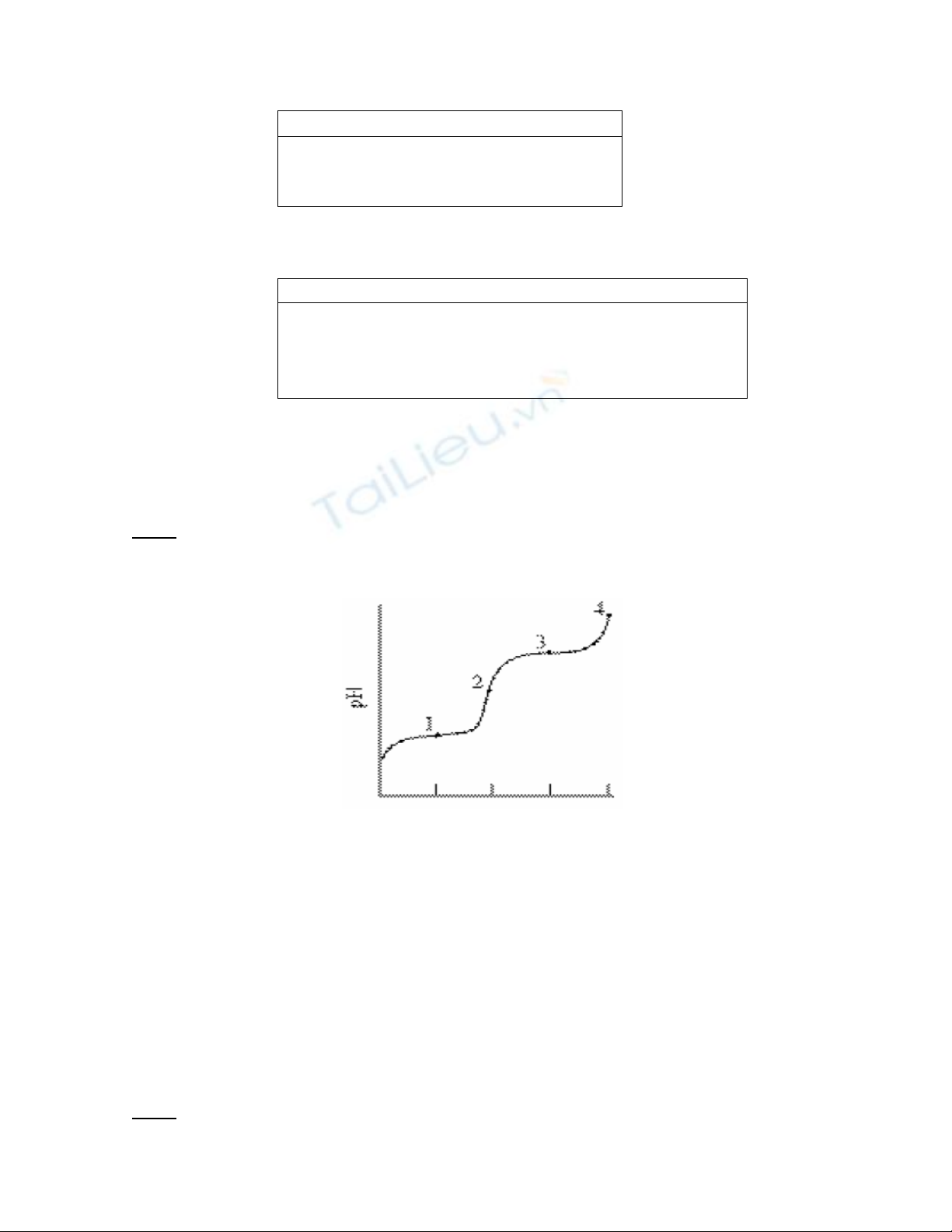
Dung dịch alanin hidroclorua [H3NCH(CH3)COOH]+Cl- được chuẩn độ bằng dung
dịch NaOH có đường cong chuẩn độ như hình bên.
a. Đưa ra công thức cấu tạo của những dạng tồn tại chính tại các điểm chuẩn độ
sau đây trên đường cong.
i. 1
ii. 2
iii. 3
iv. 4
b. Nếu K1 và K2 của alanin hidroclorua tương ứng là 4,6.10-3 và 2.10-10.
i. Viết phương trình điện li ứng với K1 và K2.
ii. Xác định pH tại các điểm 1, 2, 3.
c. Nêu cách để chuẩn bị một dung dịch đệm có pH=10 từ các dung dịch alanin
hidroclurua 0,1 M và NaOH 0,1 M.
Bài 4
Thể tích dung dịch NaOH

Một pin điện hoạt động dựa trên phản ứng
M + Cu2+aq M2+ + Cu (r) E0=1,52 V
được thiết lập theo những thể tích bằng nhau các dung dịch với tất cả các chất ở trạng thái
chuẩn. a. Dùng giá trị thế điện cực chuẩn của Cu2+(aq) (E0=0,34 V) xác định thế khử
chuẩn của phản ứng M2+(aq) + 2e M (r).
b. Pin được tích điện sao cho [Cu2+]=0,1M .Tính:
i. Nồng độ [M2+]?
ii. Suất điện động của pin?
c. Thêm 50 mL nước cất vào mỗi ngăn của pin. So sánh suất điện động của pin
trước và sau khi thêm nước. Giải thích?
Bài 5 Hoàn thành các phương trình dưới đây ở dạng phương trình ion rút gọn. Các chất
hữu cơ viết ở dạng công thức cấu tạo. (Có thể không cần cân bằng phương trình). Tất cả
các phản ứng xảy ra trong dung môi nước trừ khi được ghi rõ.
a. Cho natri sunphua vào nước.
b. Cho dung dịch kali triot vào dung dịch natri thíounphat.
c. Cho dung dịch natri florua dư vào dung dịch sắt III nitơrat.
d. Stronti-90 phóng xạ beta.
e. Sục cacbon dioxit đến dư vào dung dịch canxi hidroxit.
f. Etanol được đun nóng nhẹ với kali dicromat đã được axit hoá.
Bài 6
Phản ứng giữa clorofom và clo có cơ chế được đưa ra như sau:
Bước 1: Cl2 (k) 2Cl (k) nhanh
Bước 2: CHCl3 (k) + Cl (k) CCl3 (k) + HCl (k) chậm
Bước 3: CCl3 (k) + Cl (k) CCl4 (k) nhanh
a. Viết phương trình phản ứng đối với phản ứng tổng cộng.
b. Chỉ ra các chất trung gian phản ứng trong cơ chế này.
c. Viết phương trình tốc độ phản ứng đối với bước quyết định tốc độ.
d. Chỉ ra rằng phương trình tốc độ ở câu c có thể dùng để diễn tả qui luật tốc độ
của phản ứng tổng cộng.
Bài 7
Xenon tạo ra nhiều hợp chất như: XeF2, XeF4 và XeO3.
a. Vẽ cấu trúc Liuyt cho mỗi phân tử trên.
b. Mô tả dạng hình học của mỗi hợp chất bao gồm cả góc liên kết.
c. Cho biết và giải thích mỗi phân tử trên có cực hay không có cực.
d. Tính toán việc nghiên cứu các hợp chất này ở phản ứng cao.
Bài 8
Một phần của polyme polypropilen được chỉ ra ở dưới đây:
C
H
H
C
H
H
C
H
CH
3
C
H
CH
3

a. Viết công thức cấu tạo của monome đã tạo ra polyme trên.
b. Cho biết và giải thích polime trên thuộc loại polime cộng hay polime ngưng
tụ.
c. So sánh nhiệt đô nóng chảy của các polyme sau. Đưa ra lời giải thích cho
câu trả lời của bạn.
i. Polypropilen chứa 1000 mắt xích monome và polypropilen chứa 10000
mắt xích monome.
ii. Polypropilen và polyme mà trong đó nhóm CH3 được thay thế bằng
nhóm CH2CH2CH2CH3.
iii. Isotactic polypropilen (tất cả các nhóm CH3 ở về một phía của khung
cacbon và atactic polypropilen (các nhóm CH3 dược sắp xếp một cách
tuỳ ý)
Đáp án
Bài 1 a. 3Cu + 8H++2NO3-3Cu2++2NO+4H2O
b.
i. molg
PV
mRT
M/5,43
760
725
.125,0
308.0821,0.205,0
Gọi x là thành phần của NO2,
5,43)1( 22 ONO MxxM
46x+32(1-x)=43,5 Giải ra có: x=0,281
1
59,4
189,0
821,0
2
2
O
NO
ii. 40,86-39,49=1,37 g Cu 41,21- 40,86=0,35 g O
nCu= 0216,0
55,63
37,1 nO= 0219,0
0,16
35,0
Vậy tỉ lệ là 1:1 và công thức phải là CuO.
c. Dung dịch mất mát làm cho khối lượng của CuO giảm. Vì vậy, phần trăm của
đồng trong oxit sẽ cao hơn.
d. Khối lượng của CuO sẽ cao hơn. Vì vậy, phần trăm của đồng trong oxit sẽ thấp
hơn.
Bài 2 a. Xét N2+2H2N2H4
N2+O2NO2 2H1
2H2+O22H2O 2H2
2NO2+2H2O3O2+N2H4 -H3
N2+2H2N2H4 Hht=2H1+2H2-H3
b. N2H4(l)+2H2O2(l) N2(k)+4H2O(k)
c. Cấu trúc của hydrazin và peoxit là,

H=4.(-285,8)-[2.(-187,8)+1.50,6]=-812,2 kJ
d. H= N-N + 4 N-H + 2 O-O + 4 O-H - [NN + 8 O-H]
= 167+4.(386)+2.(142)-[942+4.(459)]=-783 kJ
e. H tính được từ câu c sẽ chính xác hơn. Vì các giá trị về năng lượng liên kết
của mỗi hợp chất trên chỉ là giá trị trung bình.
f. C=1.29,1 + 4.33,6 = 163,5 J./0C
q= CT 818200=163,5. T T=5004 0C
Bài 3
a. i. [H3NCH(CH3)COOH]+ và +H3NCH(CH3)COO-
ii. +H3NCH(CH3)COO-
iii. +H3NCH(CH3)COO- và H2NCH(CH3)COO-
iv. H2NCH(CH3)COO-
b.
i. K1 [H3NCH(CH3)COOH]+ H+ + +H3NCH(CH3)COO-
K2 +H3NCH(CH3)COO- H+ + H2NCH(CH3)COO-
ii. [H+] tại điểm 1= K1=4,6.10-3 pH=2,34
[H+] tại điểm 2= 21.KK =13
10.2,9 =9,6.10-7 pH=6,02
[H+] tại điểm 3= K2=2,0.10-10 pH=9,07
c. 2,0.10-10=][
]][10.0,1[ 10
HB
B ][
][
HB
B=2/1
Chuẩn bị một thể tích xác định alanin hidroclorua 0,10 M (ví dụ 300 mL).
Thêm dung dịch NaOH vào theo tỉ lệ 5/3 ( theo ví dụ là 500 mL). Ta được 800 mL
dung dịch có tỉ lệ 1
2
])([
])([
33
32
COOCHNCHH
COOCHNCHH
Bài 4
a. 000 koxhpin EEE và 0
oxh
E=1,52 - 0,34 =1,18 V
0
k
E(M2+ +2e M)=-1,18 V
b. i. Nếu [Cu2+] giảm xuống 0,10 M thì [M2+] phải tăng lên 1,90 M
ii. E=1,52- 10,0
90,1
ln
2
0257,0 =1,52-0,01285ln(19)=1,48 V
c. E của pin khi dung dịch pha loãng sẽ bằng E0 pin ban đầu. Dung dịch được pha
loãng bởi những lượng nước như nhau, các ion có hệ số như nhau (từ phương trình
đã được cân bằng). Epin không đổi.
Bài 5
a. Na2S + H2O 2Na+ + HS- + OH-
b. I3- + S2O32- 3I- + S4O62-








![Đề thi học sinh giỏi Quốc gia THPT môn Hoá học năm 2021-2022 có đáp án [Kèm đề thi]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230215/bapnuong09/135x160/2931676452944.jpg)













![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



