
106
Chæång 5: MÄÜT SÄÚ QUAÏ TRÇNH ÂIÃÛN CÆÛC ÂÀÛC BIÃÛT
I. Xuïc taïc âiãûn hoïa:
1/ Khaïi niãûm vãö xuïc taïc âiãûn hoïa:
Nhiãöu phaín æïng âiãûn hoïa chè xaíy ra våïi täúc âäü âaïng kãø khi quaï thãú η ráút låïn
(nghéa laì åí xa âiãûn thãú cán bàòng). Kyî thuáût xuïc taïc âiãûn hoïa cho pheïp tiãún haình phaín æïng
våïi täúc âäü låïn ngay taûi quaï thãú ráút nhoí, hay noïi caïch khaïc laì åí lán cáûn âiãûn thãú âiãûn cæûc
can bàòng.
- Nhæîng cháút xuïc taïc âiãûn hoïa coï thãø laì laì kim loaûi âiãûn cæûc, caïc cháút bë háúp phuû
trãn âiãûn cæûc, hoàûc caïc cháút hoìa tan trong dung dëch.
- Âãø so saïnh hiãûu quaí cuía caïc cháút xuïc taïc, ngæåìi ta thæåìng so saïnh täúc âäü phaín
æïng trãn caïc cháút xuïc taïc khaïc nhau.
Vê duû: nãúu trãn cháút xuïc taïc thæï nháút ta coï täúc âäü phaín æïng laì:
RT
F
n
eii 111 )1(
1,01
ηα
−−
= (5.1)
vaì trãn cháút xuïc taïc thæï hai laì:
RT
F
n
eii 222 )1(
2,02
ηα
−−
= (5.2)
Nãúu: 212121 ;;
η
η
α
α
=== nn ta coï:
2,0
1,0
2
1
i
i
i
i= (5.3)
Nhæ váûy, thæûc cháút so saïnh hai cháút xuïc taïc laì so saïnh doìng âiãûn trao âäøi i0 cuía
phaín æïng âiãûn cæûc khi coï màût cuía cháút xuïc taïc âoï.
2/ Mäüt säú vê duû vãö xuïc taïc âiãûn hoïa:
2.1. Cháút xuïc taïc laì caïc pháön tæí hoìa tan trong dung dëch:
Vê duû Br- laìm cháút xuïc taïc cho phaín æïng propylen:
2323
22
CHCHCHCHCHCHHOBr
HHOBreOHBr
−−→=−+
+→−+ +−
OH Br
CH3 - CH - CH2 + OH-
→
CH3 - CH - CH2 + H2O + Br-
OH Br O
2.2. Xuïc taïc laì âiãûn cæûc:
ÅÍ âáy ta xeït phaín æïng thoaït hydro trong caïc mäi træåìng khaïc nhau:
• Mäi træåìng axit: 2
22 HeH →+
+
• Mäi træåìng kiãöm: −
+→+ OHHeOH 222 22
107
Nhæ âaî biãút caïc phaín æïng xaíy ra qua nhiãöu giai âoaûn, trong âoï coï mäüt giai âoaûn
âoìng vai troì quan troüng:
happhu
HeH →+
+
2
hoàûc −
+→+ OHHeOH happhu2
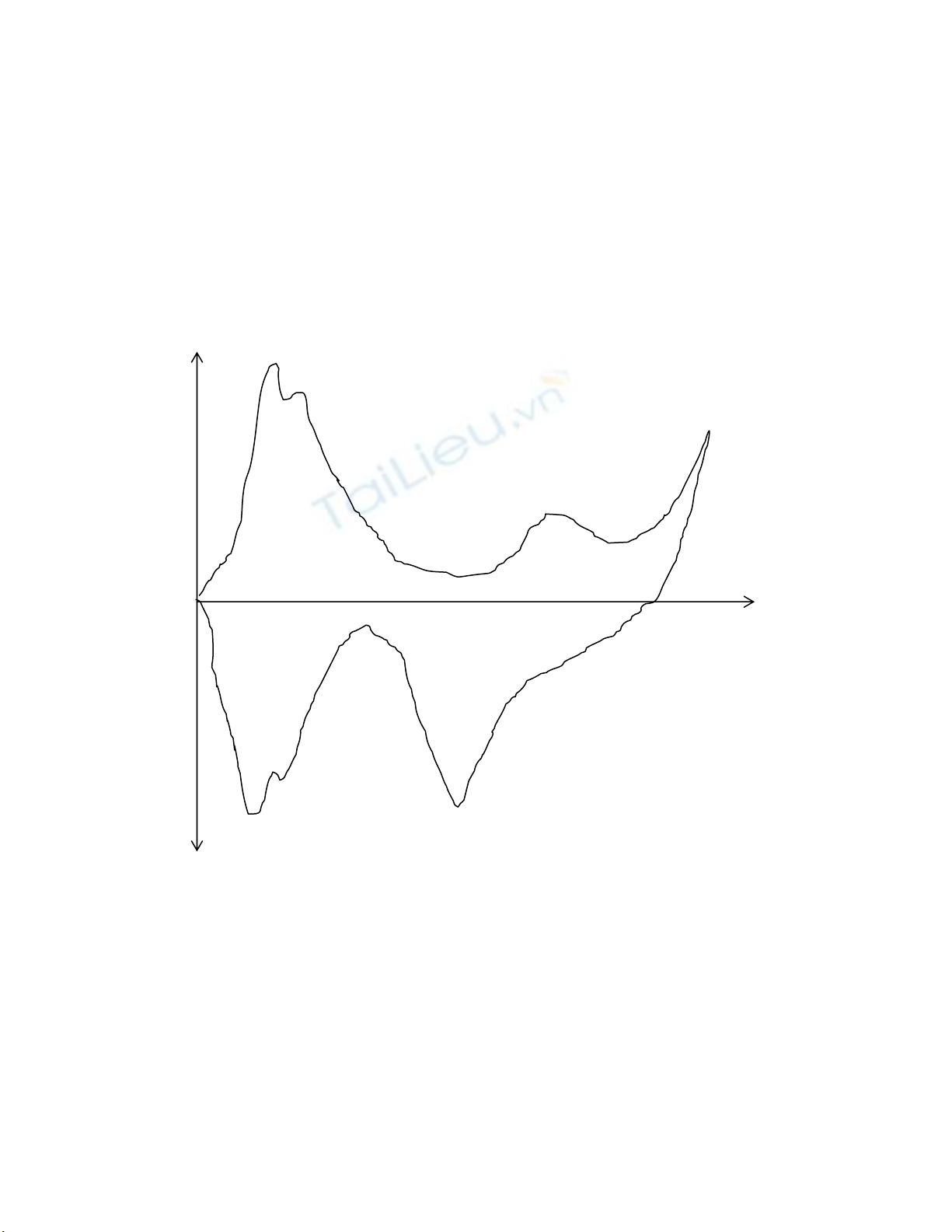
Bàòng kyî thuáût quang phäø in-situ vaì caïc phæång phaïp khaïc, ngæåìi ta âaî tçm tháúy
Hháúpphuû trãn mäüt säú kim loaûi nhæ Pt (âiãûn cæûc so saïnh). Ta coï âæåìng Vän-Ampe voìng cuía
âiãûn cæûc Pt trong dung dëch H2SO4 2.3 M åí 25oC, täúc âäü queït 0.5 V/s (Hçnh 5.1) nhæ sau:
ia(mA/cm2)
A1
1.46 - A2
0.73 - A3
0.00 +
ϕ
(V)
0.2 0.6 1.0 1.4
-0.73 -
C2
-1.46 -
C1 C3
ic
Hçnh 5.1. Âæåìng Vän-Ampe voìng cuía âiãûn cæûc Pt trong dung dëch H2SO4 2.3 M åí
25oC, täúc âäü queït 0.5 V/s
Pic A1 æïng våïi phaín æïng: eHH 22
2+→ +
Pic A2 æïng våïi phaín æïng: eHHhapphu +→ +
Pic A3 æïng våïi phaín æïng: eHOOH 44
22 ++→ +
Pic C2 æïng våïi phaín æïng: happhu
HeH →+
+
Pic C1 æïng våïi phaín æïng: 2
2HHhapphu →
Coìn Pic C3 æïng våïi sæû khuí oxyt platin

108
Phaín æïng taûo thaình Hháúpphuû xaíy ra dãù hån phaín æïng thoaït khê hydro.
Sæû täön taûi Hháúpphuû laìm xuáút hiãûn caïc cå chãú sau:
• Cå chãú A:
happhu
HMMeH −→++
+ (1)
2
22 HMHM happhu
+
→− (2)
• Cå chãú B:
happhu
HMMeH −→++
+ (1’)
2
HMeHHM happhu +→++− + (2’)
2.3. Cå chãú xuïc taïc âiãûn hoïa cuía phaín æïng thoaït hydro:
2.3.1. Sæû thoaït hydro theo cå chãú A, B trong âoï giai âoaûn 1 hoàûc 1’ khäúng
chãú täúc âäü phaín æïng. Khi áúy:
)1(
)1(1
θ
−= +
→→
H
CkV (5.4)
trong âoï
θ
: âäü phuí bãö màût cuía Hháúpthuû
vç giai âoaûn 1 laì cháûm nãn hydro háúp phuû khäng thãø coï giaï trë
θ
cao vaì 1-
θ
≈
1.
+
→→ =H
CkV )1(1
vaì ⎥
⎦
⎤
⎢
⎣
⎡−−
==− ++
→→
RT
F
CkFCkFi HH
ϕα
)1(
exp 1
)11()1(
trong âoï:
)11(
→
k: giaï tri cuía k1 taûi
ϕ
= 0
(1-
α
1): hãû säú chuyãøn âiãûn têch cuía quaï trçnh catäút trong phaín æïng 1.
⎥
⎦
⎤
⎢
⎣
⎡−
−+=− +
→
RT
F
CkFi H303.2
)1(
logloglog 1
)11(
ϕα
(5.5)
khi
α
1=0.5thç âäü däúc Tafel bàòng:
1
)120(
log −
=
∂
−∂ mV
i
ϕ
hay mV
i120
log
log =
−∂
∂
ϕ
2.3.2. Sæû thoaït hydro theo cå chãú A, giai âoaûn 2 laì cháûm.
2
)2(
2
θ
→
=− kFi (5.6)
)2(
→
k: hàòng säú täúc âäü cuía phaín æïng hoïa hoüc, khäng phuû thuäüc vaìo âiãûn thãú.
Khi quaï trçnh äøn âënh thç θ coi nhæ khäng âäøi vaì 0=
∂
∂
t
θ
hoàûc ta coï:
211
→←→ += VVV (5.7)
nãúu 12
→→ << VV taûi moüi âiãöu kiãûn vaì åí lán cáûn âiãûn thãú thuáûn nghëch 12
←→ <VV thç chuïng ta
coi nhæ phaín æïng 1 laì phaín æïng cán bàòng. Khi âoï:

109
11
←→ =VV
tæïc laì:
θθ
11 )1( ←→ =−
+kCk H
vç 11,←→ kk âãöu phuû thuäüc vaìo âiãûn thãú nãn:
=−
⎥
⎦
⎤
⎢
⎣
⎡−−
+
→)1(
)1(
exp 1
)11(
θ
ϕα
H
C
RT
F
k
θ
ϕα
⎥
⎦
⎤
⎢
⎣
⎡
→
RT
F
k1
)11( exp (5.8)
1
→
k 1
←
k
sau khi biãún âäøi ta âæåüc:
)exp(1
)exp(
1
1
RT
F
CK
RT
F
CK
H
H
ϕ
ϕ
θ
−+
−
=
+
+ (5.9)
trong âoï:
11
11
1←
→
=
k
k
K åí gáön âiãûn thãú cán bàòng.
1)exp(
1<<−
+RT
F
CK H
ϕ
vaì do âoï (5.9) tråí thaình:
)exp(
1RT
F
CK H
ϕ
θ
−= + (5.10)
thãú (5.10) vaìo (5.6) ta coï:
)
2
exp(2 22
1
2RT
F
CKkFi H
ϕ
−=− +
→
suy ra: RT
F
CKkFi H303.2
2
log2)2log(log 2
1
2
ϕ
−+=− +
→ (5.11)
ta coï âäü däúc Tafel: 1
)30(
log −
=
∂
−∂ mV
i
ϕ
hay mV
i30
log
log =
−∂
∂
ϕ
2.3.3. Sæû thoaït hydro theo cå chãú B våïi gia âoaûn 3 khäúng chãú quaï trçnh.
θ
+
→→ =H
CkV 3
3 (5.12)
3
→
k: phuû thuäüc vaìo âiãûn thãú
• ÅÍ âiãûn thãú tháúp:
11,←→ VV nhanh hån 3
→
V nhiãöu vaì coï thãø tçm âæåüc θ theo trãn., sau âoï thay giaï trë θ
vaìo (5.12) ta coï:
)exp()
)1(
exp(2 2
1
3
31 RT
F
CK
RT
F
kFi H
ϕ
ϕ
α
−
−
−=− +
→

110
)
)2(
exp(2 3
2
1
31 RT
F
CKkFi H
ϕ
α
−
−=− +
→
RT
F
CKkFi H
ϕ
α
)2(
log2)2log(log 3
1
31
−
−+=− +
→ (5.13)
khi
α
3=0.5thç âäü däúc Tafel bàòng (40 mV)-1.
• ÅÍ quaï thãú cao:
13
←→ >> VV vaì 31
→→ =VV thç:
=−
⎥
⎦
⎤
⎢
⎣
⎡−−
+
→)1(
)1(
exp 1
)11(
θ
ϕα
H
C
RT
F
k
θ
ϕα
⎥
⎦
⎤
⎢
⎣
⎡−
−
→
RT
F
k)1(
exp 3
)31(
Nãúu 31
α
α
= thç θ khäng phuû thuäüc vaìo âiãûn thãú vaì:
)
)1(
exp(2 3
31 RT
F
KCkFi H
ϕ
α
−
−=− +
→
trong âoï:
θ
=
+
=→→
→
131
11
kk
k
K
RT
F
lohCKkFi H303.2
)1(
)2log(log 3
31
ϕ
α
−
−+=− +
→ (5.14)
khi
α
3=0.5thç âäü däúc Tafel bàòng (120 mV)-1.














![Bộ câu hỏi lý thuyết Vật lý đại cương 2 [chuẩn nhất/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251003/kimphuong1001/135x160/74511759476041.jpg)
![Bài giảng Vật lý đại cương Chương 4 Học viện Kỹ thuật mật mã [Chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250925/kimphuong1001/135x160/46461758790667.jpg)










