CHƯƠNG 3: LIÊN KẾT HOÁ HỌC
Tiết 22: §. Bài 12: LIÊN KẾT ION – TINH THỂ ION
I. MỤC TIÊU BÀI HỌC:
1. Kiến thức: Biết được:
- Vì sao các nguyên tử lại liên kết với nhau
- Sự tạo thành ion, ion đơn nguyên tử, ion đa nguyên tử.
- Định nghĩa liên kết ion.
- Khái niệm tinh thể ion, tính chất chung của hợp chất ion.
2. Kĩ năng:
- Viết cấu hình electron của ion đơn nguyên tử cụ thể.
- Xác định ion đơn nguyên tử, ion đa nguyên tử trong một phân tử chất cụ
thể
II. CHUẨN BỊ :
1. Giáo viên: GV chuẩn bị máy vi tính, projector.
- Bài giảng có thể soạn bằng powerpoint kèm theo một số hình ảnh động của
sự di chuyển electron từ nguyên tử này sang nguyên tử khác để tăng tính
trực quan, sinh động.

- Mẫu tinh thể NaCl hạt lớn, mô hình mạng tinh thể NaCl (hay dùng file
flash NaCl có sẳn trong các đĩa phần mềm Hóa học).
- Phim Natri tác dụng với Clo.
2. Học sinh: ôn tập một số nhóm A tiêu biểu (bài 8)
III. PHƯƠNG PHÁP:
- Gv đặt vấn đề
- Hs tự giải quyết vấn đề dưới sự hướng dẫn của gv
- Kết hợp sách giáo khoa và hình ảnh trực quan của máy tính để HS tự
chiếm lĩnh kiến thức.
IV. NỘI DUNG TIẾT HỌC: Tiết 22
1. Ổn định lớp
2. Bài mới:
HOẠT ĐỘNG CỦA GIÁO VIÊN
VÀ HỌC SINH
GHI BẢNG
I. Sự tạo thành ion, cation, anion
1. Ion, cation, anion
a) Sự tạo thành ion:
I. Sự tạo thành ion, cation, anion
1. Ion, cation, anion
a. Sự tạo thành ion:
Hoạt động 1:
Gv: Vì sao nói nguyên tử trung hoà
về điện?
Hs: Vì trong nguyên tử số p = số e
Gv: Khi nguyên tử nhường hoặc
nhận electron thì nguyên tử còn trung
hoà về điện nữa không? Điện tích
phần còn lại của nguyên tử tính như
thế nào? Ví dụ: nguyên tử Na?
- Gv kết luận: Nguyên tử trung hoà
về điện nên khi nguyên tử nhường
hay nhận electron thì trở thành phần
tử mạng điện gọi là ion.
Ví d ụ:
Nguyên tử Na: số p=số e =11
11p điện tích 11+
11e điện tích 11-
Nguyên tử Na trung hoà về điện
Na mất 1e:
11p 11+
10e 10-
Phần còn lại mang điện tích 1+
b) Sự tạo thành cation:
Hoạt động 2:
- Gv cho biết quy luật: Trong các
phản ứng hoá học để đạt cấu hình
electron bền của khí hiếm (lớp ngoài
cùng có 8e hay 2 electron ở heli)
nguyên tử kim loại có khuynh
b) Sự tạo thành cation:
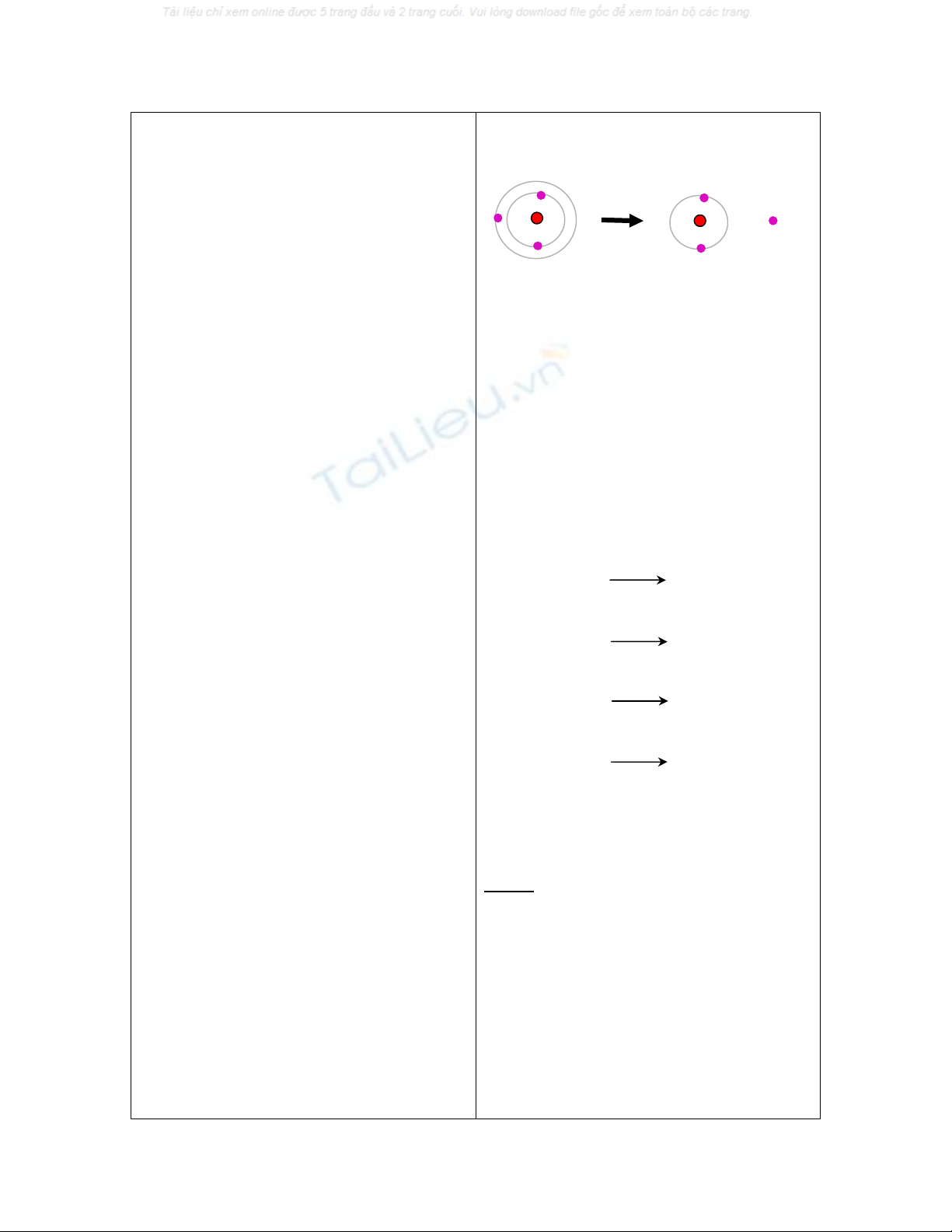
hướng nhường electron để trở thành
ion dương, được gọi là cation.
- Gv phân tích làm mẫu: Sự tạo
thành ion Li+ từ nguyên tử Li. Để có
cấu hình của khí hiếm gần nhất là
heli(1s2), nguyên tử liti dễ nhường 1
electron ở lớp ngoài cùng 2s1 trở
thành ion dương hay cation Li+.
- Gv: trình diễn hình ảnh động về
sự tạo thành ion Na+
- Hs vận dụng: Viết phương tr
ình
nhường electron của các nguyên t
ử
kim loại lớp ngoài cùng có 1, 2, 3
electron như Na, Mg, Al để trở thành
ion dương.
Ví dụ1:
Li(Z= 3): 1s
2
2s
1
Li Li+
+
e
Ví dụ 2: :
Na Na+ + 1e
Mg Mg2+ + 2e
Al Al3+ + 3e
M Mn+ + ne
Vậy kim loại nhường e
Lưu ý : Tên cation = cation + tên kim
loại
Ví dụ: Cation liti(Li+), cation
natrri(Na+), cation magie(Mg2+)…
3+ 3+
+
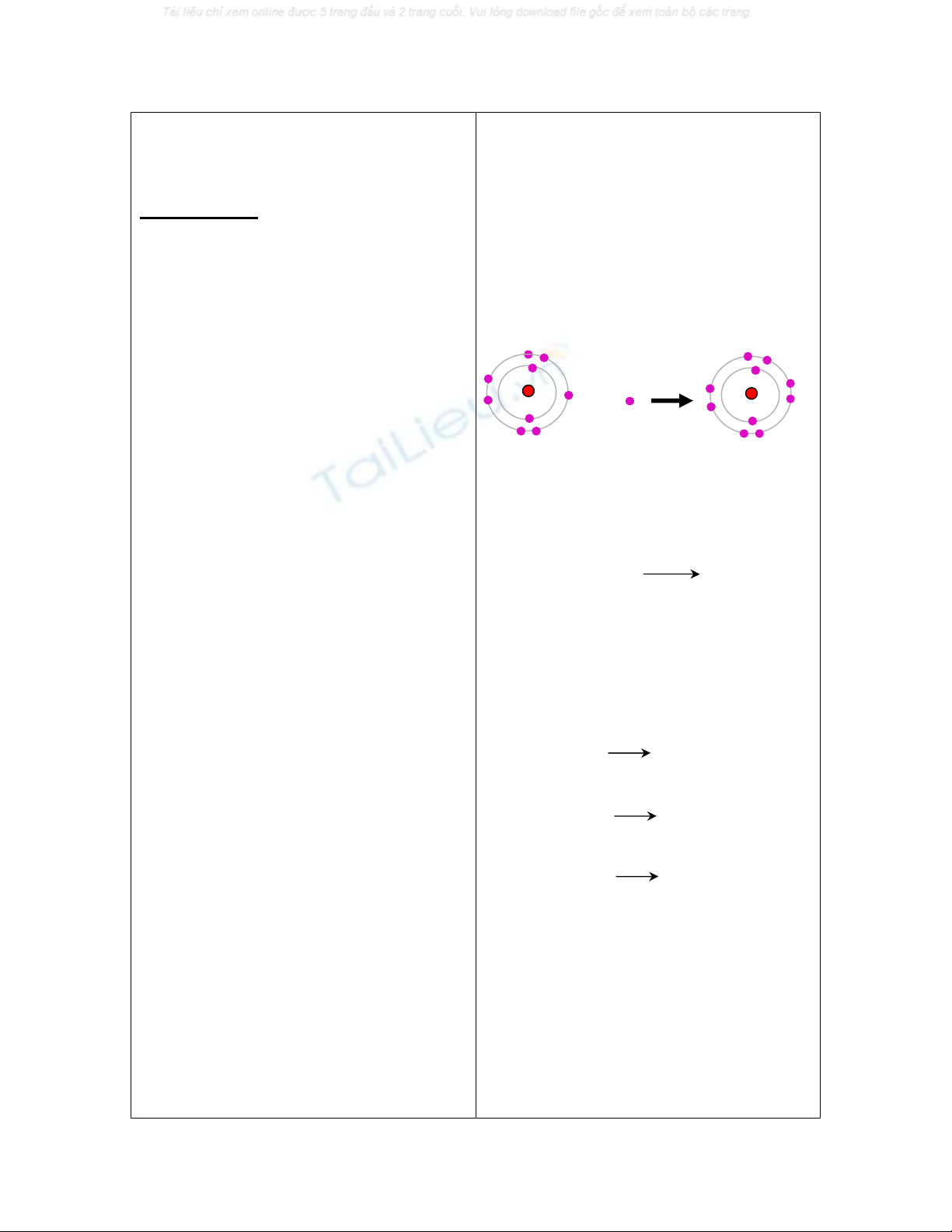
c) Sự tạo thành anion:
Hoạt động 3:
- Gv cho biết quy luật: Trong các
phản ứng hoá học để đạt cấu hình
electron bền của khí hiếm, nguyên t
ử
phi kim có khuynh hướng nhận
electron để trở thành ion âm, được
gọi là anion.
- Gv phân tích làm mẫu: Sự tạo
thành ion F- từ nguyên tử F. Để có
cấu hình của khí hiếm gần nhất là
neon (1s22s22p6), nguyên tử F dễ
nhận 1 electron trở thành ion âm hay
anion F-
- Gv: trình diễn hình ảnh động về
sự tạo thành ion Cl-
- Hs vận dụng: Viết phương tr
ình
nhường electron của các nguyên t
ử
kim loại lớp ngoài cùng có 1, 2, 3
electron như K, Mg, Al để trở thành
ion dương.
c) Sự tạo thành anion:
Ví dụ 3: F(Z=9): 1s22s22p5
F + e F-
Ví dụ 4:
Cl + e Cl-
O + 2e O2-
X + m.e Xm-
Vậy phi kim nhận electron.
Lưu ý : Tên anion = ion + tên gốc
axit tương ứng.(trừ O2- gọi là anion
oxit)
9+ 9+
+