
BỘ GIÁO DỤC VÀ ĐÀO TẠO
ĐẠI HỌC HUẾ
MIỄN DỊCH BỆNH LÝ HỌC
GIÁO TRÌNH ĐÀO TẠO SAU ĐẠI HỌC
HUẾ

Chương 1
LÂM SÀNG VÀ SINH HỌC PHẢN ỨNG VIÊM
I. Định nghĩa
Phản ứng viêm là quá trình đáp ứng sinh lý đề kháng của cơ thể chống lại sự xâm nhập dẫn đến sự thay đổi tổ chức. Nhiệm vụ đầu tiên của
phản ứng viêm là loại bỏ các tác nhân xâm nhập (vi khuẩn, virus, ký sinh trùng, tổ chức tổn thương) và cho phép sự sửa chữa hồi phục tổ chức
tổn thương. Đáp ứng này gọi là phản ứng viêm cấp, là hiện tượng thuận lợi cho sinh vật có thể tìm thấy sự dung nạp sinh lý. Trường hợp phản
ứng âm tính khi phản ứng tồn tại và trở nên mạn tính. Trong trường hợp này phản ứng viêm không thuận lợi và chỉ được kềm chế với tác dụng
điều trị của thuốc.
Phản ứng viêm là yếu tố đầu tiên của miễn dịch không đặc hiệu, cho phép sự đề kháng diện rộng. Thực tế, các vi sinh vật gây bệnh có thể
tiếp xúc hằng ngày nhưng chỉ có thể gây bệnh trong một số trường hợp do cơ chế miễn dịch tự nhiên không cần sự tham dự của các dòng tế bào
lympho đặc hiệu. Tuy nhiên, phản ứng viêm cấp cũng là yếu tố khởi phát và điều hoà đáp ứng miễn dịch đặc hiệu.
Cơ chế loại bỏ các vi sinh vật gồm đáp ứng miễn dịch tự nhiên xảy ra lập tức sau khi vi snh vật xâm nhập vào cơ thể. Sau vài giờ, pha đầu
tiên nhanh chóng tiếp tục bởi đáp ứng miễn dịch không đặc hiệu sớm. Những pha sớm này cho phép khống chế nhiễm trùng trước khi tế bào
lympho T của đáp ứng miễn dịch có khả năng can thiệp
II. Yếu tố khởi động viêm
Yếu tố vật lý: nhiệt (bỏng), lạnh giá, tia xạ ion hoá dẫn đến tổn thương tổ chức và giải phóng các dẫn xuất thoái hoá như collagen
Các yếu tố ngoại sinh và nội sinh khác: vi sinh vật gây bệnh, nọc độc côn trùng, tinh thể (urat), sản phẩm (toan, kiềm, chất độc), sản phẩm
sinh học (độc tố, thoái hoá tổ chức), các cấu trúc có nguồn gốc từ phản ứng miễn dịch (phức hợp miễn dịch, kháng thể, cytokin).
Mặc dầu khác nhau về bản chất của yếu tố khởi động nhưng phản ứng viêm là như nhau. Mức độ lm sàng của phản ứng viêm và thời gian
sẽ thay đổi và điều kiện cho những hậu quả thuận lợi hay làm mất phản ứng viêm.
III. Phản ứng viêm cấp
Đặc trưng bởi tứ chứng kinh điển: sưng, nóng, đỏ, đau của Celsius. Phản ứng này kèm theo tổn thương chức năng cục bộ tuỳ theo mức độ
tấn công của tác nhân gây bệnh.
Phản ứng viêm cấp có thể chia làm ba giai đoạn:
Pha mạch máu: xảy ra lập tức, đặc trưng bởi sự thay đổi của vi tuần hoàn tại chổ
Pha tế bào: xảy ra tiếp theo với sự xâm nhập của nhiều tế bào, sự di chuyển tế bào sẽ cho phép loại bỏ các tác nhân gây bệnh và tổ chức
tổn thương.
Pha tái tạo và lên sẹo: xảy ra trong vài ngày và tái tạo tổ chức
1. Pha mạch máu
1.1. Sự đông máu
Bao gồm sự co các tiểu động mạch cực kỳ ngắn, có thể xảy ra trong vài giây, theo cung phản xạ dưới sự điều khiển của hệ giao cảm. Sự co
mạch sẽ làm rối loạn sự di chuyển của tiểu cầu trong tuần hoàn và dẫn đến hoạt hoá tiểu cầu. Hiện tuợng này là yếu tố quyết định vì các tiểu cầu
tham gia làm bít các lỗ hổng tự nhiên hay khởi động và đảm bảo sự co mạch hiệu quả bằng sự tụ tập tại chổ, của adrenalin, nor adrenalin và
serotonin. Các tiểu cầu hoạt hoá có thể tổng hợp thromboxan A2 có khả năng ngưng tập và co mạch rất mạnh. Vai trò khác là đông máu tiên
phát, pha mạch tức thì này cũng làm tách biệt các tác nhân gây bệnh có khả năng xâm nhập qua vết thương. Hoạt hoá yếu tố đông máu XII bởi
các yếu tố hữu hình hay hoà tan (tinh thể, collagen), sản phẩm sinh học (LPS vi khuẩn, plasmin, phức hợp miễn dịch) khởi động đông máu và dẫn
đến hình thành sợi fibrin củng cố cục máu đông tiên phát. Sợi fibrin tạo nên cũng là yếu tố hoá hướng động các bạch cầu hạt trung tính nhưng nó
cũng tham gia vào tính thấm mạch bằng cách tác động lên hệ kinin
1.2. Hệ thống kinin
Các kininogen tiền thân bất hoạt của kinin, tạo ra dưới tác động của các kallicrein, một số peptid hoạt mạch làm tăng nhiệt độ tại chổ và
gây đau. Những chất này dễ bị phá huỷ bởi các kininase. Bradykinin là sản phẩm tiêu biểu của họ kinin, là một peptid có 9 axit amin tăng tính
thấm mạch máu. Bradykinin gây đau do có khả năng liên kết với các thụ thể đặc hiệu trên các tế bào thần kinh cảm giác, và tác động với plasmin
bằng cách hoạt hoá con đường tắt bổ thể và khuếch đại đáp ứng miễn dịch
1.3. Những dẫn xuất của axit arachidonic
Bradykinin làm tăng tiềm lực của prostaglandin và kích thích phospholipase A2. Phosphalipase A2 sẽ chuyển hoá phospholipid màng tiểu
cầu và tế bào nội mạc mạch máu thành axit arachidonic. Chuyển hoá axit arachidonic thực hiện bằng con đường cyclo-oxygenase tạo các
prostaglandin và con đường lipo-oxygenase tạo các leucotrien, các phân tử này có khả năng hoạt hoá các chất trung gian khác. Những sản phẩm
của cyclo-oxygenase (PGE2, PGF2α, PGD2, PGI2, TxA2) là những tác nhân gây giãn mạch và đóng góp vào sưng, nóng, đau và gây sốt. Những
sản phẩm của lipo-oxygenase (LTB4, LTC4, LTD4) có hoạt tính hóa hướng động mạnh trên bạch cầu hạt trung tính.
1.4. PAF-acether (platelet activating factor): là sản phẩm trong quá trình hoạt hoá tiểu cầu. Đây là sản phẩm của phospholipid màng được
tạo ra từ bạch cầu hạt trung tính, bạch cầu đơn nhân/đại thực bào, tế bào nội mạc, có khả năng ngưng tập tiểu cầu, nó cũng có tính hoá hướng
động đối với bạch cầu hạt trung tính, nó hoạt hoá đại thực bào và tác động trên tế bào xơ non, và tế bào sợi cơ.
1.5. Diễn tiến của pha mạch máu
Sự giải phóng các hóa chất trung gian dẫn đến sự sự giãn mạch với lưu lượng máu tăng cục bộ, sự thay đổi tính thấm mạch và sự tăng kích
thước các khe hở giữa các tế bào nội mạc sẽ cho phép các protein huyết tương và các tế bào đến chổ viêm. Sự tăng lưu lượng vi tuần hoàn giải
thích tính chất nóng và đỏ của ổ viêm. Sự xuất tiết huyết tương dẫn đến phù nề tổ chức và tăng áp lực tại các đoạn cuối thần kinh tại chổ, giải
thích cảm giác sưng và đau. Bổ thể là thành phần protein chủ yếu tại tổ chức tổn thương. Hoạt hoá bổ thể theo con đường cổ điển (phức hợp
miễn dịch) hoặc con đường tắt (độc tố vi khuẩn) tạo thuận cho sự giãn mạch và tăng tính thấm mạch (C3a, C5a), tăng hoá hướng động bạch cầu
hạt trung tính và tế bào đơn nhân (C2b, C4a, C3b, C5b-7), sự opsonin hoá và giải phóng histamin từ tiểu cầu. Histamin làm tăng co các sợi cơ
trơn và tính thấm của mạch bằng cách co các tế bào nội mạc
Sự thay đổi thành mạch dẫn đến sự hiện diện của các thụ thể mới của tế bào nội mạc như ELAM-1 (endothelial leucocyte adhesion
molecule -1) VCAM-1 (vascular cell adhesion molecule -1), ICAM-1 (intercellular adhesion molecule -1) càng làm mạnh thêm sự thoát mạch và
di tản tế bào đến tổ chức tổn thương. Hiện tượng này được khuếch đại dưới tác động của các hoá chất do tế bào nội mạc tiết ra.
2. Pha tế bào
Pha tế bào tiếp theo pha mạch máu, đặc trưng bởi dòng bạch cầu thoát khỏi mạch máu vào gian bào diễn tiến 3 giai đoạn (1) tế bào của
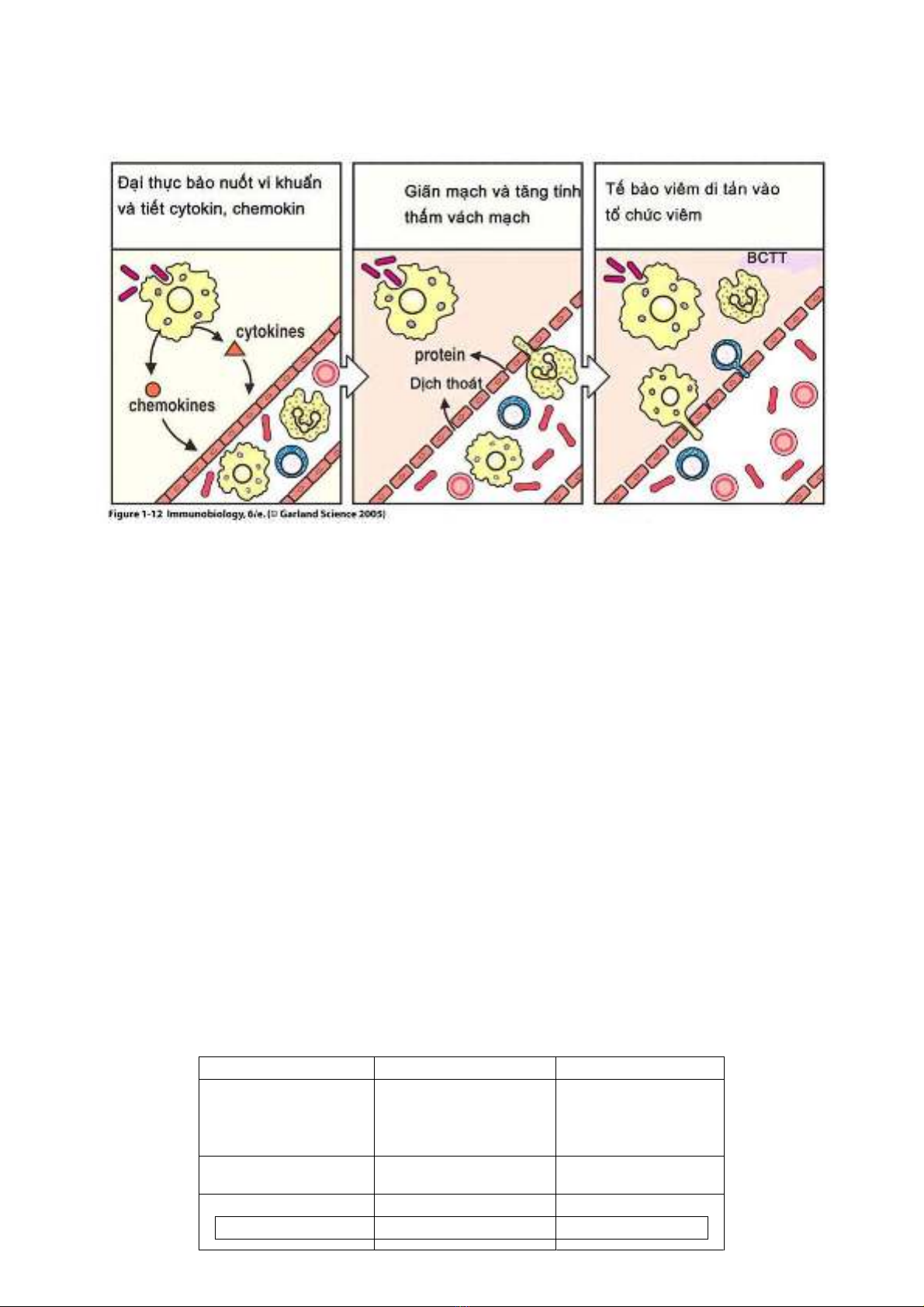
miễn dịch không đặc hiệu gồm bạch cầu hạt trung tính và tế bào đơn nhân /đại thực bào, xảy ra trong vài phút đầu tiên và có chức năng loại bỏ
các tác nhân gây bệnh và tổ chức tổn thương; (2) tiếp theo là pha đáp ứng miễn dịch không đặc hiệu sớm, liên quan các tế bào lympho có các thụ
thể kháng nguyên ít thay đổi nhằm tham gia vào sự loại bỏ kháng nguyên. Cuối cùng, khi 2 giai đoạn này không đủ loại bỏ tác nhân gây bệnh thì
cơ thể sẽ chuyển sang đáp ứng miễn dịch đặc hiệu với sự tham gia của tế bào lympho B và T đặc hiệu
2.1. Miễn dịch không đặc hiệu
Hình 1.1. Các bạch cầu hoá hướng động đến ổ viêm
Khởi đầu của pha tế bào là sự di tản của tế bào từ tuần hoàn vào ổ viêm trong khoảng 30-60 phút sau khi tác nhân gây bệnh xâm nhập.
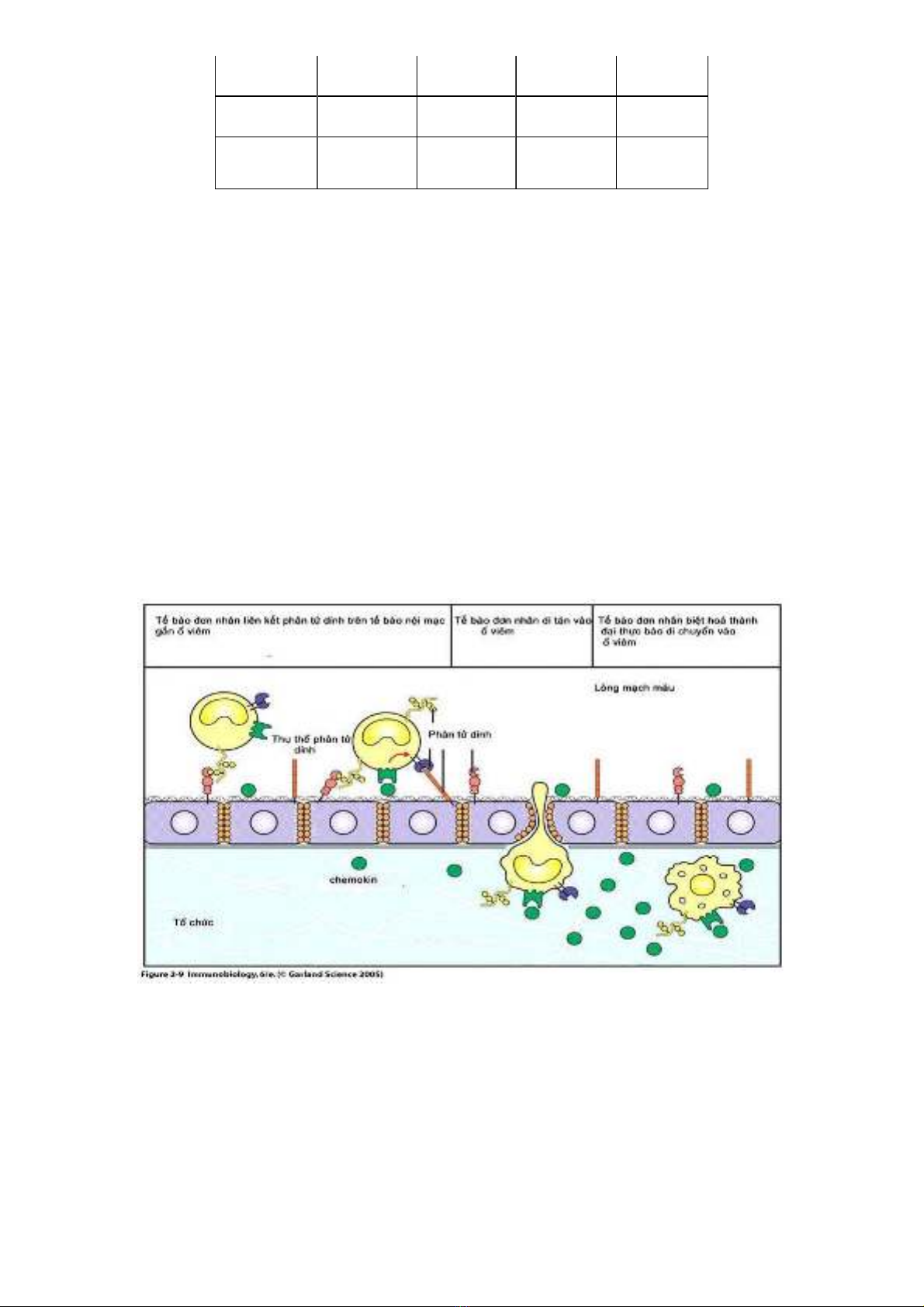
Bạch cầu hạt trung tính bám rìa dọc theo vách mạch và thoát mạch nhờ tác dụng của các phân tử hoá hướng động như IL-8, MCP-1, IP-10. Giai
đoạn đầu sự liên kết giữa các bạch cầu và tế bào nội mạc nhờ các phân tử selectin của nội mạc và các phối tử (ligand) hiện diện trên bạch cầu:
kháng nguyên sialyl-Lewis. Sự tương tác này không cố định bạch cầu mà tạo nên sự chuyển động lăn trên bề mặt tế bào vách mạch. Sự liên kết
cố định cần sự tương tác mạnh hơn với sự tham gia của cặp ICAM-1 trên tế bào nội mạc và phối tử trên bạch cầu. Sự tương tác giữa hai phân tử
sẽ ngăn cản bạch cầu và cho phép di tản bạch cầu ra khỏi lòng mạch. Sự di tản bạch cầu trong tổ chức liên kết tuỳ thuộc vào sự chênh lệch nồng
độ các hoá chất hướng động do các đại thực bào và tế bào nội mạc tại ổ viêm tiết ra. Tại ổ viêm, bạch cầu hạt trung tính có thể loại bỏ tác nhân
gây bệnh bằng cơ chế thực bào. Sự thực bào có thể trực tiếp qua các thụ thể đặc hiệu cấu trúc bề mặt vi khuẩn, hay gián tiếp sau khi được
opsonin hoá bởi các kháng thể hoặc các bổ thể. Các bạch cầu hạt trung tính sau khi nuốt các vật lạ, sản xuất các chuyển hoá độc oxy, NO,
protease, phospholipase cũng như các peptid kháng khuẩn có thể loại bỏ các vi khuẩn Gr (+) và Gr (-), nấm…Nếu các bạch cầu hạt trung tính
không đủ sức phá huỷ tác nhân gây bệnh, các đại thực bào bị hấp dẫn bởi các chất hoá hướng động do các bạch cầu hạt trung tính tiết ra, sẽ đến
ổ viêm (2-4 giờ sau đó), thực bào các bạch cầu hạt trung tính già cổi, và tất cả những vật lạ, và sản xuất các gốc hoạt hoá oxy và cytokin.
2.1.1.Hóa chất trung gian do đáp ứng miễn dịch không đặc hiệu
-Dạng hoạt động của oxy: trong số các phân tử tiết ra bởi các đại thực bào, các gốc oxy hoạt hoá có vai trò quan trọng trong việc phá huỷ
nhanh các vi sinh vật. Nhằm chống trả nhiễm trùng, các thực bào, đặc biệt là các bạch cầu hạt trung tính , tăng khr năng tiêu thụ oxy. Sự gia tăng
tiêu thụ oxy (burst oxydatif) dẫn đến tạo thành CO2 và H2O). Đôi khi, sự tạo thành các chất sau này không trực tiếp, gồm một loạt các phản ứng
cho phép sản xuất oxy và dẫn đến sự tạo thành các chất độc ( anion superoxyde: O2, peroxyde hydrogen H2O2, gốc hydroxyde OH). Những
dạng oxy hoá khuếch tán tự do và có thể gây độc ở các mức độ khác nhau: phá vỡ cấu trúc màng tế bào bằng cơ chế peroxy hoá lipid, biến đổi
các protein và các enzym, tác động với các DNA. Những tế bào sản xuất các gốc tự do này sẽ được bảo vệ bởi những hậu quả độc hại này qua
hai cơ chế (1) sản xuất các enzym có vai trò chống oxy hóa như superoxyde dimutase và catalase khử độc lần lượt anion superoxyde và
peroxyde hydrogen. Mặt khác tổng hợp các protein stress như HSP (heat shock protein) khi có sự tấn công vật lý như tăng nhiệt độ. Những
protein “chaperon” sẽ tác động như chất vận chuyển ức chế hiệu ứng sinh học của những yếu tố được vận chuyển, chúng có vai trò điều hoà tinh
tế vì chúng can thiệp cùng lúc vào cơ chế điều khiển sự sao mã một số gen.
-Cytokin: có chức năng trong đáp ứng miễn dịch không đặc hiệu thông qua khả năng chiêu mộ các tế bào thực bào và các phân tử hiệu ứng
tại nơi nhiễm trùng. Sự chiêu mộ tăng cường nhờ vào vai trò của các cytokin và các chimiokin từ các tế bào miễn dịch không đặc hiệu. Những
cytokin đáp ứng nhiễm trùng như IL-1, IL-6, IL-8, IL-12 và TNF-α. Chúng tác dụng tại chổ và toàn thân, có vai trò dẫn truyền tín hiệu giữa các
tế bào và cho phép hoạt hoá các hệ thống khác nhau. Các cytokin tiền viêm như IL-1, IL-6, TNF-α có vai trò ưu thế trong điều hoà các đại thực
bào, chúng cũng tham gia vào khả năng dính với tế bào nội mạc, di tản đến ổ viêm, thực bào, hoạt hoá các hệ thống ly giải phụ thuộc và không
phụ thuộc
Bảng 1.1. Các cytokin do đại thực bào hoạt hoá sản xuất
Cytokin Hiệu quả tại chổHiệu quả toàn thân
IL-1 Hoạt hóa tế bào nội mạc
Hoạt hóa tế bào lympho
Phá huỷ tổ chức
Sốt
Sản xuất IL-6
IL-8 Hoá hướng động và hoạt hóa
bạch cầu hạt trung tính
TNF-αHoạt hóa tế bào nội mạc
Hoạt hóa tế bào lympho
Tăng tính thấm mạch
Sốt
Mệt mỏi
Chán ăn
Bảng 1.2. Vai trò của các cytokin tiền viêm
IL-1/IL-6/TNF-α
Gan Tuỷ xương Vùng dưới đồiCơ
Tổ chức mỡ
Tế bào tua
Protein pha cấpHuy động bạch
cầu hạt trung tính
SốtTăng dị hoá
protein và lipid
Trưởng thành
Di tản
Opsonin hoá Thực bào Giảm nhân lên
của virus và vi
khuẩn
Khởi động đáp
ứng miễn dịch
đặc hiệu
-IL-1: chất trung gian polypeptid do nhiều loại tế bào tiết ra, chủ yếu là đại thực bào , tế bào keratin, tế bào xơ non, và tế bào lympho B.
Ngược lại với nhiều cytokin khác, IL-1 được dự trữ tại tế bào, do đó tác dụng của nó xảy ra lập tức. IL-1 có vai trò chủ yếu gây ra đáp ứng miễn
dịch không đặc hiệu và khởi động cho đáp ứng miễn dịch của tế bào lympho T. Nó có thể xem như một hormon viêm thực sự, có tác dụng trên hệ
thần kinh trung ương (sốt, buồn ngủ, chán ăn), tế bào gan tổng hợp các protein viêm pha cấp, huỷ cốt bào làm tăng huỷ xương, tế bào cơ trơn và
bạch cầu hạt trung tính. Sự sản xuất IL-1 đôi khi xảy ra tự nhiên, đa số trường hợp nó được kích thích bởi các vi khuẩn, virus, phần tử (tinh thể
urat), tổn thương tổ chức.
-TNF-α: sản xuất bởi đại thực bào và tế bào đơn nhân dưới tác dụng kích thích của nhiều nguyên nhân khác nhau (sản phẩm của virus, vi
khuẩn). Bản thân TNF-α kích thích tổng hợp Il-6 và IL-1, nó có hầu hết các tính chất của IL-1 như tiền viêm, chống ung thư, chống virus, chống
ký sinh trùng. Hoạt tính gây sốt có thể trực tiếp hoặc thông qua IL-1, có hoạt tính chống đông và gây ra tiết leucotrien và PAF. TNF-α do đại
thực bào tiết ra trong phản ứng viêm tác dụng trực tiếp tế bào nội mạc, làm tăng dòng máu, tính thấm của mạch, dẫn đến sự dính giữa tế bào nội
mạc và bạch cầu. Hiện tượng tạo thuận sự đông máu ở các mạch máu nhỏ tiếp xúc trực tiếp ổ viêm, sẽ tránh sư lan toả nguyên nhân gây bệnh và
qua tuần hoàn.
Trong trường hợp nhiễm trùng toàn thân, TNF có thể có những hậu quả nguy hiểm. Trong trường hợp nhiễm trùng máu, lượng TNF do đại
thực bào ở gan và lách tiết ra ồ ạt dẫn đến sự tăng tính thấm gây phù toàn thân và truỵ tim mạch. Sốc nhiễm trùng, sự sản xuất TNF quá mức gây
đông máu trong mạch lan toả với sự tiêu thụ ồ ạt các yếu tố đông máu, tình trạng xuất huyết dẫn đến suy sụp đa phủ tạng và tử vong.
-IL-6: do nhiều loại tế bào tiết ra (tế bào biểu mô, tế bào nội mạc, tế bào đơn nhân, đại thực bào , tế bào keratin, tế bào gan, tế bào sao)
dưới tác dụng của nhiều kích thích khác nhau. Trong quá trình viêm, IL-6 hoạt động như một chất gây sốt nội sinh, tương tự như IL-1 và TNF.
IL-6 cũng là cytokin kích thích gan sản xuất protein pha viêm cấp. Ngoài ra, IL-6 còn do tế bào lympho TCD4+ sản xuất và có ảnh hưởng qúa
trình chín của tế bào lympho B trở thành tương bào bài tiết kháng thể khởi động đáp ứng miễn dịch đặchiệu.
Hình 1.2. Cơ chế thoát mạch của bạch cầu – vai trò của các phân tử dính
-Một số cytokin khác: IL-2, IL-3, IL-4, IFN-γ và CSF (colony stimulating factor) tham gia vào phản ứng viêm nhưng hoạt động của chúng
giới hạn và ít rõ ràng ở in vivo. Một trong những chức năng đó là tăng dự trữ bạch cầu hạt. Những cytokin do đại thực bào sản xuất có tác dụng
toàn thân đóng góp vào việc loại bỏ các tác nhân gây bệnh: trong đó có tình trạng tăng thân nhiệt, tăng bạch cầu, nhất là tăng bạch cầu hạt trung
tính. Tăng bạch cầu từ tuỷ xương và do huy động các bạch cầu hạt trung tính bám rìa vách mạch đi vào máu.
-Chimiokin: những peptid nhỏ giống như cytokin, tổng hợp bởi các đại thực bào. Những cytokin khác nhau có cấu trúc peptid gần giống
nhau và có tất cả những tính chất hoá hướng động bạch cầu, cho phép chiêu mộ các tế bào đơn nhân, bạch cầu hạt trung tính từ máu đến ổ viêm.
Một số chimiokin cũng có vai trò trong sự phát triển tế bào lympho và tăng sinh mạch. Các đại thực bào tổ chức khởi động đáp ứng miễn dịch và
số lượng của chúng tăng nhanh do tác dụng của chimiokin và tập trung tại ổ viêm. Ba chimiokin do tế bào nội mạc sản xuất là IL-8, MCP-1 và
IP-1, IL-8 thuộc họ chimiokin CXC, do nhiều loại tế bào sản xuất (tế bào biểu mô, tế bào nội mạc, tế bào đơn nhân, tế bào keratin, tế bào gan, tế
bào xơ non, tế bào NK, tế bào lympho T) dưới tác dụng của IL-1, TNF-α, PAF-acether hay LPS. Nó thu hút và kích thích sự dính các bạch cầu
hạt trung tính với tế bào nội mạc bằng cách tăng biểu lộ intergrin trên bạch cầu hạt trung tính. IL-8 tăng vỡ hạt bạch cầu hạt trung tính, tăng hoạt
tính enzym và thực bào. Ngoài ra, IL-8 tăng tính thấm mạch và đồng kích thích tiết LTB4.
2.1.2. Protein pha viêm cấp: IL-1, IL-6 và TNF-α hoạt hoá tế bào gan tổng hợp các protein viêm cấp. Trong số các loại protein viêm này
có hai loại hoạt động có cơ chế như hiệu ứng của kháng thể nhưng không có tính đặc hiệu là CRP và MBL.
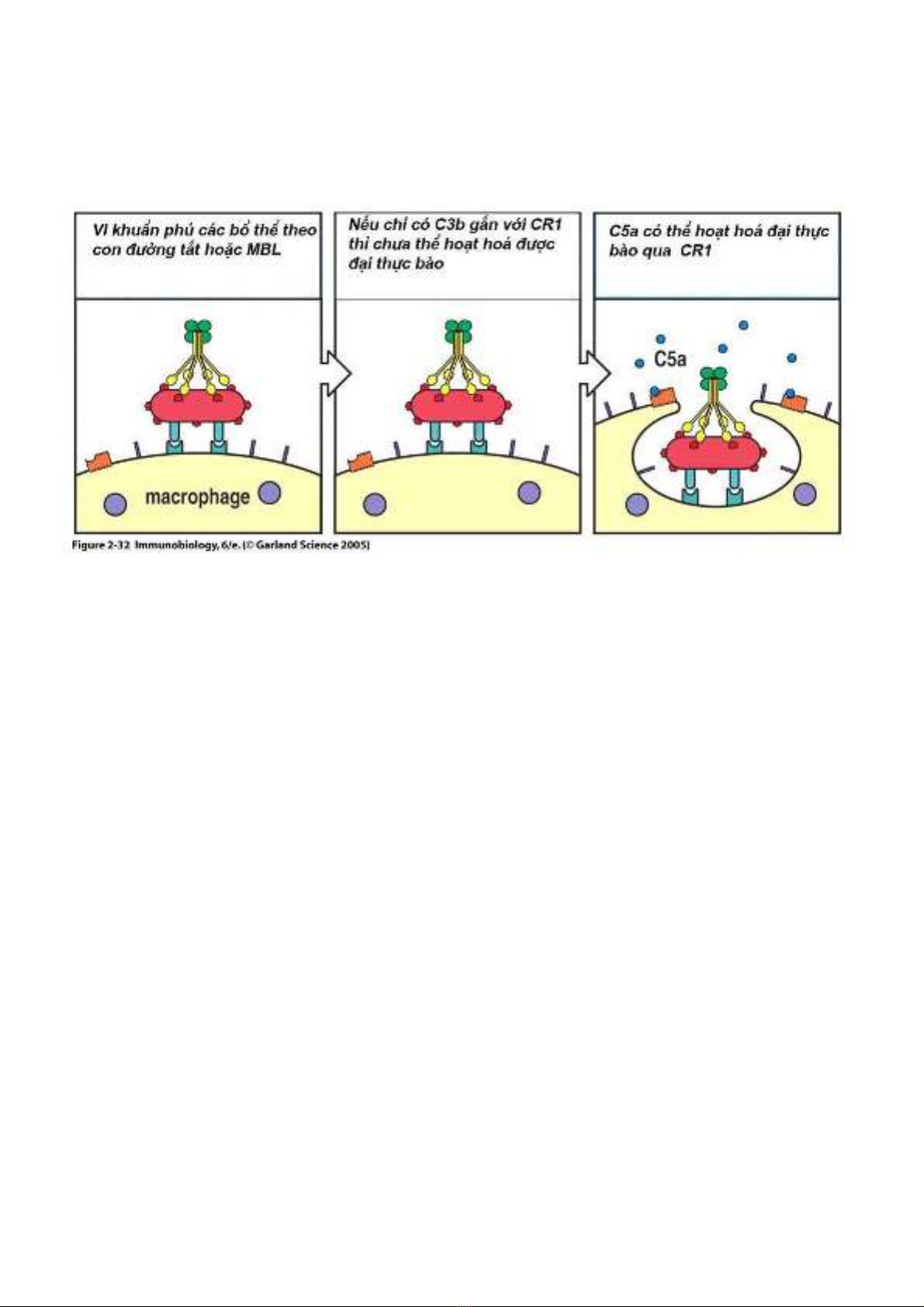
C – reactive protein: thuộc họ pentraxin, CRP gắn lên phosphorylcholin hiện diện ở bề mặt của một số vi khuẩn. Khi CRP gắn với vi
khuẩn, chúng có thể tác dụng theo hai cách. Thứ nhất là opsonin hoá đơn giản các vi sinh vật tạo thuận cho hiện tượng thực bào và thứ hai là
hoạt hoá bổ thể theo con đường cổ điển bằng cách gắn CRP lên mảnh C1q.
Mannan binding lectin (MBL): hiện diện lượng ít trong huyết thanh nhưng lại sản xuất rất nhiều trong phản ứng viêm. MBL gắn với cặn
mannose hiện diện trên bề mặt của nhiều loại vi khuẩn và có cơ chế tác dụng như CRP.
Hình 1.3. Cơ chế hoạt hoá đại thực bào bằng con đường tắt hoặc qua MBL
2.2. Đáp ứng miễn dịch không đặc hiệu sớm
Hoạt hoá bổ thể bằng con đường tắt, thực bào, hay phá huỷ các tác nhân gây bệnh bới các đại thực bào của hệ thống miễn dịch không đặc
hiệu xảy ra trong vài giờ đầu sau khi xảy ra nhiễm trùng. Nếu các vi sinh vật thoát khỏi sự đề kháng không đặc hiệu, thì quá trình chống đỡ của
cơ thể sẽ liên quan đến hoạt động của nhiều cơ chế hiệu ứng miễn dịch đặc hiệu khác nhau.
Đáp ứng miễn dịch không đặc hiệu nhận biết kháng nguyên với các thụ thể ít thay đổi và không đặc hiệu. Hoạt động của các cơ chế này
không có trí nhớ miễn dịch có khả năng bảo vệ cơ thể chống lại sự tái xâm nhập của vi sinh vật.
Đáp ứng miễn dịch không đặc hiệu sớm có vai trò quyết định trong sự đề kháng của cơ thể, và cũng đinh hướng cho đáp ứng miễn dịch đặc
hiệu sau này. Trước hết là nó khống chế tình trạng nhiễm trùng trước khi có đáp ứng miễn dịch đặc hiệu. Sau đó, nhờ vào các cytokin, tạo thuận
cho đáp ứng miễn dịch đặc hiệu dịch thể hay tế bào.
2.2.1. Các tế bào liên quan đáp ứng miễn dịch không đặc hiệu sớm
- Tế bào NK: kiểm soát sớm một số nhiễm trùng đối với vi sinh vật nội bào như Herpes, Leishmania, Listeria). Hoạt tính độc của tế bào NK
tăng bởi IFN-α và IL-12, là hai cytokin khởi động của đáp ứng miễn dịch không đặc hiệu sớm. Tế bào NK nhận biết các tế bào nhiễm nhờ vào
hai loại thụ thể bề mặt.
+Thụ thể lectin: có hoạt tính hoạt hoá có khả năng nhận biết một số phân tử bề mặt của tế bào bị nhiễm vi sinh vật và sẽ hoạt hoá độc tính
ở tế bào NK.
+Thụ thể ức chế (KIR: killer inhibiting receptor) nhận biết phân tử MHC lớp I ở bề mặt tế bào đích. Nếu tế bào biểu lộ MHC lớp I với số
lượng bình thường, thì KIR sẽ được hoạt hoá và tế bào NK không phá huỷ tế bào đích. Ngược lại, trong khi nhiễm virus thì số lượng MHC giảm,
tế bào NK không còn nhận biết tín hiệu ức chế và có thể hoạt hoá cơ chế phá huỷ tế bào đích.
-Tế bào lympho Tγd hiện diện một lượng ít ở các tế bào tuần hoàn. Chúng được tìm thấy ở tế bào biểu mô bề mặt như da, niêm mạc, chúng
còn được gọi là các tế bào lympho trong biểu mô. Các tế bào này nhận diện hết sức đặc biệt các kháng nguyên rất giới hạn như các protein sốc
nhiệt (HSP). Sự nhận biết này trực tiếp không cần MHC.
-Tế bào lympho B1a. Tế bào lympho B sản xuất kháng thể theo lý thuyết là ưu tiên cho đáp ứng miễn dịch đặc hiệu. Tuy nhiên, tồn tại một
dòng tế bào lympho B phân biệt được nhờ biểu lộ CD5 trên màng, gọi là tế bào lympho B1a và có tính chất khác với tế bào lympho B kinh điển.
Chúng sản xuất các kháng thể tự nhiên lớp IgM chống lại các kháng nguyên lipid và polysaccharide. Sự sản xuất các kháng thể này đòi hỏi sự
hiện diện của IL-5, chúng được sản xuất 48 giờ sau khi nhiễm trùng và liên kết với polysaccharide hiện diện trên bề mặt của vi khuẩn. Một khi
gắn được với bề mặt vi khuẩn thì chúng hoạt hoá bổ thể.
2.3. Đáp ứng miễn dịch đặc hiệu
Đáp ứng miễn dịch đặc hiệu khởi động sau vài ngày khi các cơ chế liên quan đáp ứng miễn dịch tự nhiên và không đặc hiệu sớm bị xâm
chiếm bởi các vi sinh vật gây bệnh, dẫn đến sự hoạt hoá tế bào lympho B và T hiệu ứng đặc hiệu với tác nhân gây bệnh.
Ngược với đáp ứng miễn dịch tự nhiên và không đặc hiệu sớm, thì đáp ứng miễn dịch đặc hiệu không khởi động ở nơi xâm nhập của vi sinh
vật trong cơ thể. Chúng phát trển ở tổ chức lympho ngoại vi là nơi các vi sinh vật hay các sản phẩm của chúng đi qua bởi hệ thống mạch lympho.
Trong các hạch, các tế bào trình diện kháng nguyên như các đại thực bào hay tế bào lympho B có thể bắt giữ các kháng nguyên và trình diện cho
tế bào lympho T trinh có các thụ thể kháng nguyên. Một số tế bào như tế bào tua, có khả năng bắt giữ tại chổ kháng nguyên và vận chuyển kháng
nguyên trong các hạch lympho. Những tế bào tua ở ngoại vi có kiểu hình chưa trưởng thành đặc trưng bởi sự biểu lộ yếu MHC lớp II và vắng mặt
các phân tử đồng kích thích ở bề mặt, những tế bào tua chưa chín này không thể hoạt hoá tế bàolympho T trinh. Ngược lại, chúng rất có hiệu quả
khi bắt giữ các kháng nguyên bằng cách nuốt (endocytose, macropinocytose). Một khi kháng nguyên ngoại sinh xâm nhập vào tổ chức, các tế
bào tua nuốt các kháng nguyên và được hoạt hoá bởi các cytokin sản xuất tại chổ do các tế bào miễn dịch tự nhiên và không đặc hiệu sớm. Toàn
bộ các tín hiệu này sẽ thay đổi kiểu hình của tế bào tua và làm mất khả năng nuốt kháng nguyên theo kiểu endocytose và pinocytose và biểu lộ
đầy đủ MHC lớp II, phân tử dính và các phân tử đồng kích thích. Các tế bào tua trưởng thành sẽ di chuyển đến các hạch ở các vùng lân cận và


















![Động lực làm việc của nhân viên y tế: Thực tế từ Bệnh viện Quân y 175 [Phân tích chuyên sâu]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260124/vihennessy-11/135x160/91769227641.jpg)




![Bài giảng Dịch tễ học Trường CĐ Phương Đông Quảng Nam [Mới Nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260123/lionelmessi01/135x160/15031769186053.jpg)

![Giáo trình Dinh dưỡng An Toàn Thực Phẩm: [Hướng Dẫn Chi Tiết/Mới Nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260123/lionelmessi01/135x160/19031769194228.jpg)
