1
SỞ GIÁO DỤC VÀ ðÀO TẠO
THÀNH PHỐ ðÀ NẴNG HƯỚNG DẪN CHẤM KÌ THI HỌC SINH GIỎI THÀNH PHỐ
NĂM HỌC 2004 - 2005
MÔN: HÓA HỌC LỚP 10
Thời gian: 150 phút (không kể thời gian giao ñề)
Câu I (4 ñiểm)
1. Hãy giải thích tại sao phân tử Cl
2
O có góc liên kết (111
o
) nhỏ hơn và ñộ dài liên kết Cl-O (1,71Å)
lớn hơn so với phân tử ClO
2
(118
o
và 1,49Å)?
2. So sánh và giải thích ñộ mạnh:
(a) tính axit, tính oxi hóa của các chất HClO, HClO
2
, HClO
3
và HClO
4
.
(b) tính axit, tính khử của các chất HF, HCl, HBr, HI
3. Giải thích sự biến ñổi khối lượng riêng của nước theo nhiệt ñộ:
Nhiệt ñộ (
o
C)......... 0 4 10 15 20
D (g/ml)................ 0,999866 1,000000 0,999727 0,999127 0,998230
ðÁP ÁN ðIỂM
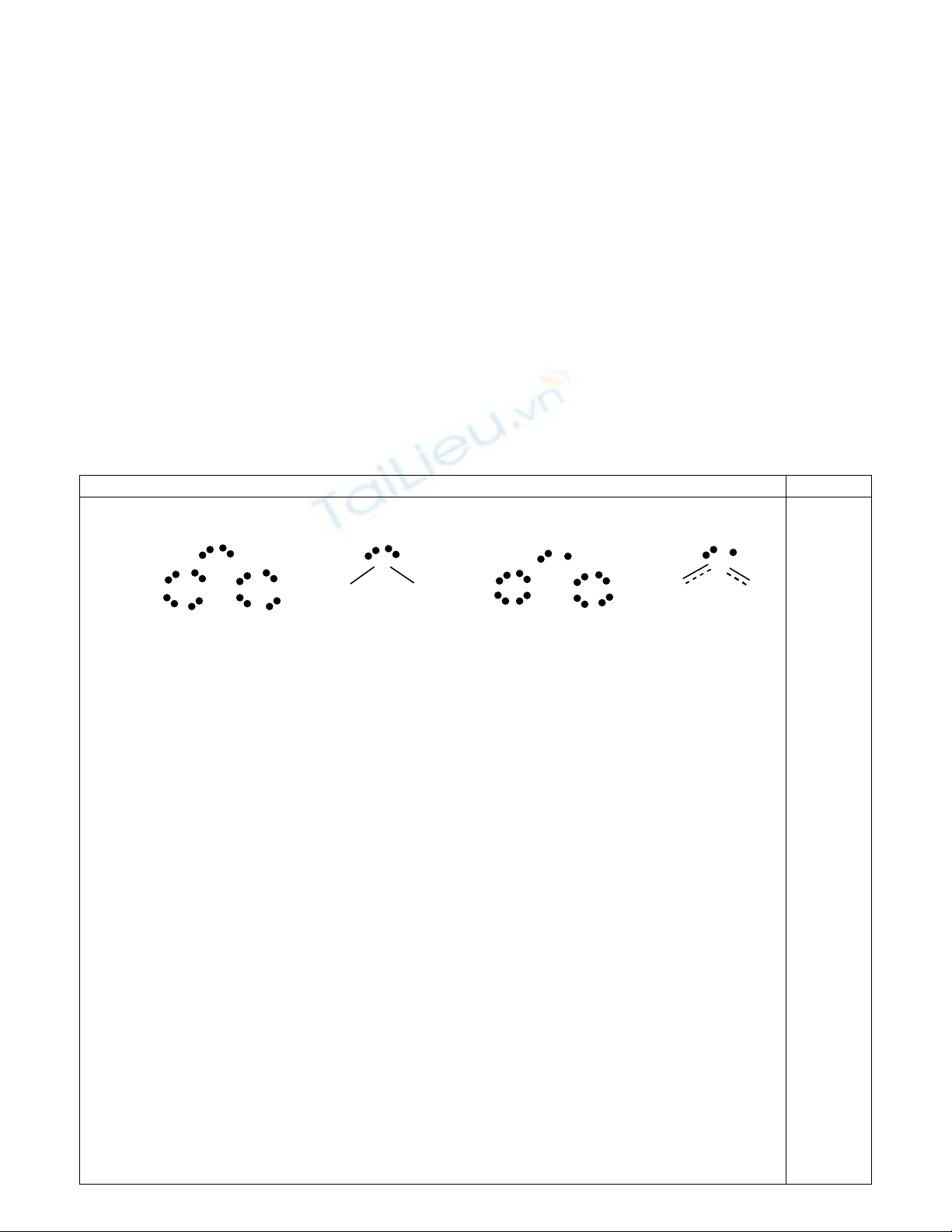
1. Công thức electron và công thức cấu tạo của hai phân tử:
Cl
OO
Cl Cl
O
Cl Cl
OCl
OO
Góc liên k
ế
t c
ủ
a Cl
2
O nh
ỏ
h
ơ
n c
ủ
a ClO
2
là vì nguyên t
ử
trung tâm (O) c
ủ
a Cl
2
O có
hai c
ặ
p electron t
ự
do t
ạ
o l
ự
c
ñẩ
y ép góc liên k
ế
t nhi
ề
u h
ơ
n so v
ớ
i nguyên t
ử
trung
tâm (Cl) c
ủ
a ClO
2
ch
ỉ
có 3 electron t
ự
do.
Liên k
ế
t Cl-O trong phân t
ử
ClO
2
có
ñặ
c tính c
ủ
a liên k
ế
t
ñ
ôi do s
ự
c
ộ
ng h
ưở
ng v
ớ
i
electron
ñộ
c thân
ở
trên Cl ho
ặ
c O.
ðặ
c tính liên k
ế
t
ñ
ôi này làm liên k
ế
t Cl-O trong
ClO
2
ng
ắ
n h
ơ
n trong Cl
2
O (ch
ỉ
ch
ứ
a liên k
ế
t
ñơ
n).
2. ðộ
m
ạ
nh tính axit:
(a)
HClO < HClO
2
< HClO
3
< HClO
4
S
ố
nguyên t
ử
oxi không hidroxyl t
ă
ng làm t
ă
ng
ñộ
phân c
ự
c c
ủ
a liên k
ế
t O-H
(b)
HF < HCl < HBr < HI
Bán kính nguyên t
ử
t
ă
ng làm
ñộ
b
ề
n liên k
ế
t gi
ả
m, kh
ả
n
ă
ng b
ị
phân c
ự
c hóa c
ủ
a
liên k
ế
t H-X t
ă
ng.
ðộ
m
ạ
nh tính oxi hóa - kh
ử
(a)
Tính oxi hóa gi
ả
m: HClO > HClO
2
> HClO
3
> HClO
4
S
ố
nguyên t
ử
oxi t
ă
ng làm t
ă
ng
ñộ
b
ề
n phân t
ử
(
ñộ
b
ộ
i liên k
ế
t t
ă
ng) nên
ñộ
m
ạ
nh
tính oxi hóa gi
ả
m.
(b)
Tính kh
ử
t
ă
ng: HF < HCl < HBr < HI
Bán kính nguyên t
ử
t
ă
ng làm gi
ả
m
ñộ
b
ề
n phân t
ử
, làm t
ă
ng tính kh
ử
1,00
(0,50
×
2)
2,00
(0,50
×
4)
2
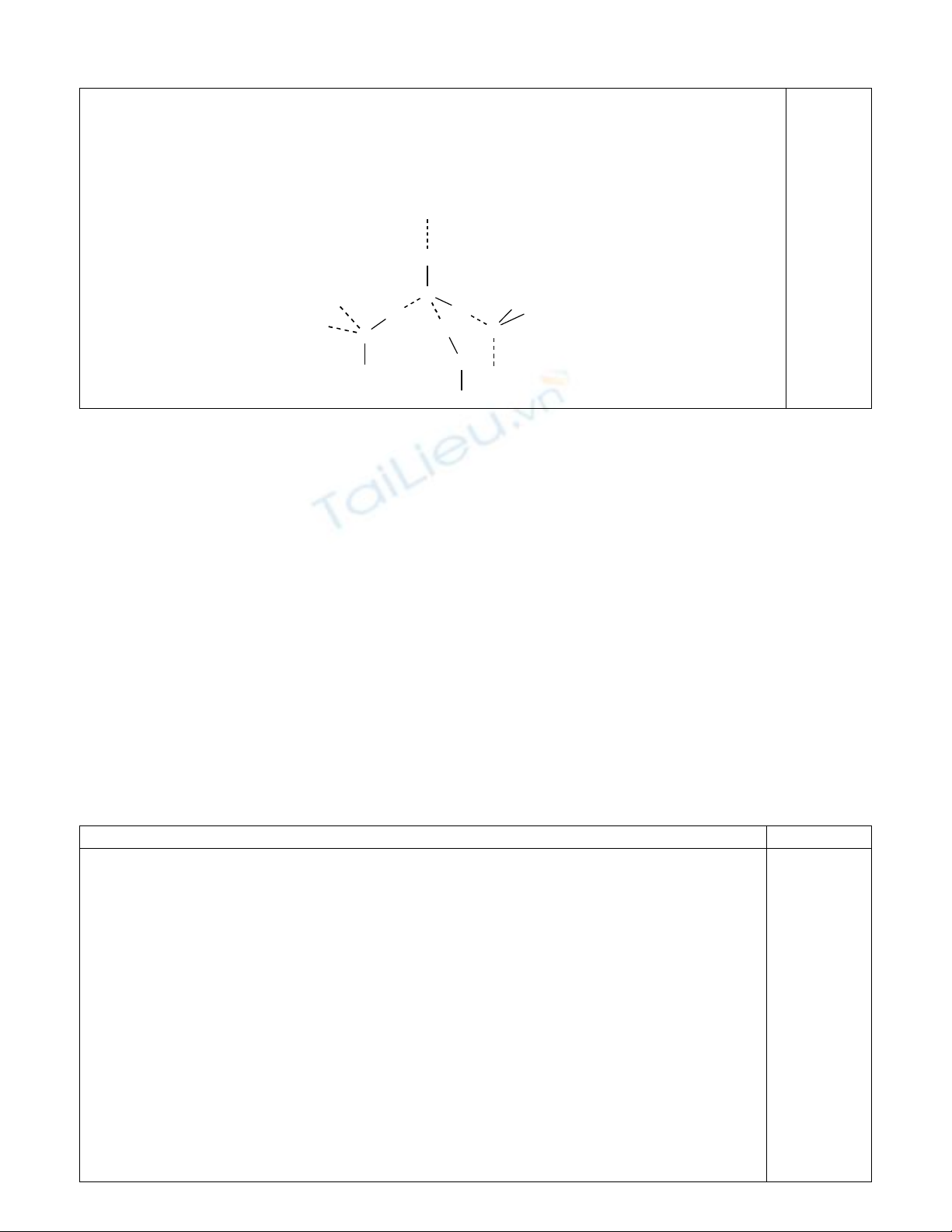
3. Ở
n
ướ
c
ñ
á (0
o
C), các phân t
ử
liên k
ế
t v
ớ
i nhau b
ằ
ng liên k
ế
t H hình thành c
ấ
u trúc tinh
th
ể
phân t
ử
khá r
ỗ
ng (xem hình d
ướ
i), kh
ố
i l
ượ
ng riêng nh
ỏ
. Khi nhi
ệ
t
ñộ
t
ă
ng (4
o
C),
liên k
ế
t H b
ị
phá v
ỡ
m
ộ
t ph
ầ
n khi
ế
n các phân t
ử
xích l
ạ
i g
ầ
n nhau h
ơ
n nên kh
ố
i l
ượ
ng
riêng t
ă
ng. Khi ti
ế
p t
ụ
c t
ă
ng nhi
ệ
t
ñộ
, kho
ả
ng cách gi
ữ
a các phân t
ử
t
ă
ng làm th
ể
tích
t
ă
ng lên nên kh
ố
i l
ượ
ng riêng gi
ả
m.
H
O
HH
H
O
O
H
O
HH
H
1,00
(0,50
×
2)
Câu II
(4
ñ
i
ể
m)
1.
Xác
ñị
nh nhi
ệ
t hình thành AlCl
3
khi bi
ế
t:
Al
2
O
3
(r) + 3COCl
2
(k)
→
3CO
2
(k) + 2AlCl
3
(r)
∆
H
1
= -232,24 kJ
CO (k) + Cl
2
(k)
→
COCl
2
(k)
∆
H
2
= -112,40 kJ
2Al (r) + 1,5O
2
(k)
→
Al
2
O
3
(k)
∆
H
3
= -1668,20 kJ
Nhi
ệ
t hình thành c
ủ
a CO:
∆
H
4
= -110,40 kJ/mol
Nhi
ệ
t hình thành c
ủ
a CO
2
:
∆
H
5
= -393,13 kJ/mol.
2.
T
ạ
i 25
o
C ph
ả
n
ứ
ng b
ậ
c m
ộ
t sau có h
ằ
ng s
ố
t
ố
c
ñộ
k = 1,8.10
-5
s
-1
:
2N
2
O
5
(k)
→
4NO
2
(k) + O
2
(k)
Ph
ả
n
ứ
ng trên x
ả
y ra trong bình kín có th
ể
tích 20,0 L không
ñổ
i. Ban
ñầ
u l
ượ
ng N
2
O
5
cho v
ừ
a
ñầ
y
bình. T
ạ
i th
ờ
i
ñ
i
ể
m kh
ả
o sát, áp su
ấ
t riêng c
ủ
a N
2
O
5
là 0,070 atm. Gi
ả
thi
ế
t các khí
ñề
u là khí lí t
ưở
ng.
(a) Tính t
ố
c
ñộ
(i) tiêu th
ụ
N
2
O
5
; (ii) hình thành NO
2
; O
2
.
(b) Tính s
ố
phân t
ử
N
2
O
5
ñ
ã b
ị
phân tích sau 30 giây.
3.
Ph
ả
n
ứ
ng d
ướ
i
ñ
ây
ñạ
t
ñế
n cân b
ằ
ng
ở
109K v
ớ
i h
ằ
ng s
ố
cân b
ằ
ng K
p
= 10:
C (r) + CO
2
(k)
2CO (k)
(a) Tìm hàm l
ượ
ng khí CO trong h
ỗ
n h
ợ
p cân b
ằ
ng, bi
ế
t áp su
ấ
t chung c
ủ
a h
ệ
là 1,5atm.
(b)
ðể
có hàm l
ượ
ng CO b
ằ
ng 50% v
ề
th
ể
tích thì áp su
ấ
t chung là bao nhiêu?
ðÁP ÁN ðIỂM
1.
Nhi
ệ
t hình thành AlCl
3
là nhi
ệ
t c
ủ
a quá trình:
Al + 1,5Cl
2
→
AlCl
3
ðể
có quá trình này ta s
ắ
p x
ế
p các ph
ươ
ng trình nh
ư
sau:
Al
2
O
3
(r) + 3COCl
2
(k)
→
3CO
2
(k) + 2AlCl
3
(k)
∆
H
1
3CO (k) + 3Cl
2
(k)
→
3COCl
2
(k)
3
∆
H
2
2Al (r) + 1,5O
2
(k)
→
Al
2
O
3
(r)
∆
H
3
3C (k) + 1,5O
2
(k)
→
3CO (k) 3
∆
H
4
3CO
2
(k)
→
3C (r) + 3O
2
(k)
3(-
∆
H
5
)
Sau khi t
ổ
h
ợ
p có k
ế
t qu
ả
là:
2Al (r) + 3Cl
2
(k)
→
2AlCl
3
(r)
∆
H
x
∆
H
x
=
∆
H
1
+ 3
∆
H
2
+
∆
H
3
+ 3
∆
H
4
+ 3(-
∆
H
5
)
= (-232,24) + 3(-112,40) + (-1668,20) + 3(-110,40) + 3(393,13) = - 1389,45 kJ
V
ậ
y, nhi
ệ
t hình thành 1 mol AlCl
3
= -1389,45 / 2 =
- 694,725 kJ/mol
1,50
(1,00+0,50)

3
2.
(a) p
i
V = n
i
RT
⇒
3
i
ON
ON
10.8646,2
298082,0
07,0
RT
P
V
n
C
52
52
−
=
×
===
(mol.l
-1
)
⇒
835
ON
10.16,510.8646,210.8,1C.kv
52
−−−
=×==
mol.l
-1
.s
-1
.
T
ừ
ph
ươ
ng trình: 2N
2
O
5
(k)
→
4NO
2
(k) + O
2
(k)
⇒
dt
dC
dt
dC
4
1
dt
dC
2
1
v
22
52
ONOON
+=×+=×−=
nên v
tiêu thụ
(N
2
O
5
) =
−
2v =
−
2
×
5,16.10
-8
=
−
10,32.10
-8
mol.l
-1
.s
-1
v
hình thành
(NO
2
) = 4v = 4
×
5,16.10
-8
= 20,64.10
-8
mol.l
-1
.s
-1
v
hình thành
(O
2
) = v = 5,16.10
-8
mol.l
-1
.s
-1
(b) S
ố
phân t
ử
N
2
O
5
ñ
ã b
ị
phân h
ủ
y = v
tiêu thụ
(N
2
O
5
)
×
V
bình
×
t
×
N
o
(s
ố
avogadrro)
= 10,32.10
-8
×
20,0
×
30
×
6,023.10
23
≈
3,7.10
19
phân t
ử
3.
(a) C + CO
2
2CO
∑
n
[ ] (1 - x) 2x 1 + x (mol)
Ta có:
5,1
x1
x1 x1
x2
P
P
K
2
CO
2
CO
P
2
×
+
−
+
==
= 10
⇒
x = 0,79
V
ậ
y h
ỗ
n h
ợ
p cân b
ằ
ng ch
ứ
a 2.0,79 = 1,58 mol CO (88,27%) và 1 – 0,79 = 0,21 mol
CO
2
(11,73%)
(b) T
ừ
10P
5,0
)5,0(
K
2
P
=×=
⇒
P = 20 atm.
1,00
(0,25
×
4)
0,50
1,00
(0,50
×
2)
Câu III
(4
ñ
i
ể
m)
1.
Vi
ế
t ph
ươ
ng trình các ph
ả
n
ứ
ng t
ươ
ng
ứ
ng v
ớ
i trình t
ự
bi
ế
n
ñổ
i s
ố
oxi hóa c
ủ
a l
ư
u hu
ỳ
nh sau
ñ
ây:
2
S
−
→
)1(
0
S
→
)2(
4
S
+
→
)3(
6
S
+
→
)4(
4
S
+
→
)5(
0
S
→
)6(
2
S
−
2.
Trình bày ph
ươ
ng pháp nh
ậ
n bi
ế
t các ion halogenua trong m
ỗ
i dung d
ị
ch h
ỗ
n h
ợ
p sau
ñ
ây: (a) NaI
và NaCl, (b) NaI và NaBr.
3.
Vi
ế
t ph
ươ
ng trình ph
ả
n
ứ
ng minh h
ọ
a quá trình
ñ
i
ề
u ch
ế
các ch
ấ
t sau
ñ
ây t
ừ
các
ñơ
n ch
ấ
t halogen
t
ươ
ng
ứ
ng: (a) HClO
4
, (b) I
2
O
5
, (c) Cl
2
O, (d) OF
2
.
ðÁP ÁN ðIỂM
1.
Ph
ươ
ng trình ph
ả
n
ứ
ng:
(1)
H
2
S + 1/2O
2
→
S + H
2
O
(2)
S + O
2
→
t
SO
2
(3)
SO
2
+ Cl
2
+ 2H
2
O
→
H
2
SO
4
+ 2HCl
(4)
Cu + 2H
2
SO
4
→
CuSO
4
+ SO
2
+ 2H
2
O
(5)
SO
2
+ 2H
2
S
→
3S + 2H
2
O
(6)
2Na + S
→
t
Na
2
S
(H
ọ
c sinh có th
ể
s
ử
d
ụ
ng các ph
ả
n
ứ
ng khác cho quá trình này)
1,50
(0,25
×
6)

4
2.
(a) Thêm t
ừ
t
ừ
AgNO
3
vào m
ẫ
u th
ử
, th
ấ
y xu
ấ
t hi
ệ
n k
ế
t t
ủ
a vàng tr
ướ
c và k
ế
t t
ủ
a tr
ắ
ng
sau, nh
ậ
n ra
ñượ
c hai ion I
-
và Cl
-
.
Ag
+
+ I
-
→
AgI
↓
(vàng)
Ag
+
+ Cl
-
→
AgCl
↓
(tr
ắ
ng)
(b) Thêm H
2
SO
4
và benzen vào m
ẫ
u th
ử
. Thêm t
ừ
ng gi
ọ
t n
ướ
c clo, l
ắ
c
ñề
u. Th
ấ
y xu
ấ
t
hi
ệ
n màu tím trong l
ớ
p benzen, sau
ñ
ó m
ấ
t màu khi n
ướ
c clo d
ư
nh
ậ
n ra I
-
. Thêm ti
ế
p
n
ướ
c clo, xu
ấ
t hi
ệ
n l
ớ
p vàng nâu trong l
ớ
p benzen nh
ậ
n ra Br
-
.
Cl
2
+ 3I
-
→
2Cl
-
+ I
3-
I
2
+ 5Cl
2
+ 6H
2
O
→
12H
+
+ 10Cl
-
+ 2IO
3-
Cl
2
+ 2Br
-
→
2Cl
-
+ Br
2
3.
(a) 3Cl
2
+ 6NaOH
→
t
5NaCl + NaClO
3
+ 3H
2
O
4NaClO
3
→
t
NaCl + 3NaClO
4
NaClO
4
+ H
2
SO
4
→
NaHSO
4
+ HClO
4
(ch
ư
ng c
ấ
t)
(b) 3I
2
+ 6OH
-
→
5I
-
+ IO
3-
+ 3H
2
O
IO
3-
+ H
+
→
HIO
3
2HIO
3
→
t
I
2
O
5
+ H
2
O
(c) 2Cl
2
+ HgO
→
Cl
2
O + HgCl
2
(d) 2F
2
+ 2OH
-
→
2F
-
+ OF
2
+ H
2
O
1,00
(0,50
×
2)
1,50
0,50
0,50
0,25
0,25
Câu IV
(4
ñ
i
ể
m)
Cho 6,000 g m
ẫ
u ch
ấ
t ch
ứ
a Fe
3
O
4
, Fe
2
O
3
và các t
ạ
p ch
ấ
t tr
ơ
. Hòa tan m
ẫ
u vào l
ượ
ng d
ư
dung d
ị
ch KI
trong môi tr
ườ
ng axit (kh
ử
t
ấ
t c
ả
s
ắ
t thành Fe
2+
) t
ạ
o ra dung d
ị
ch A. Pha loãng dung d
ị
ch A
ñế
n th
ể
tích
50 mL. L
ượ
ng I
2
có trong 10 mL dung d
ị
ch A ph
ả
n
ứ
ng v
ừ
a
ñủ
v
ớ
i 5,500 mL dung d
ị
ch Na
2
S
2
O
3
1,00M (sinh ra S
4
O
62-
). L
ấ
y 25 mL m
ẫ
u dung d
ị
ch A khác, chi
ế
t tách I
2
, l
ượ
ng Fe
2+
trong dung d
ị
ch
còn l
ạ
i ph
ả
n
ứ
ng v
ừ
a
ñủ
v
ớ
i 3,20 mL dung d
ị
ch MnO
4-
1,000M trong H
2
SO
4
.
1.
Vi
ế
t các ph
ươ
ng trình ph
ả
n
ứ
ng x
ả
y ra (d
ạ
ng ph
ươ
ng trình ion thu g
ọ
n).
2.
Tính ph
ầ
n tr
ă
m kh
ố
i l
ượ
ng Fe
3
O
4
và Fe
2
O
3
trong m
ẫ
u ban
ñầ
u.
ðÁP ÁN ðIỂM
1.
Ph
ươ
ng trình ph
ả
n
ứ
ng:
Fe
3
O
4
+ 2I
-
+ 8H
+
→
3Fe
2+
+ I
2
+
4H
2
O (1)
Fe
2
O
3
+ 2I
-
+ 6H
+
→
2Fe
2+
+ I
2
+
3H
2
O (2)
2S
2
O
32-
+ I
2
→
S
4
O
62-
+ 2I
-
(3)
5Fe
2+
+ MnO
4-
+ 8H
+
→
5Fe
3+
+ Mn
2+
+ 4H
2
O (4)
2.
Tính ph
ầ
n tr
ă
m:
(3)
⇒
mol00275,010055,0
2
1
n
2
1
n2
32
2
OS
)3(I
=×==
−
(4)
⇒
mol016,010032,05n5n
4
2
MnO)4(Fe
=××== −+
ðặ
t s
ố
mol Fe3O4 và Fe2O3 l
ầ
n l
ượ
t là x và y ta có:
=
=
⇒
=×=+
=×=+
00925,0y
0045,0x
01375,0500275,0yx
032,02016,0y2x3
%4,17%100
000,6
2320045,0
m%
43
OFe
=×
×
=
%7,24%100
000,6
16000925,0
m%
32
OFe
=×
×
=
2,00
(0,50
×
4)
2,00

5
Câu V
(4
ñ
i
ể
m)
Th
ự
c t
ế
khoáng pirit có th
ể
coi là h
ỗ
n h
ợ
p c
ủ
a FeS2 và FeS. Khi x
ử
lí m
ộ
t m
ẫ
u khoáng pirit b
ằ
ng brom
trong dung d
ị
ch KOH d
ư
ng
ườ
i ta thu
ñượ
c k
ế
t t
ủ
a
ñỏ
nâu A và dung d
ị
ch B. Nung k
ế
t t
ủ
a B
ñế
n kh
ố
i
l
ượ
ng không
ñổ
i thu
ñượ
c 0,2g ch
ấ
t r
ắ
n. Thêm l
ượ
ng d
ư
dung d
ị
ch BaCl2 vào dung d
ị
ch B thì thu
ñượ
c
1,1087g k
ế
t t
ủ
a tr
ắ
ng không tan trong axit.
1.
Vi
ế
t các ph
ươ
ng trình ph
ả
n
ứ
ng.
2.
Xác
ñị
nh công th
ứ
c t
ổ
ng c
ủ
a pirit.
3.
Tính kh
ố
i l
ượ
ng brom theo lí thuy
ế
t c
ầ
n
ñể
oxi hóa m
ẫ
u khoáng.
ðÁP ÁN ðIỂM
1.
Ph
ươ
ng trình ph
ả
n
ứ
ng:
2FeS2 + 15Br2 + 38OH-
→
2Fe(OH)3 + 4SO42- + 30Br- + 16H2O (1)
2FeS + 9Br2 + 22OH-
→
2Fe(OH)3 + 2SO42- + 18Br- + 8H2O (2)
2Fe(OH)3
→
Fe2O3 + 3H2O (3)
Ba2+ + SO42-
→
BaSO4 (4)
2.
Công th
ứ
c:
mol10.5,2
160
2,0
2n2n,mol10.75,4
233
1087,1
nn
3
OFeFe
3
SOBaS
324
−−
======
9,1:110.75,4:10.5,2n:n
33
SFe
==
−−
⇒
công th
ứ
c FeS
1,9
3.
G
ọ
i s
ố
mol FeS
2
và FeS l
ầ
n l
ượ
t là x và y ta có:
=
=
⇒
=+
=+
−
−
−
−
3
3
3
3
10.25,0y
10.25,2x
10.75,4yx2
10.5,2yx
g88,216010.25,0
2
9
10.25,2
2
15
m
33
Br
2
=×
×+×=
−−
2,00
(0,50
×
4)
1,00
1,00













![Truyện tranh Gấu Trúc Thích Vẽ [Mới Nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250726/TVSDLibK12/135x160/954_gau-truc-thich-ve.jpg)


![Truyện tranh Hươu cao cổ bị cận thị [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250725/TVSDLibK12/135x160/97_truyen-tranh-huou-cao-co-bi-can-thi.jpg)
![Vui học cùng bé: Tìm và nối chữ [Hướng dẫn chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250725/thuthao00/135x160/971_vui-hoc-cung-be-tim-va-noi-chu.jpg)



![Trò chơi săn chữ: Khám phá chữ cái [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250725/thuthao00/135x160/66711753416654.jpg)


![Tập viết các nét cơ bản [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250724/kimanh00/135x160/80_tap-viet-cac-net-co-ban.jpg)
