
Kin thc hóa hc c bn Biên son: Võ Hng Thái
1
MT S KHÁI NIM VÀ KIN THC C BN HÓA HC (2)
20. Thù hình (Allotropy, Allotrope)
Thù hình (allotropy) là hin tưng mt nguyên t hóa hc hin din các dng n cht khác
nhau. Các n cht khác nhau ca mt nguyên t ưc gi là các dng thù hình (allotrope).
Thí d: Oxi (O2), ozon (O3), tetraoxi (O4) là ba dng thù hình ca nguyên t oxi (oxigen,
oxygen, O). Photpho trng, photpho , photpho en là ba dng thù hình ca nguyên t
photpho (phosphor, phosphorus, P). Graphit (than chì), kim cưng, m hóng (b hóng, l
ngh, than vô nh hình), fuleren (fullerene, C60) là bn dng thù ca nguyên t cacbon
(carbon, C). Nguyên t lưu hunh (sulphur, S) có nhiu dng thù hình nht, khong 30 dng
thù hình, như S8; S7; S6; S12; S18; ....
21. a hình (Polymorphy, Polymorphous, Polymorphism)
a hình là hin tưng mt cht rn hin din các dng tinh th khác nhau. Các tinh th khác
nhau ca mt cht ưc gi là các dng a hình (polymorphs: dimorphs, trimorphs,
tetramorphs,...Có th dch là nh hình, tam hình, t hình,...). S bin i gia dng a hình
này thành dng a hình khác ưc gi là s chuyn hóa a hình (polymorphic transformation)
Thí d: Canxi cacbonat (carbonat calcium, CaCO3) có hai dng a hình là calcit (calcite) và
aragonit (aragonite). Titan ioxit (dioxid titan, TiO2) có ba dng a hình là brookit (brookite),
anatas (anatase) và rutil (rutile). Kim loi st (Fe) có các dng a hình (thù hình) là Fe- (ferit,
ferrite); Fe- (austenit, austenite); Fe-. Photpho (phosphor, P) có các dng a hình (thù hình)
là photpho trng, photpho và photpho en.
Như v y a hình là s hin din các tinh th khác nhau ca cùng mt cht rn (c hp cht
l!n n cht, nu là n cht rn thì a hình c"ng là thù hình)
22. Hn hng (Amalgam)
H#n hng là hp kim ca thy ngân (Hg) v$i kim loi khác. Thy ngân là kim loi duy nht
hin din dng lng iu kin thư%ng. Thy ngân hòa tan ưc rt nhiu kim loi to h#n
hng. Tùy thuc vào t& l gia thy ngân và bt kim loi em phi trn mà h#n hng thu ưc
có th dng lng, st (nhão) hay rn. H#n hng có th dùng làm cht kh' (h#n hng natri),
dùng làm in cc, dùng trong s phân kim (tách vàng, bc)...
(c bit h#n hng ưc dùng làm v t liu trám r)ng. Ngư%i ta ly h#n hp bt kim loi gm:
69,4% Ag (bc), 3,6% Cu (ng), 26,2% Sn (thic), 0,8% Zn (k*m) (ph+n tr)m khi lưng)
em hòa tan trong thy ngân (Hg) to h#n hng dùng làm trám r)ng. Thy ngân chim
khong 42-45% khi lưng h#n hng này. Lúc +u h#n hng dng st nên ưc nhét vào l#
trng ca r)ng c+n trám. Th%i gian ngn sau, v t liu này ông cng li. Hin có nhiu tranh
lu n v vic dùng h#n hng trám r)ng, vì thy ngân là cht c i v$i th+n kinh. Tuy
nhiên theo các nha s,, h#n hng có an toàn cao, có l* thy ngân b gi ch(t trong hp kim
v$i các kim loi nên không gây c hi áng k. Và trong thc t ngư%i ta ã dùng phưng
pháp trám r)ng này t- lâu (t- gia th k. 19 n hin nay)
Trong khai thác nh l/, ngư%i ta dùng thy ngân gi ly vàng có l!n trong qu(ng, sau ó
em chưng ct thu ưc vàng có hàm lưng cao hn.
23. ng lng. ng lng gam (Equivalent weight. Gram equivalent weight)

Kin thc hóa hc c bn Biên son: Võ Hng Thái
2
ng lng ca mt cht là s ph+n khi lưng ca cht ó có th thay th hay phn ng
v-a v$i 1 ph+n khi lưng hiro (hidrogen, hydrogen, H) hay 8 ph+n khi lưng oxi
(oxigen, oxygen, O).
H2 + 1/2O2 → H2O
2g 16g
1g 8g
H = 1; O = 8
CuO + H2 →
0
t Cu + H2O
80g 2g
40g 1g => CuO = 40
2Al + 3/2O2 → Al2O3
54g 48g
9g 8g => Al = 9
Fe + 2HCl → FeCl2 + H20
56g 2g
28g 1g => Fe = 28
(28 ph+n kl Fe ã thay th 1 ph+n kl H, trong HCl, nên ưng lưng ca Fe trong phn
ng này là 28)
Na + CH3COOH → CH3COONa + 1/2H20
23g 1g => Na = 23
ng lng gam ca mt cht là khi lưng tính b1ng gam ca cht ó mà có s ch& b1ng
s ch& ưng lưng ca nó. ây là khi lưng tính b1ng gam ca cht ó có th phn ng hay
thay th v-a v$i 1 gam H hay 8 gam O.
Như v y khái nim ưng lưng v$i ưng lưng gam c"ng ging như khái nim nguyên t'
lưng, phân t' lưng v$i nguyên t' gam, phân t' gam. Và do ó 1 ưng lưng gam mt cht
có th thay th hay phn ng v-a v$i 1 mol H (1 nguyên t' gam H) hay 0,5 mol O (0,5
nguyên t' gam O).
Thí d:
H = 1 => ưng lưng gam ca H (lgH) = 1 gam
O = 8 => lgO = 8 g (8 g O phn ng v-a v$i 1 g H. Hay 1 lg O phn ng v-a
v$i 1 lg H. Hay 0,5 mol O phn ng v-a v$i 1 mol H)
Al = 9 => lgAl = 9 g (9 g Al phn ng v-a v$i 1 g H hay 8 g O. Hay 1 lg Al
phn ng v-a v$i 1 lg H hay 1 lg O. Hay 1 lg Al phn
ng v-a v$i 1 mol H hay 0,5 mol O)
CuO = 40 => lgCuO = 40 g (40 g CuO phn ng v-a v$i 1 g H. Hay 1 lg CuO
phn ng v-a v$i 1 lg H)
S liên h gia ng lng vi khi lng nguyên t, khi lng phân t (S liên h
gia ng lng gam vi khi lng mol nguyên t, khi lng mol phân t)
A =
A
A
n
M
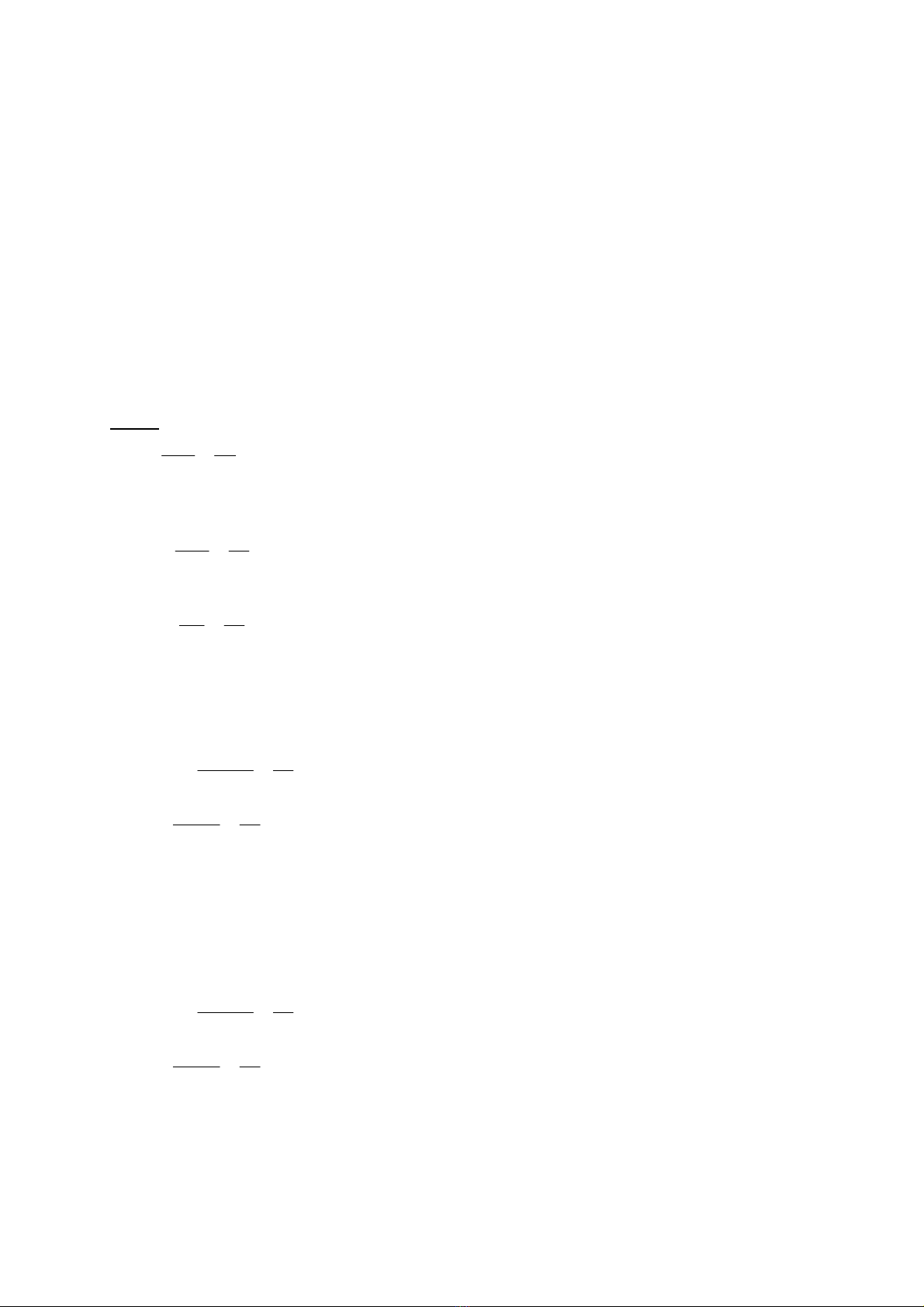
Kin thc hóa hc c bn Biên son: Võ Hng Thái
3
A: ưng lưng (ưng lưng gam) ca cht A
MA: Khi lưng nguyên t', khi lưng phân t' (khi lưng mol nguyên t', khi lưng mol
phân t', nguyên t' gam, phân t' gam) ca A
nA: - Hóa tr ca A (nu A là kim loi)
- B1ng s ion H+ mà mt phân t' axit (acid) ã tham gia phn ng (trao i)
- B1ng s ion OH- mà mt phân t' baz (baz, base) ã tham gia phn ng (trao i)
- B1ng s in t' mà mt phân t' cht oxi hóa ã nh n
- B1ng s in t' mà mt phân t' cht kh' ã cho
- B1ng s in tích âm hay s in tích dưng mà mt phân t' mui, oxit (oxid, oxide)
kim loi, axit (acid), baz (baz, base) ã tham gia trao i (phn ng)
- Nói chung 1 phân t' A có cha nA ưng lưng A hay 1 mol (1 nguyên t' gam, 1
phân t' gam) A có cha nA ưng lưng gam A
Thí d:
Al = 3
27
=
Al
Al
n
M= 9 (ưng lưng ca nhôm b1ng 9; ưng lưng gam ca nhôm b1ng 9
gam; 1 nguyên t' Al có cha 3 ưng lưng Al; 1 mol Al có cha 3 ưng lưng gam Al)
Fe(II) = 2
56
=
Fe
Fe
n
M= 28 (ưng lưng ca st (II) b1ng 28; ưng lưng gam ca Fe(II) b1ng
28 g)
Fe(III) = 3
56
=
Fe
n
Fe = 18,67 (ưng lưng ca st (III) b1ng 18,67; lgFe(III) = 18,67 g)
H2SO4 + 2KOH → K2SO4 + 2H2O
1 mol 2 mol
2 lg 2 lg
42SOH = 49
2
98
42
42 ==
SOH
SOH
n
M (1 mol H2SO4 trong phn ng này có cha 2 lg H2SO4)
KOH = 56
1
56 ==
KOH
KOH
n
M (1 mol KOH có cha 1 lg KOH)
Như v y theo phn ng trên 1 mol H2SO4 phn ng v-a v$i 2 mol KOH; 2 lg H2SO4
phn ng v-a v$i 2 lg KOH
H2SO4 + KOH → KHSO4 + H2O
1 mol 1 mol
1 lg 1 lg
42SOH = 98
1
98
42
42 ==
SOH
SOH
n
M (1 mol H2SO4 trong phn ng này có cha 1 lg H2SO4)
KOH = 56
1
56 ==
KOH
KOH
n
M (1 mol KOH có cha 1 lg KOH)
Như v y theo phn ng trên 1 mol H2SO4 phn ng v-a v$i 1 mol KOH; 1 lg H2SO4
phn ng v-a v$i 1 lg KOH

Kin thc hóa hc c bn Biên son: Võ Hng Thái
4
+7 +2 +2 +3
2KMnO4 + 10FeSO4 + 8H2SO4 → 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
Cht oxi hóa Cht kh' Môi trư%ng
2 mol 10 mol
10 lg 10 lg
+7 +2
KMnO4 + 5e- → Mn2+ (1 phân t' cht oxi hóa KMnO4 nh n 5 in t')
+2 +3
Fe2+ - 1e- → Fe3+ (1 phân t' cht kh' FeSO4 cho 1 in t')
KMnO4 = 6,31
5
158
4
4==
KMnO
KMnO
n
M (ưng lưng ca KMnO4 trong phn ng này b1ng 31,6. 1
mol KMnO4 có cha 5 lg cht oxi hóa KMnO4; 1 phân t' KMnO4 nh n 5 in t'; 1 mol cht
oxi hóa KMnO4 nh n 5 mol in t')
FeSO4 = 1
152
4
4=
FeSO
FeSO
n
M= 152 (ưng lưng ca FeSO4 trong phn ng này b1ng 152. ưng
lưng gam ca FeSO4 b1ng 152 gam. 1 phân t' FeSO4 cha 1 ưng lưng kh' FeSO4. 1 mol
FeSO4 cha 1 ưng lưng gam kh' FeSO4. 1 mol cht kh' FeSO4 cho 1 mol in t')
+2 0 +2,5 -1
2Na2S2O3 + I2 → Na2S4O6 + 2NaI
Natri hiposunfit Iot (Iod) Natri tertrationat Natri ioua (Iodur natrium)
2 mol 1 mol
2 lg 2 lg
+2 +2,5
2S - 1e- → 2S (1 phân t' Na2S2O3, cha 2 nguyên t' S, ã cho 1 in t')
0 -1
I2 + 2e- → 2I (1 phân t' I2 ã nh n 2 in t')
Na2S2O3 = 1
158
322
322 =
OSNa
OSNa
n
M= 158 (1 mol Na2S2O3 cha 1 ưng lưng gam Na2S2O3)
I2 = 2
254
2
2=
I
MI= 127 (1 mol I2 cha 2 ưng lưng gam I2)
+3 -1 +2 0
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
2 mol 2 mol
2 lg 2 lg
+3 +2
Fe3+ + 1e- → Fe2+ (1 phân t' FeCl3 nh n 1 in t')
-1 0
I- - 1e- → I (1 phân t' KI cho 1 in t')
FeCl3 = 1
5,162
3
3=
FeCl
FeCl
n
M= 162,5 (1 mol FeCl3 cha 1 ưng lưng gam oxi hóa FeCl3)
KI = 1
166
=
KI
KI
n
M= 166 (1mol KI cha 1 ưng lưng gam kh' KI)

Kin thc hóa hc c bn Biên son: Võ Hng Thái
5
BaCl2(dd) + K2SO4(dd) → BaSO42 + 2KCl(dd)
1 mol 1 mol
2 lg 2 lg
BaCl2 =2
208
2
2=
BaCl
BaCl
n
M= 104 (phân t' BaCl2 có cha 2 in tích dưng, c"ng như 2 in tích
âm, tham gia trao i. Ba2+ 2Cl-, 1 mol BaCl2 có cha 2 ưng lưng gam BaCl2)
K2SO4 = 2
174
42
42 =
SOK
SOK
n
M= 87 (1 phân t' K2SO4 cha 2 in tích dưng, c"ng như 2 in tích
âm, tham gia trao i. 2K+ SO42-, 1 mol K2SO4 có cha 2 ưng lưng gam K2SO4)
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
1 mol 3 mol
6 lg 6 lg
Al2O3 = 6
102
32
32 =
OAl
OAl
n
M= 17 (2Al3+ 3O2-, 1 mol Al2O3 cha 6 ưng lưng gam Al2O3)
H2SO4 =2
98
42
42 =
SOH
SOH
n
M= 49 (2H+ SO42-, 1 mol H2SO4 cha 2 ưng lưng gam H2SO4)
Qua các thí d trên, ta nh n thy hai cht A, B tham gia phn ng v-a v$i nhau thì có cha
s ưng lưng (hay s ưng lưng gam) b1ng nhau. ây chính là ni dung ca nh lu t
ưng lưng.
nh lut ng lng: Các cht phn ng, thay th, kt hp v-a v$i nhau thì có cha s
ưng lưng b1ng nhau.
Nu VA lít dung dch cht tan A có nng ưng lưng CA (trong 1 lít dung dch này có
cha CA ưng lưng gam A) phn ng v-a v$i VB lít dung dch cht tan B có nng
ưng lưng CB (trong 1 lít dung dch này có cha CB ưng lưng gam B) thì theo nh lu t
ưng lưng, s ưng lưng gam ca A và B trong hai th tích trên b1ng nhau:
CAVA = CBVB
Trong công thc trên, CA, CB biu di3n b1ng nng ưng lưng (N, nguyên chu4n,
normality, biu th s ưng lưng gam cht tan có trong 1 lít dung dch, lg/L). Còn VA, VB
biu di3n b1ng bt c n v th tích nào c"ng ưc, mi3n là phi cùng mt n v th tích.
Công thc này thư%ng dùng trong s nh phân, xác nh nng ca mt dung dch khi
bit nng ca dung dch ca cht phn ng v$i nó và bit th tích các dung dch phn ng
v-a (trong 4 s hng, bit ưc 3 s hng kia thì s* tính ưc s hng còn li).
Nôm na ca nh lu t ưng lưng là: nu là phn ng oxi hóa kh', khi hai cht kh' và cht
oxi hóa phn ng v-a v$i nhau thì s mol in t' mà cht kh' cho b1ng v$i s mol in t'
mà cht oxi hóa nh n. Nu là phn ng trung hòa gia mt axit v$i mt baz, khi trung hòa
v-a thì s mol ion H+ ca axit b1ng s mol ion OH- ca baz (kt hp v-a to cht
không in ly H2O). Nu là phn ng trao i gia các mui, baz, axit khi thay th (phn
ng) v-a thì s mol in tích dưng ca ion dưng b1ng s mol in tích âm ca ion âm
(kt hp v-a to ra phân t' trung hòa in tích, kt hp v-a to ra cht kt ta,
tr+m hin, cht d3 bay hi, cht không in ly hay cht in ly yu hn).







![Tính chất hóa học chung của các chất Vô cơ [chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2016/20161006/bins100/135x160/9881475804057.jpg)


















