
85
Từ kết quả trên hình 15, người ta rút ra một nhận xét rằng: nói chung, nhiệt độ tự bốc
cháy càng cao nếu như áp suất của hỗn hợp cháy càng thấp. Song đường cong có một số
đặc trưng. Thật vậy, đối với nhiều hiđrocacbon người ta quan sát thấy rằng ở một áp suất
đã cho đủ cao P có ba nhiệt độ tới hạn của sự tự bốc cháy T1, T2, T3. Chính trong vùng áp
suất và nhiệt độ này tạo nên cái gọi là ngọn lửa lạnh. ở những áp suất đủ yếu, đường cong
tách vùng nổ khỏi vùng phản ứng chậm và có một vùng được gọi là vùng tự bốc cháy với
thời hạn dài (autoinflamation à longs détailles). Đặc biệt trong vùng này, ở một nhiệt độ
T đã cho, có ba áp suất tới hạn của sự tự bốc cháy P1, P2, P3.
Ta hãy nghiên cứu một hỗn hợp nổ được đưa tức thời tới nhiệt độ tự bốc cháy của nó,
thậm chí ngay ở nhiệt độ cao hơn một cách rõ ràng thì sự tự bốc cháy sẽ không xảy ra ngay
mà phải sau một khoảng thời gian nào đó. Khoảng thời gian tự bốc cháy này càng ngắn khi
nhiệt độ càng cao và việc tồn tại thời hạn tự bốc cháy là do cần phải đạt được một nồng độ
gốc tự do để cho phản ứng oxi hoá có thể tự bùng lên hay tự bốc cháy.
Nhiệt độ tự bốc cháy và thời hạn tự bốc cháy là những thông số quan trọng trong sự
nổ. Ví dụ, việc biết nhiệt độ tự bốc cháy là rất quan trọng trong lĩnh vực an toàn khi phải
làm việc với các nhiên liệu. Thật vậy, nhiên liệu tương đối dễ bay hơi và trong quá trình
chuyển thiết bị đựng hay do nguyên nhân thất thoát có thể dễ dàng tạo nên các hỗn hợp
nổ với không khí ngay khi một vật tiếp xúc với hỗn hợp này nếu như nhiệt độ của nó cao
hơn nhiệt độ tự bốc cháy của hỗn hợp.
Bảng 33.
Nhiệt độ tự bốc cháy của các nhiên liệu (các hỗn hợp hợp thức với oxi tinh
khiết và với không khí ở áp suất khí quyển)
Nhiệt độ tự bốc cháy (°C)
Nhiên liệu
Với oxi tinh khiết Với không khí
Hiđro H2 560 570
Amoniac NH3 - 650
Oxit cacbon CO 590 630
Metan CH4 555 580
Propan C3H8 470 480
Etilen C2H4 485 520
Axetilen C2H2 295 320
n-hexan n-C6H14 - 260
n-heptan n-C7H16 - 235
n-octan C8H18 - 220
iso-octan C8H18 - 670
Benzen C6H6 - 620
Axetanđehit CH3CHO 150 230
Đietylete (C2H5)2O 180 190
86
Axit axetic CH3COOH - 575
Axeton CH3COCH3 - 560
Sunfuacacbon CS2 - 130
Metylclorua CH3Cl 605 650
Etylclorua C2H5Cl 470 505
Một ví dụ khác, nhiều tổng hợp hoá học công nghiệp được thực hiện trong các lò phản
ứng lớn mà ở đó những chất tham gia phản ứng có thể tạo nên hỗn hợp nổ. Những lò phản
ứng này là nơi của những phản ứng chậm phát nhiệt cho nên rất quan trọng, phải có các
biện pháp ngăn ngừa tỉ mỉ như lấy nhiệt được giải phóng ra từ phản ứng, loại nhiệt của lò
phản ứng để nó không đạt được nhiệt độ tới hạn của sự tự bốc cháy. Ta thấy ở bảng 33, các
nhiên liệu cho động cơ như các C6 hay C8 có nhiệt độ tự bốc cháy trong không khí từ 230 ÷
260°C. Thế mà chỉ việc tiếp xúc với thành xilanh cũng đủ để đưa hỗn hợp này đến khoảng
230°C và nhiệt độ này còn tăng lên khi pittong nén khí tăng lên.
Thời hạn chậm nổ là một thông số rất quan trọng. Ví dụ, trong động cơ điezen người ta
phun gazoin vào xilanh sau khi đã nén không khí làm cho nhiệt độ tăng lên trên nhiệt độ tự
bốc cháy. Nếu thời hạn tự bốc cháy tương ứng với chế độ của động cơ, nghĩa là thời gian
kéo dài 1 vòng nén thì sự tự bốc cháy xảy ra. Ngược lại, nếu thời hạn quá dài, hỗn hợp
không thể nổ trước khi giai đoạn giảm áp bắt đầu thì nhiên liệu bị thải ra khỏi xilanh và
không bị đốt cháy.
Trong động cơ xăng, người ta tạo nên một tia lửa điện đốt cháy hỗn hợp nhiên liệu -
không khí. Từ điểm bắt cháy, ngọn lửa được truyền đi và đốt cháy nhiên liệu trên đường
truyền của nó. Sự truyền này đòi hỏi một thời gian nhất định trong đó nhiệt độ của phần
chưa bị cháy tăng lên liên tục do sự tăng liên tục của áp suất do sản phẩm cháy tạo ra. Phần
này của hỗn hợp nằm ngay trong các điều kiện nổ. Và nó sẽ nổ sau một thời hạn có thể là
tương đối ngắn làm xuất hiện các sóng áp suất có hại cho động cơ. Hiện tượng này được
gọi là tiếng “lách cách” kim loại. Để loại hiện tượng này thì tất cả các nhiên liệu trong
xilanh phải bốc cháy, nghĩa là thời hạn tự bốc cháy phải đủ dài. Thời hạn tự bốc cháy của
nhiên liệu thường được phân loại theo chỉ số octan: một nhiên liệu càng lâu tự bốc cháy thì
chỉ số octan của nhiên liệu càng cao và ngược lại. Trong thực tế có nhiều phụ gia được
thêm vào nhiên liệu với nồng độ nhỏ đã làm tăng chỉ số octan của nhiên liệu lên hàng chục
đơn vị.
5.3.1 Xác định nhiệt độ tự bốc cháy
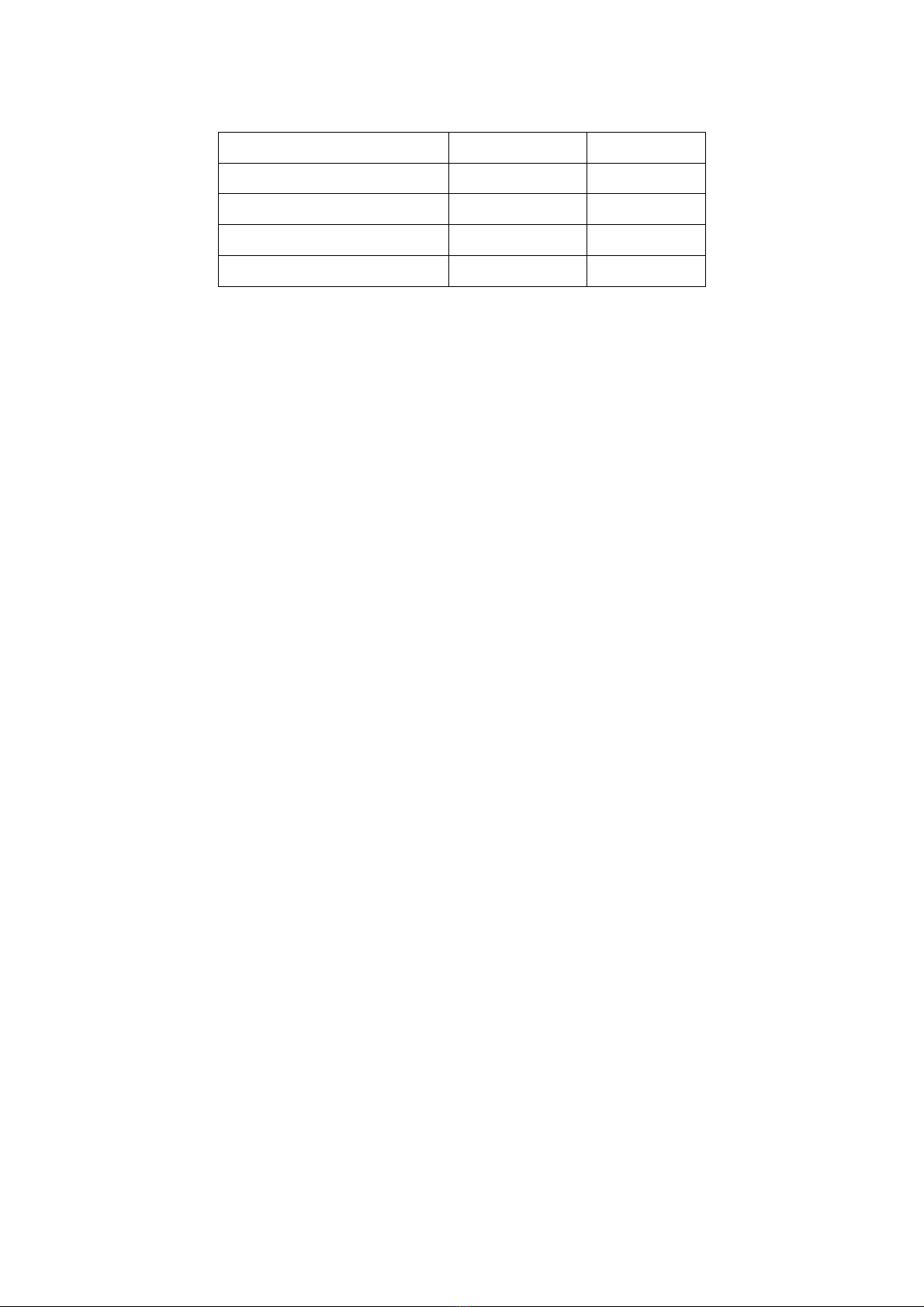
Phương pháp phổ biến nhất để đo nhiệt độ tự bốc cháy của nhiên liệu là phương pháp
hoả kế. Hoả kế được chế tạo rất đơn giản, gồm một lò phản ứng được đặt trong một lò
điện. Sau khi đã làm chân không trước trong lò phản ứng và nhiệt độ trong lò phản ứng
phải đồng đều, người ta đưa hỗn hợp nhiên liệu và không khí vào trong đó. Nếu nhiệt độ
đủ cao, sự tự bốc cháy sẽ xảy ra khi đưa hỗn hợp vào sau một khoảng thời gian nhất định.
Sự tự bốc cháy được xác định hoặc bằng sự tăng lên đột ngột về nhiệt độ hay áp suất, hoặc
bằng sự xuất hiện một quá trình phát quang hóa học. Tùy theo từng trường hợp, bộ phận
phát hiện sẽ hoặc là một cặp nhiệt điện hay một áp kế rất nhạy, hoặc là một tế bào quang
87
điện (hình 16). Thời gian từ lúc đi vào của hỗn hợp và sự xuất hiện sự tự bốc cháy là thời
hạn tự bốc cháy.
Hình 16.
Sơ đồ nguyên lí của phương pháp hoả kế để xác định thời hạn và nhiệt độ tự bốc cháy
Hỗn hợp nhiên liệu và không khí được trộn trước, cho vào bình chứa (c). Lò phản ứng
(a) được đưa tới nhiệt độ mong muốn nhờ lò đốt nóng bằng điện (b). Sau khi hỗn hợp được
đưa vào đó qua khoá (d). Sự tự bốc cháy được phát hiện bằng một nhiệt kế điện trở G, hay
bằng một áp kế (f) hay bằng 1 tế bào quang điện (e).
Một phương pháp khác thường xuyên được sử dụng để xác định nhiệt độ tự bốc cháy
của nhiên liệu lỏng là đưa một giọt nhiên liệu lỏng vào trong một chén nung bị đốt nóng ở
nhiệt độ đã biết. Chén nung có chứa chất duy trì sự cháy. Bất tiện của phương pháp này là
người ta không biết thành phần của hỗn hợp nổ. Thật vậy, sự hoá hơi của giọt nhiên liệu
tiếp theo sự khuếch tán của hơi trong chất duy trì sự cháy làm xuất hiện những gradient
nồng độ rất khó biết.
Còn về các phương pháp xác định thời hạn tự bốc cháy, tất cả các phương pháp
này đều cùng phải giải quyết một vấn đề: làm thế nào để đưa ngay tức thời và đồng
nhất một hỗn hợp nổ tới một nhiệt độ đủ cao. Trong một số trường hợp thời hạn này
có thể là vài ba phút, nhưng thông thường là một vài mili giây hoặc một vài micro
giây.
Một phương pháp khác là đốt nóng một cách riêng biệt nhiên liệu và chất duy trì sự
cháy tới nhiệt độ mong muốn, sau đó đưa chúng vào tiếp xúc với nhau. Nhưng phương
pháp này gặp phải một khó khăn liên quan tới thời gian cần thiết để làm đồng nhất hỗn
hợp tham gia phản ứng.
Trong phương pháp này cần chú ý rằng đại đa số các nhiên liệu chỉ cần được đốt nóng
trước vừa phải để tránh những phản ứng nhiệt phân làm thay đổi bản chất của chất tham
gia phản ứng.
Đối với các nhiên liệu có thời hạn tự bốc cháy trên một giây thì phương pháp hoả kế là
hoàn toàn thoả đáng. Đối với các thời hạn ngắn hơn, phương pháp hoả kế không còn giá trị
nữa bởi vì việc đưa hỗn hợp vào lò phản ứng cũng mất hàng trăm mili giây.
Những thời hạn nằm giữa mili giây và giây được đo bằng hai phương pháp khác nhau:
phương pháp thứ nhất được thực hiện trên một hỗn hợp đồng nhất, còn phương pháp thứ
hai sử dụng kỹ thuật đốt nóng sơ bộ những chất tham gia phản ứng. Trong phương pháp
thứ nhất, việc tăng nhiệt độ được thực hiện bằng cách nén đoạn nhiệt hỗn hợp đồng nhất
88
trong một xilanh. Ngược với hệ thống biên tay quay được dùng trong các động cơ ở đó tốc
độ nén giảm từ từ khi sự nén càng cao. ở đây sự chuyển động của pittong được điều chỉnh
sao cho tốc độ nén liên tục tăng lên nhằm mục đích giảm thiểu thời gian trong đó hỗn hợp
cháy nằm ở một nhiệt độ cao hơn nhiệt độ tự bốc cháy. Việc thực hiện những điều kiện này
là rất khó, đặc biệt đối với việc bất động pittong vào cuối của quá trình.
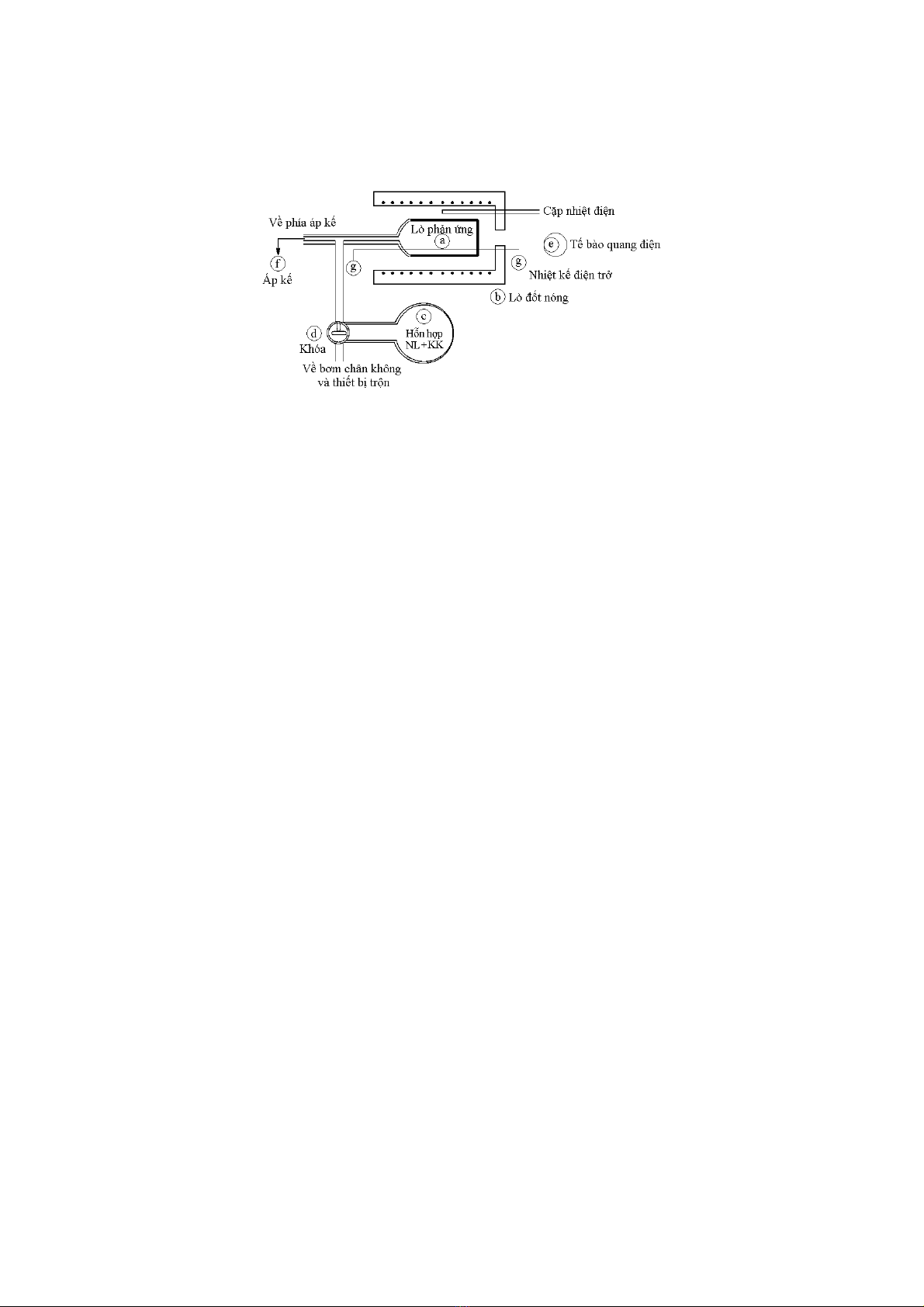
Trên sơ đồ xác định thời gian tự bốc cháy bằng phương pháp nén đoạn nhiệt (hình 17)
sự bất động của pittong thu được bằng cách truyền toàn bộ năng lượng tịnh tiến lên một hệ
thống khác gồm một pittong triệt tiêu chống lại pittong thứ nhất đến va đập vào lúc kết
thúc quá trình.
Hình 17.
Xác định thời hạn tự bốc cháy bằng phương pháp nén đoạn nhiệt
Sau khi nén, hỗn hợp đạt tới nhiệt độ T2 và áp suất P2 và chúng không thay đổi liên
quan tới nhiệt độ T1 và áp suất P1 lúc ban đầu theo định luật nén đoạn nhiệt:
1
1
2
21
2
12
1
V
V
TV
P
TV
P
γ−
γ
⎛⎞
⎜⎟ ⎛⎞
⎝⎠
==
⎜⎟
⎝⎠
trong đó V1 và V2 là các thể tích ban đầu và cuối cùng bị chiếm bởi hỗn hợp, γ là tỉ số
của các nhiệt dung riêng ở áp suất và ở thể tích không đổi.
Hỗn hợp nổ được giữ trong
buồng đốt (A) và được nén
bởi pittong B đạt tới nhiệt độ
T và một áp suất P, áp suất
này có thể đo được bằng
một bộ phận cảm biến áp
điện C. Việc nén được bắt
đầu khi nhận một khí ở một
áp suất nào đó có trong bình
chứa D ở phía trên cao của
xilanh E bằng cách mở van
F. Van này được khoá bởi
một nam châm điện G. Các
pittong H và B phải không
chuyển động do sự thay đổi
năng lượng ở thời điểm mà
phần thấp của pittong H va
vào khối triệt tiêu I khối này
bị chạy chậm lại một cách
độc lập trong xilanh triệt tiêu
J. Hỗn hợp giữ nguyên ở
nhiệt độ T và áp suất P cho
đến khi sự nổ bắt đầu. Sự
tăng đột ngột của áp suất
được phát hiện bởi biến áp
điện C và chỉ ra sự kết thúc
của thời hạn tự bốc cháy.
89
Để đo các thời hạn tự bốc cháy, người ta đặt máy biến áp điện trên các thành của
xilanh. Máy biến áp điện này sẽ vẽ trên màn hình của một máy dao động ký sự tiến triển
tín hiệu áp suất tuỳ thuộc vào thời gian; sau khi kết thúc sự nén, áp suất được giữ không
đổi sau đó tăng lên một cách đột ngột khi sự tự cháy xảy ra (hình 17). Thời gian kéo dài
đoạn thẳng ở áp suất không đổi tạo nên một phép đo trực tiếp thời hạn tự bốc cháy.
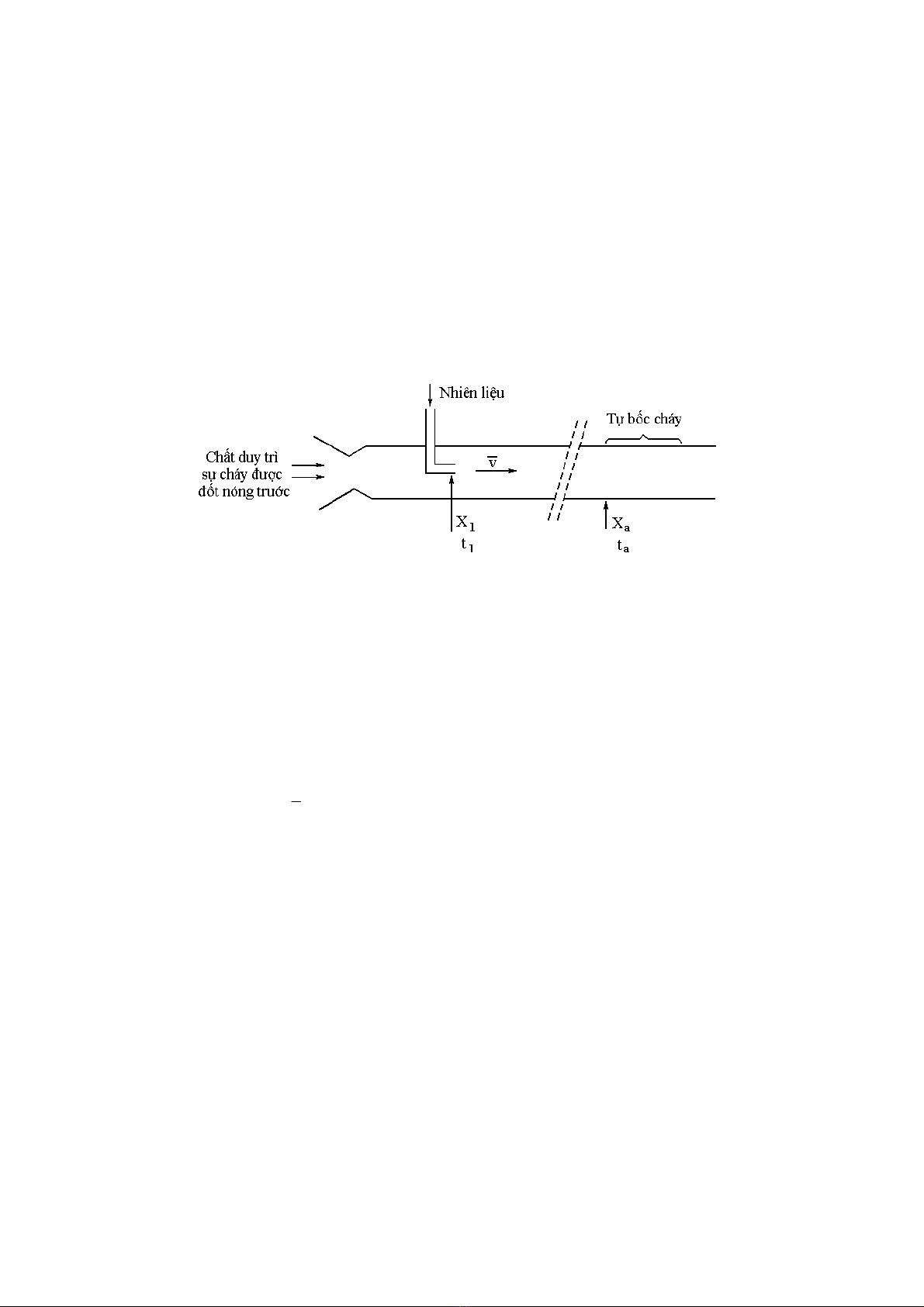
Một phương pháp khác xác định thời hạn tự bốc cháy của nhiên liệu được sơ đồ hoá
trên hình 18. Nguyên lý của phương pháp này rất đơn giản: chất duy trì sự cháy được nâng
lên nhiệt độ mong muốn qua một thiết bị trao đổi nhiệt, sau đó được đưa vào buồng đốt với
một tốc độ đã biết qua một ống dẫn trong suốt.
Hình 18.
Sơ đồ nguyên lý của phương pháp xác định thời hạn tự bốc cháy của khí
Nhiên liệu cũng được đốt nóng trước ở cùng một nhiệt độ như chất duy trì sự cháy,
nhiệt độ được chọn sao cho các phản ứng nhiệt phân của nhiên liệu là không đáng kể. Sau
đó được tiêm vào ở một thời điểm đã cho và được trộn với chất duy trì sự cháy. Sau một
thời gian nhất định (thời gian này sẽ phụ thuộc vào thời gian trộn lẫn và thời hạn tự bốc
cháy) hỗn hợp sẽ nổ và khoảng cách từ khi xuất hiện sự tự bốc cháy này đến điểm tiêm
nhiên liệu chia cho tốc độ chảy của hỗn hợp sẽ cho ta giá trị gần đúng của thời hạn tự bốc
cháy.
Thời hạn tự bốc cháy thu được bằng việc xác định vị trí của nơi xảy ra sự tự bốc cháy :
θ = ta − t1 = (xa − x1) / ν
Trong một số ứng dụng, ví dụ như trong các động cơ phản lực thẳng, thời hạn tự bốc
cháy thường rất thấp: một vài phần trăm giây hay vài chục micro giây (10−6 giây).
Để đo các đại lượng này người ta dùng phương pháp sóng va chạm. Đó là các sóng áp
suất siêu âm có thể nâng lên trong vài micro giây nhiệt độ và áp suất của khí trên đường đi
của chúng.
Những va chạm này được thực hiện trong những ống dẫn (hay ống va chạm) có chứa
hỗn hợp khí cháy. Nguyên lý đo được giải thích bằng giản đồ thời gian - khoảng cách (hình
19).


























