
Hóa Đ i c ng A2ạ ươ Ch ng 3ươ 1
Đ NG HÓA H CỘ Ọ
Đ NG HÓA H CỘ Ọ
Chemical Kinetics
Chemical Kinetics

Hóa Đ i c ng A2ạ ươ Ch ng 3ươ 2
Đ NG HÓA H CỘ Ọ
Đ NG HÓA H CỘ Ọ
•Đ ng hóa h c tìm hi u xem ộ ọ ể ph n ng x y ra ả ứ ả
nhanh ch m ra saoậ
•Có 4 y u t quan tr ng nh h ng lên v n t c:ế ố ọ ả ưở ậ ố
–N ng đ tác ch tồ ộ ấ
–nhi t đệ ộ
–h at đ c a xúc tácọ ộ ủ
–tính ch t b m t.ấ ề ặ
•M c đích: Tìm hi u các ph n ng hóa h c ụ ể ả ứ ọ ở
m c đ phân t ứ ộ ử nh mằ mô hình hoá các quá trình
trong t nhiên.ự

Hóa Đ i c ng A2ạ ươ Ch ng 3ươ 3
V n t c ph n ngậ ố ả ứ
V n t c ph n ngậ ố ả ứ
Reaction Rates
Reaction Rates
•V n t cậ ố c a m t ph n ng đ c đo b ng ủ ộ ả ứ ượ ằ bi n ế
thiên c a n ng đ theo th i gian. ủ ồ ộ ờ
•Xem ph n ngả ứ A → B
•Đây là bi u th c c a ể ứ ủ v n t c trung bìnhậ ố
∆ (n ng đ c a tác ch t A)ồ ộ ủ ấ
V nt c = -----------------------------------ậ ố ∆ (th i gian)ờ
Hóa Đ i c ng A2ạ ươ Ch ng 3ươ 4
Chemical Kinetics
Chemical Kinetics
Reaction Rates
Reaction Rates

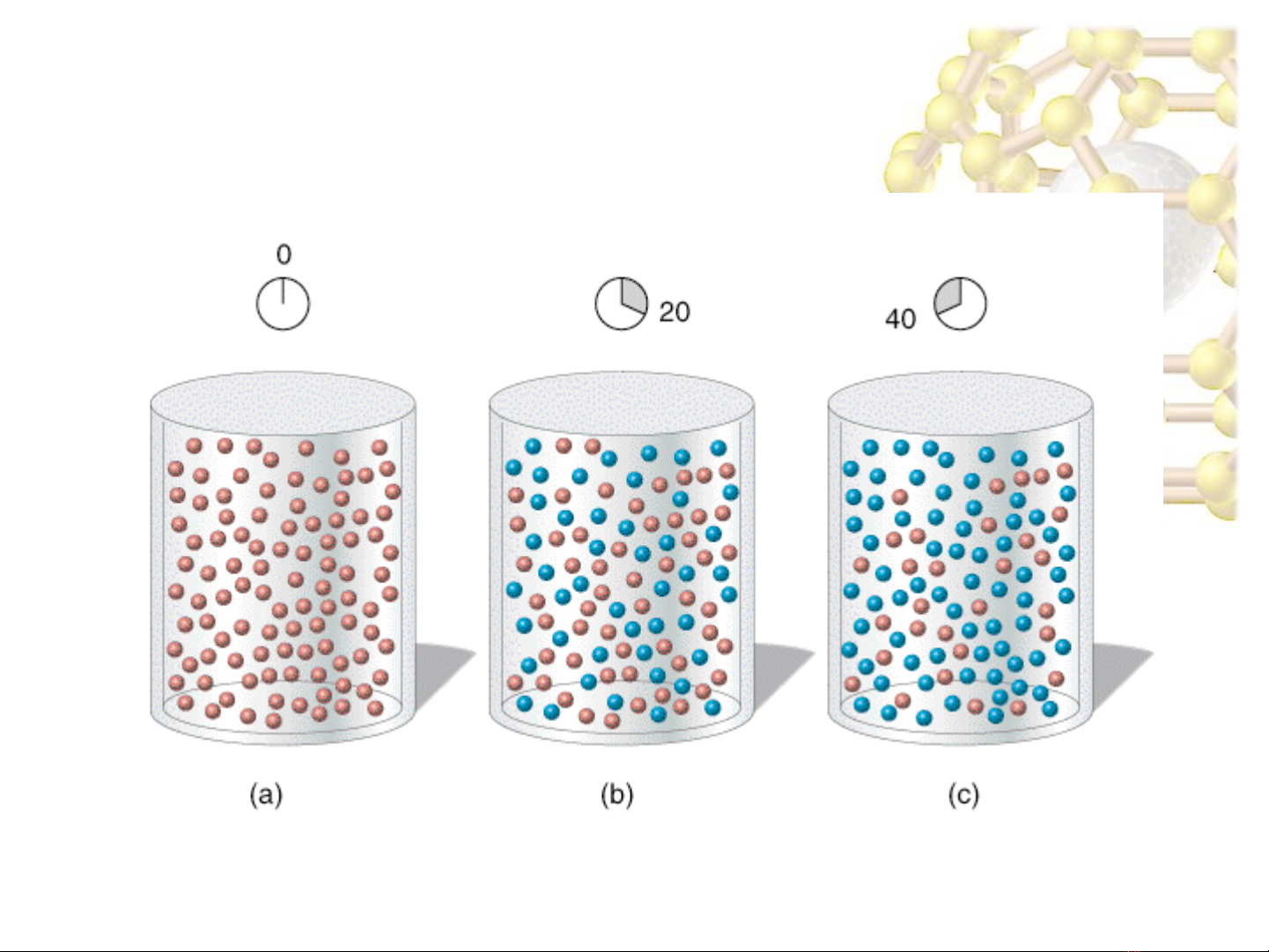
Hóa Đ i c ng A2ạ ươ Ch ng 3ươ 5
–T i ạt = 0 ( t im e z e ro ) : 1 . 0 0 m o l A ( 1 0 0
red spheres); 0.0 mol B
–T i ạt = 20 min: 0.54 mol A, 0.46 mol B.
–T i ạt = 40 min: 0.30 mol A, 0.70 mol B.
–V y:ậ
( )
( ) ( )
mol/min 026.0
min 0 -min 10
mol 0 - mol 26.0
min 0 -min 10
0at B of moles10at B of moles
B of moles
Vtb
==
=−=
=
∆
∆
=
tt
t
Vận tốc trung bình


























