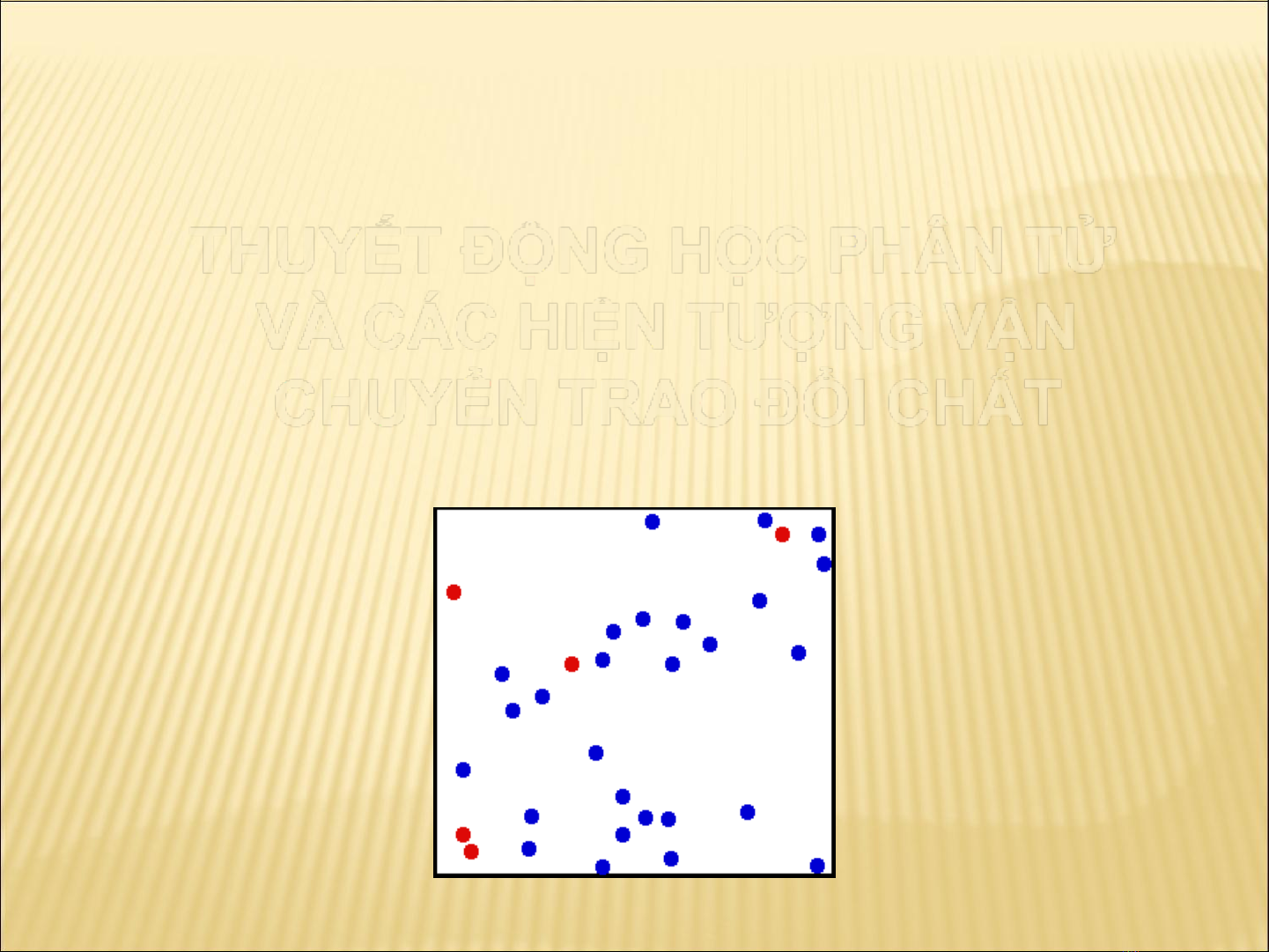
THUYẾT ĐỘNG HỌC PHÂN TỬ
VÀ CÁC HIỆN TƯỢNG VẬN
CHUYỂN TRAO ĐỔI CHẤT
• Hiểu được Thuyết động học phân tử về khí lý tưởng .Từ
phương trình cơ bản suy ra được các hệ quả của nó .
• Nắm vững ý nghĩa biểu thức nội năng của khí lý tưởng .
• Nêu được bản chất, nguyên nhân của các hiện tượng
khuếch tán, ma sát nhớt .Vận dụng để giải thích các quá
trình vận chuyển trao đổi ch
ất trong cơ thể.
• Nêu được bản chất, nguyên nhân của các trạng thái
căng mặt ngoài chất lỏng, hiện tượng mao dẫn . Vận
dụng và giải thích được một số hiện tượng liên quan
trong thực tế, đời sống và trong y học
MC TIÊU
NOÄI DUNG
THUYEÁT ÑOÄNG HOÏC PHAÂN TÖÛ VEÀ CHAÁT KHÍ
KHÍ THÖÏC
CAÙC HIEÄN TÖÔÏNG VAÄN CHUYEÅN TRONG
CHT KHÍ
TRAÏNG THAÙI CAÊNG MAËT NGOAØI CUÛA CHAÁT
LOÛNG
HIEÄN TÖÔÏNG MAO DAÃN
CAÙC HIEÄN TÖÔÏNG VAÄN CHUYEÅN TRONG
CHAÁT LOÛNG

I -THUYẾT ĐỘNG HỌC PHÂN TỬ VỀ CHẤT KHÍ
1. CÁC ĐỊNH LUẬT THỰC NGHIỆM VỀ CHẤT KHÍ
a. Các khái niệm
- Nhiệt độ: Là đại lượng vật lý đặc trưng cho mức
độ chuyển động hỗn loạn phân tử của các vật .
- Nguyên lý thứ không (zero) nhiệt động lực học
Từ thực nghiệm cho ta kết luận :
“ Khi đặt hai vật (hệ) A và B tiếp xúc với nhau và coi
hệ hai vật này là cô lập. Năng lượng E được truyền từ
vật có nhiệt độ cao (nóng hơn) sang vật có nhiệt độ
thấp,cho đến khi hai vật có nhiệt độ bằng nhau và
không trao đổi năng lượng nữa. Lúc đó, hai vật ở
trạng thái cân bằng về nhiệt ”.

(Heä coâ laäp)

![Bài giảng Vật lý đại cương và sinh lý [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250804/vijiraiya/135x160/88621754292979.jpg)


















![Bộ câu hỏi lý thuyết Vật lý đại cương 2 [chuẩn nhất/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251003/kimphuong1001/135x160/74511759476041.jpg)
![Bài giảng Vật lý đại cương Chương 4 Học viện Kỹ thuật mật mã [Chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250925/kimphuong1001/135x160/46461758790667.jpg)




