
CÔNG NGHỆ SỬ LÝ
KHÍ NOX
NHÓM 16

DANH SÁCH THÀNH VIÊN NHÓM
•PHẠM VĂN HẢO 2009120137
•HOÀNG NAM KHÁNH 2009120114
•NGUYẾN TẤN THÀNH 2009120158
•VÕ ĐÌNH QUANG 20091201
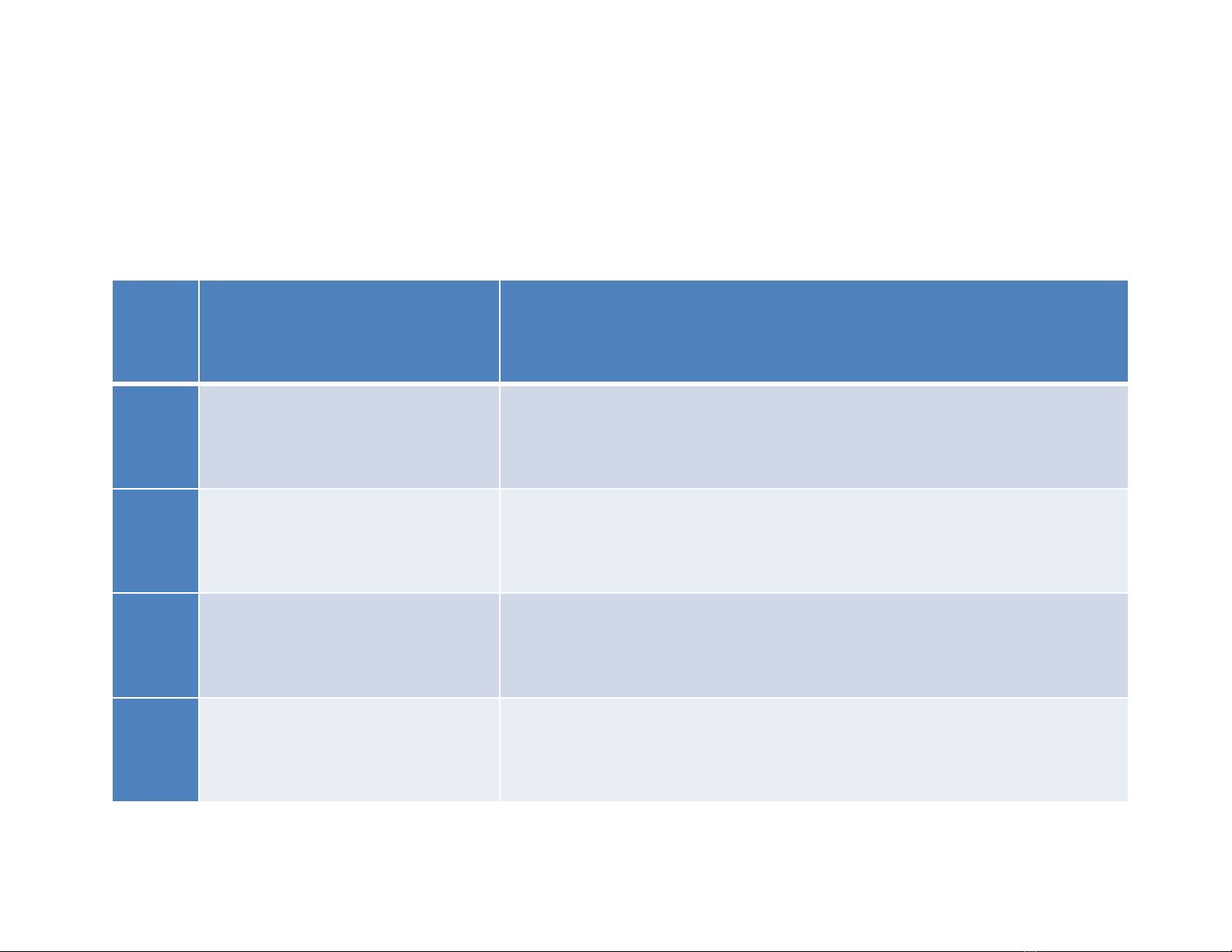
Stt
Tên thành viên Phân công công việc
1
Nguyễn Tấn Thành
Tìm tài liệu, làm Word, làm PowerPoint,
tổng hợp bài.
2Phạm Văn Hảo
Tìm tài liệu, làm Word, làm PowerPoint,
thuyết trình.
3
Hoàng Nam Khánh
Tìm tài liệu, làm Word, thuyết trình.
4Võ Đình Quang
Tìm
tài liệu, làm Word, làm
PowerPoint,
thuyết trình.

NỘI DUNG TRÌNH BÀY
NỘI DUNG TRÌNH BÀY
1•TỔNG QUAN VỀ NOX
2•PHƯƠNG PHÁP HẤP THỤ
3•PHƯƠNG PHÁP HẤP PHỤ
4•PHƯƠNG PHÁP KHỬ NOXBẰNG CHẤT XÚC TÁC
5•PHƯƠNG PHÁP XỬ LÝ KHÍ NOXBẰNG ĐIỀU CHỈNH QUÁ TRÌNH CHÁY
6•HỆ THỐNG SCR

TỔNG QUAN VỀ NOX
TỔNG QUAN VỀ NOX
• Trong 7 thông số NOX: NO, NO2,
NO3,N2O,N2O3,N2O4và N2O5, chỉ có N2O, NO,
NO2là có thể đánh giá đư ợ c lư ợ ng tạ o thành
củ a chúng trong khí quyể n. NO và NO2
thư ờ ng đi vớ i nhau và chúng có thể đặ c trư ng
và đạ i diệ n cho NOX
























![Thiết kế cung cấp điện cho tòa nhà B2 Đại học Vinh: Đồ án môn học [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251212/phanduchung10072004@gmail.com/135x160/65851765594609.jpg)

