
NHÓM 11:

I.Điện Phân
S đi n phân là quá trình oxi hóa- kh x y ra b ự ệ ử ả ở ề
m t các đi n c c khi đó dòng đi n m t chi u đi qua ặ ệ ự ệ ộ ề
ch t đi n li nóng ch y ho c dd ch t đi n li và có kèm ấ ệ ả ặ ấ ệ
theo s bi n đ i đi n năng thành hóa năngự ế ổ ệ
B n ch t c a s đi n phân:ả ấ ủ ự ệ
- Kh x y ra trên b m t đi n c c.ử ả ề ặ ệ ự
-Năng l ng dùng cho ph n ng là đi n năng dòng đi n ượ ả ứ ệ ệ
m t chi u.ộ ề
- S cho và nh n đi n t không x y ra tr c ti p gi a các ự ậ ệ ử ả ự ế ữ
ion tham gia ph n ng mà ph i truy n qua dây d n.ả ứ ả ề ẫ

- Tuy nhiên, sự phát sinh dòng điện trong pin điện
hóa và sự điện phân là hai quá trình ngược nhau.vì
vậy, dấu của điện cực là ngược nhau.
+/ Chú ý:
- v b n ch t, quan đi m v anot, catot trong pin đi n ề ả ấ ể ề ệ
hóa và trong bình đi n phân hoàn toàn gi ng nhau:ệ ố
+ Catot là n i x y s kh ơ ả ự ử
+ Anot là n i x y ra s oxi hóaơ ả ự
- Ng i ta phân bi t: đi n phân ch t đi n li nóng ch y, ườ ệ ệ ấ ệ ả
đi n phân dung d ch ch t đi n li trong n c, đi n phân ệ ị ấ ệ ướ ệ
dùng đi n c c d ng tan ệ ự ươ
+ Trong pin: Anot là cực âm, catot là cực dương
+ Trong bình điện phân: Anot là cực dương, catot là cực âm
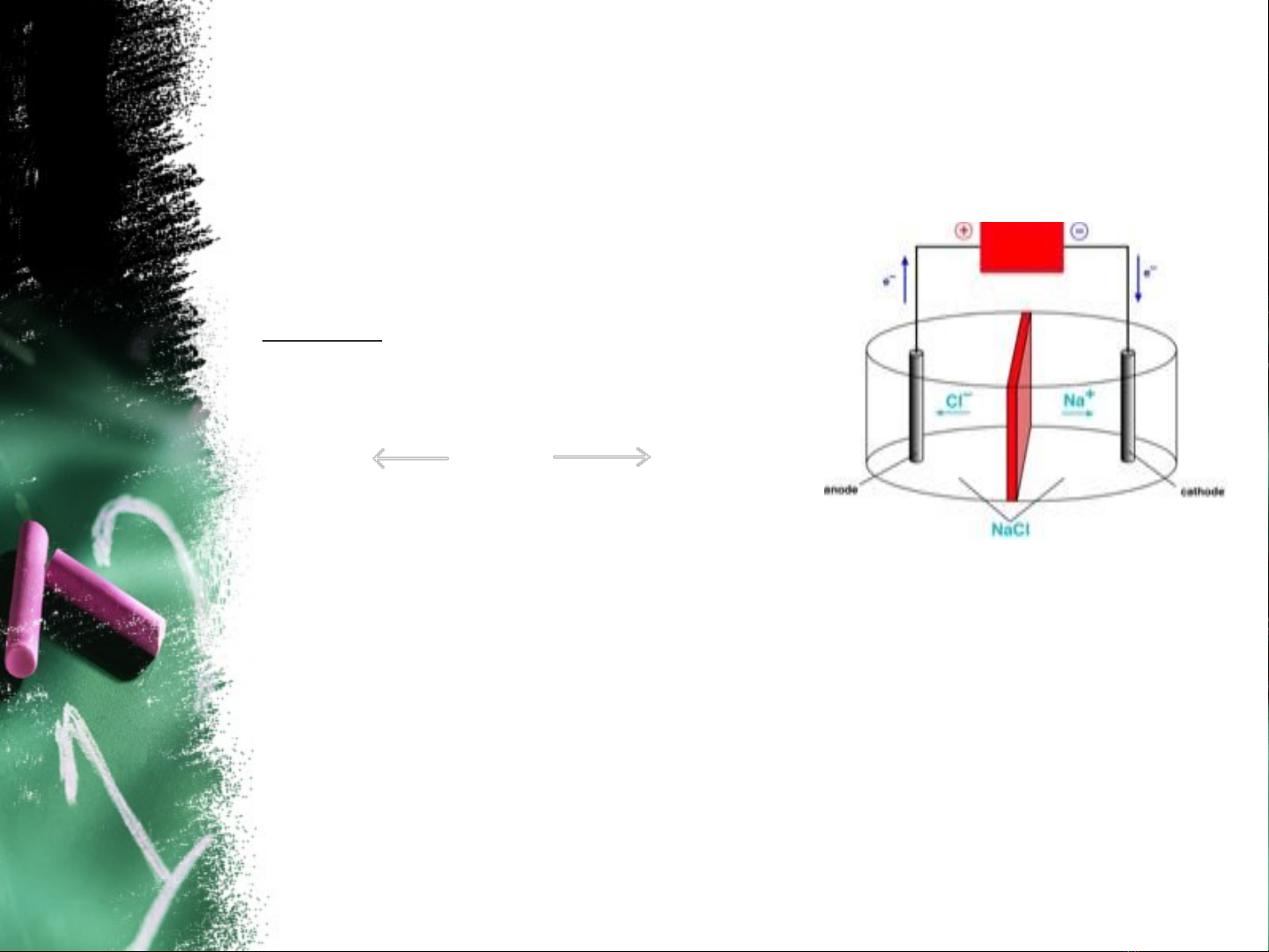
II. S Đi n Phân Các Ch t Đi nLiự ệ ấ ệ
1. Đi n phân nóng ch y:ệ ả
Ch áp d ng đi u ch các kim ỉ ụ ề ế
lo i ho t đ ng m nh nh : Na, ạ ạ ộ ạ ư
K, Ca, Ba, Al….
Ví d 1ụ: Đi n phân NaCl nóng ệ
ch y có th bi u di n b ng s đ : ả ể ể ễ ằ ơ ồ
NaCl
2 Na+ + 1e → Na | 2Cl- → Cl2 + 2e
Ph ng trình đi n phân là:ươ ệ
Catot ( – ) Anot ( + )
2Na + Cl2
2NaCl
__Cần có màng ngăn không cho Cl2 tác dụng trở lại với Na ở
trạng thái nóng chảy làm giảm hiệu suất của quá trình điện
phân. Một số chất phụ gia như NaF, KCl giúp làm giảm nhiệt độ
nóng chảy của hệ…

•Ví d 2ụ: Đi n phân NaOH nóng ch y có th bi u di n b ng ệ ả ể ể ễ ằ
s đ : ơ ồ
•Catot ( – ) NaOH Anot ( + )
•4| Na+ + 1e → Na 4OH- → O2 + 2H2O + 4e
•Ph ng trình đi n phân là: 4NaOHươ ệ 4Na + O2 + 2H2O
Ví d 3ụ: Đi n phân Alệ2O3 nóng ch y pha thêm criolit (Naả3AlF6) có
th bi u di n b ng s đ : ể ể ễ ằ ơ ồ

![Lý thuyết và bài tập Hóa học lớp 11 (KHTN) năm 2021-2022 - Trường THPT Đào Sơn Tây [Chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230310/phuogchi205/135x160/5561678432848.jpg)
























