Đáp án đ thi Duyên H i -Môn Hoá kh i 11.ề ả ố
Câu S l c cách gi iơ ượ ả Đi mể
Câu 1.
(2,0
đi mể)
nCu= 0,04 mol; nHNO3=0,24mol ; nKOH=0,21mol => nCu= nCu(NO3)2 =0,04 mol
KOH+ HNO3 -> KNO3 + H2O
x x x
2KOH + Cu(NO3)2 -> Cu(OH)2 + 2KNO3
0,08 0,04 0,04 0,08
KNO3 -> KNO2 + 1/2O2 ; Cu(OH)2-> CuO + H2O
(0,08+x) (0,08+x)
mCuO = 0,04.80 = 3,2 mol => Ch t r n g m: CuO; KNOấ ắ ồ 2; KOH dư
=> 20,76 gam ch t r n = (0,08+x).85+ 3,2 +(0,21-0,08-x).56= 20,76ấ ắ
=> x= 0,12mol -> nKOH pư=0,2mol < 0,21mol -> KOH dư -> th a mãn ỏ
nHNO3 pư=0,24 – 0,12 = 0,12mol => nH2O= ½. nHNO3 pư=0,06mol=> m H2O=1,08g
=> m khí= mCu + mHNO3 - mCu(NO3)2 - m H2O= 2,56+7,56-7,52-1,08 = 1,52g
=> mdd= 2,56+25,2-1,52=26,24g
Trong A: C%HNO3 d = 7,56/26,24=28,81%ư
C% Cu(NO3)2 = 7,52/26,24=28,66%
0,5
0,5
0,5
0,5
C âu 2 .
(2,0
đi m)ể
1.Khi ®un nãng dung dÞch NaHCO3 :
2 NaHCO3 Na2CO3 + H2O + CO2↑
a) Dung dÞch Na2CO3 lÇn lît t¸c dông víi c¸c dung dÞch:
2 Mg2+ + 2 CO32− + H2O (MgOH)2CO3↓ + CO2↑
Mg2+ + 2 CO32− + 2 H2O Mg(OH)2↓ + 2 HCO3−
Ba2+ + CO32− BaCO3↓
2 Al3+ + 3 CO32− + 3 H2O 2 Al(OH)3↓ + 3 CO2↑
2 Zn2+ + 2 CO32− + H2O (ZnOH)2CO3↓ + CO2↑
Zn2+ + 2 CO32− + 2 H2O Zn(OH)2↓ + 2 HCO3−
2 Fe3+ + 3 CO32− + 3 H2O 2 Fe(OH)3↓ + 3 CO2↑
b) Dung dÞch Na2S lÇn lît t¸c dông víi c¸c dung dÞch:
2 Mg2+ + S2− + 2 H2O Mg(OH)2↓ + H2S↑
2 Al3+ + 3 S2− + 6 H2O 2 Al(OH)3↓ + 3 H2S↑
Zn2+ + S2− ZnS↓
2 Fe3+ + 3 S2− 2 FeS↓ +
S↓
Fe3+ + 3 S2− + 3 H2O Fe(OH)3↓ + 3 HS−
c) Dung dÞch NH3 lÇn lît t¸c dông víi c¸c dung dÞch:
Mg2+ + 2 NH3 + 2 H2O Mg(OH)2↓ + 2 NH4+
Al3+ + 3 NH3 + 3 H2O Al(OH)3↓ + 3 NH4+
Zn2+ + 2 NH3 + 2 H2O Zn(OH)2↓ + 2 NH4+
Zn(OH)2 + 4 NH3 [Zn(NH3)4]2+ + 2 OH−
Fe3+ + 3 NH3 + 3 H2O Fe(OH)3↓ + 3 NH4+
0,25
0,25
0,25
2.
a.C u hình electron c a Niấ ủ 2+ : [Ar]3d8
•Xét ph c [Ni(CN)ứ4]2- :
CN- là ph i t tr ng m nh, d n đ n ion Niố ử ườ ạ ẫ ế 2+ tr ng thái kích thíchở ạ :
0,25
to
3d 4s 4p
3d8 dsp2
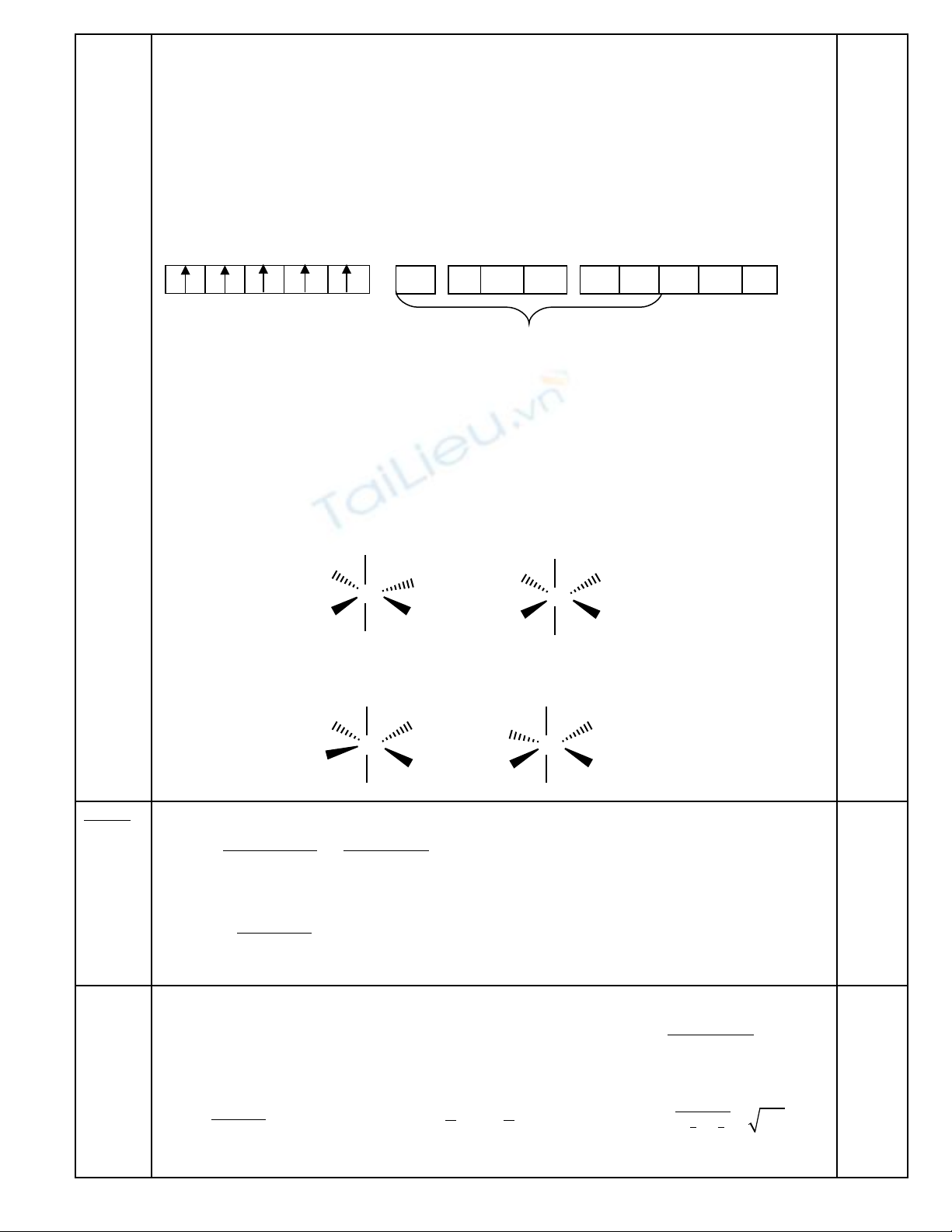
⇒ Ni2+ tr ng thái lai hóa dspở ạ 2
⇒ [Ni(CN)4]2- có d ng vuông ph ng và ion trung tâm Niạ ẳ 2+ không còn electron đ c thân,ộ
do đó ion [Ni(CN)4]2- có tính ngh ch t .ị ừ
•Xét ph c [FeFứ6]3- :
C u hình electron c a Feấ ủ 3+: [Ar]3d5
F- là ph i t tr ng y uố ử ườ ế
⇒ Fe3+ tr ng thái lai hóa spở ạ 3d2
⇒ [FeF6]3- có d ng bát di n đ u và ion trung tâm Feạ ệ ề 3+ còn 5 electron đ c thân ộ⇒ có tính
thu n t .ậ ừ
b.
- Tên c a các ion ph củ ứ :
Điclorotetraamincoban (III) : [CoCl2(NH3)4]+
Triclorotrixianocobanat (III) : [CoCl3(CN)3]3-.
- C u trúc l p thấ ậ ể :
Co
Co
Co
Co
Cl
Cl
Cl
NH
3
CN
CN
Cl
CN
NH
3
H
3
N
Cl Cl Cl Cl
H
3
N NH
3
NH
3
H
3
NClH
3
N
Cl
NC
CNNC
0,25
0,25
0,25
0,25
Câu 3
(2,0
đi mể)
1.
a) Kc =
[ ] [ ]
[ ] [ ]
2
2 2
.
.
H O CO
H CO
=
0,5 0, 425
0,6 0, 459
×
×
= 0,7716 ; Kp = Kc(RT)∆n = 0,7716 (do ∆n = 0)
b) T i CBHH: [Hạ2O] = a ; [CO] = a ; [H2] = [CO2] = 0,2 – a
Ta có :
2
2
(0, 2 )
a
a−
= 0,7716 → a = 0,094 và 0,2 – a = 0,106
Đáp s : Kc = Kp = 0,772; [Hố2] = [CO2] = 0,106 M và [H2O] = [CO] = 0,094 M.
0,5
0,5
2.
a) ∆G = –2.16,64 = –33,28 kJ/mol → ∆G0 = – RTlnKp → nKp = –
33, 28
8,314 298
−
÷
×
=13,43
V y Kp = 6,8. 10ậ5.
b)Kp=
3
2 2
2
3
.
NH
N H
P
P P
nên đ i v i ph n ngố ớ ả ứ
1
2
N2 +
3
2
H2 ⇌ NH3. có K’p =
3
2 2
1 3
2 2
.
NH
N H
P
P P
=
P
K
=
825
0,5
0,5
3d5 4s 4p 4d
Câu 4: (2,0 đi mể)
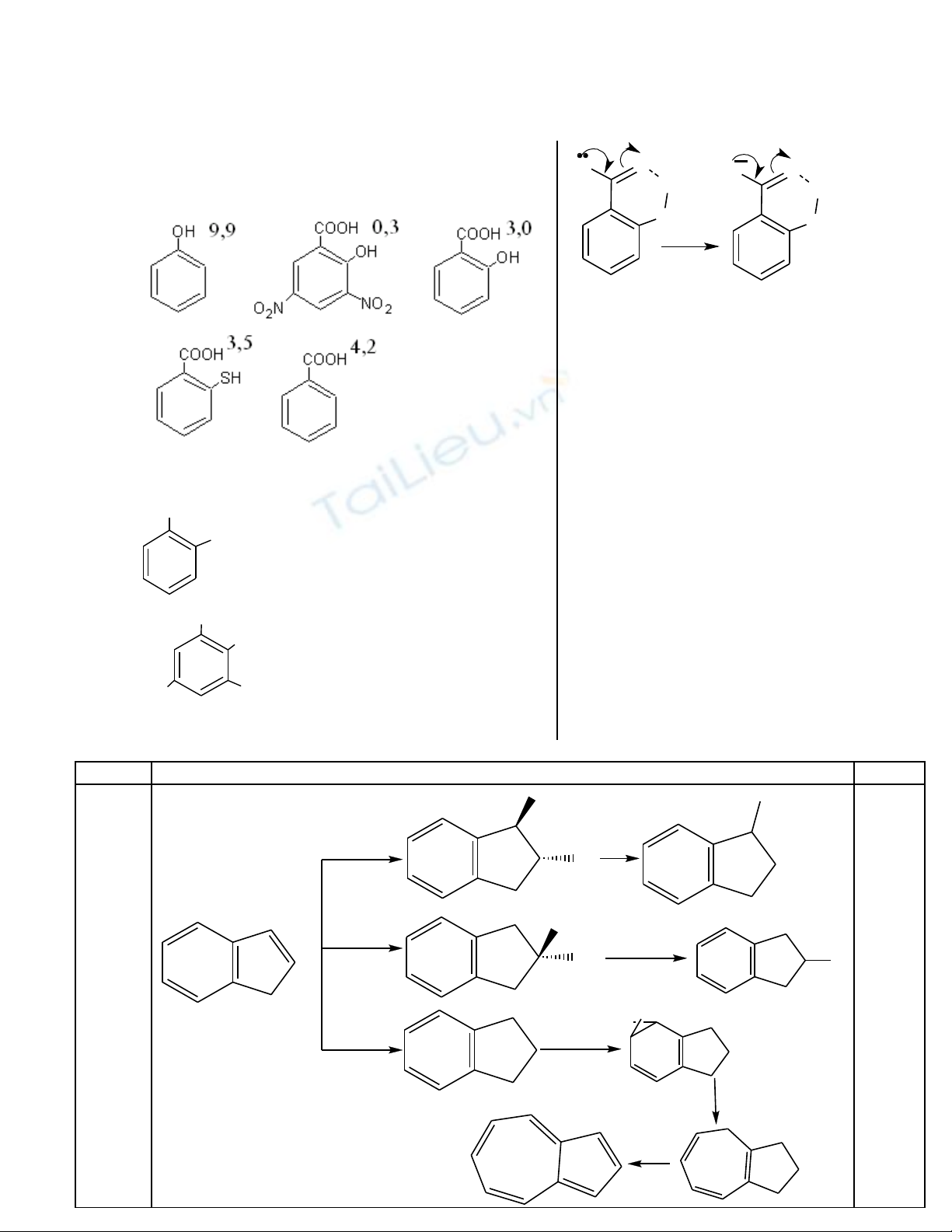
Trong các h p ch t t p ch c trên pKợ ấ ạ ứ 1 là c a nhómủ
-COOH, pK2 c a -OH và -SHủ
pK1:
pK2:
COOH
OH
3,5
13
COOH
OH
NO
2
O
2
N
7
3,0
O
H
O
OH
O
H
O
O
-
BÒn
Hi u ng Octoệ ứ
Liên k t H n i phân t làm Cacbanion sinh raế ộ ử
b n, b n h n khi có nhóm hút e vòng th mề ề ơ ở ơ
làm gi i to đi n tích âm và đ ng th i cũngả ả ệ ồ ờ
làm lk O-H trong phân c c h n.ự ơ
Lk H v i O b n h n v i S vì O âm đi n h n.ớ ề ơ ớ ệ ơ
vì lk H n i phân t ko làm H+ c a phenolộ ử ủ
không phân li đ cượ
lk H v i S ko b n = v i Oớ ề ớ
Có nhi u nhóm hút e làm lk O-H phenol phânề
c c m nhự ạ
M i ch t đúng cho 0,25. T ng s : 0,25 x 8 = 2,0 đi mỗ ấ ổ ố ể
Câu S l c cách gi iơ ượ ả Đi mể
Câu 5
(2,0
đi mể)
HOBr
B
2
H
6
H
2
/Pd CH
2
N
2
as
H
2
O
2
OH
-
OH
Br
O
H
HH
A
OH
B
raxemic
BH
2
H
CD
H
2
/Pd
E
G
Pd/t
0
H
Mõi
chát
đúng
cho
0,125
8 ch tấ
đúng =
1,0
Câu S l c cách gi iơ ượ ả Đi mể
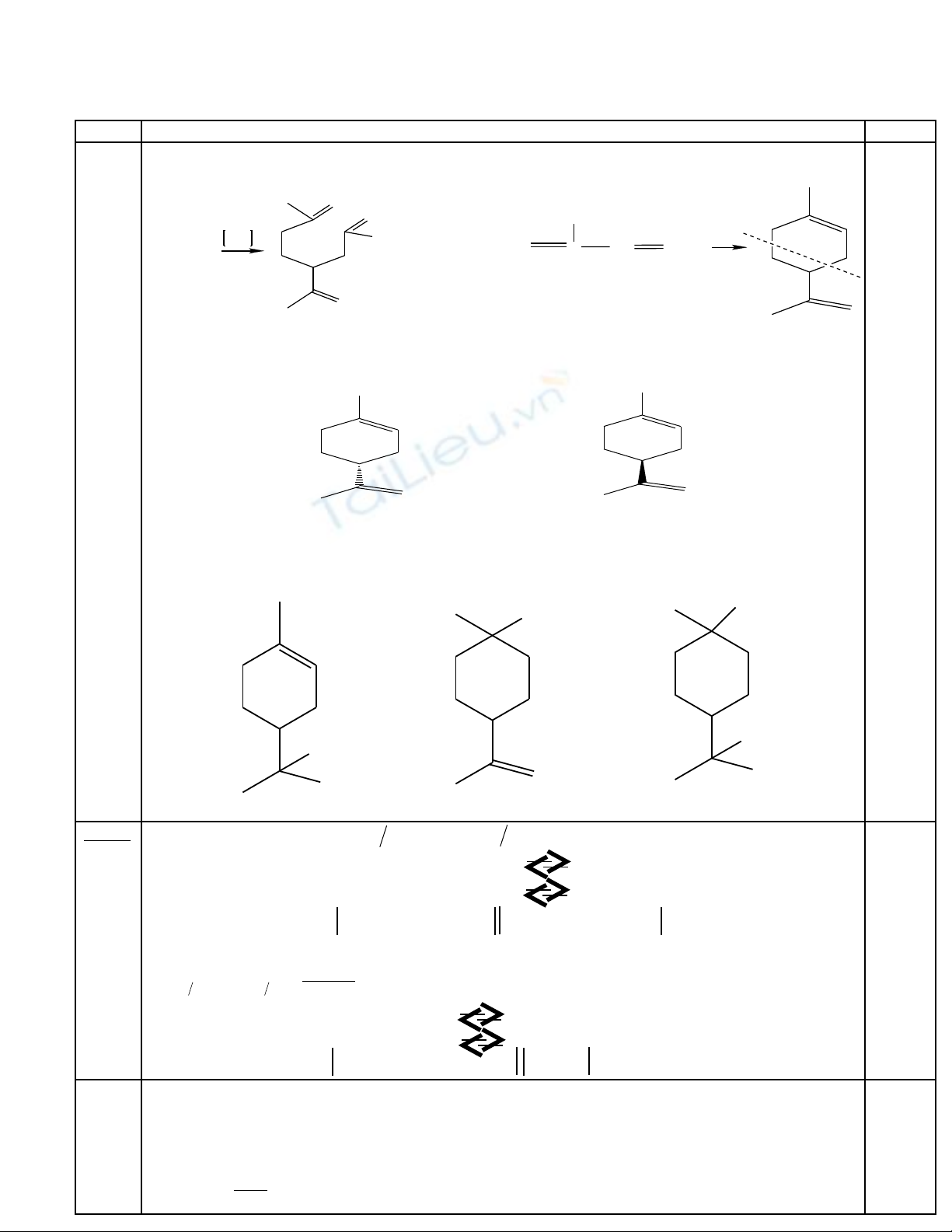
Câu 5 2.
a) C u t o c a limonenấ ạ ủ
limonen
O
O
O
OH
O
+ CO
2
2CH
2
C
CH
3
CH CH
2
. C u trúc c a các đ ng phân limonen ấ ủ ồ
vµ
c. Các s n ph m khi hiđrat hoá limonen ả ẩ
OH
OH
OH
OH
0,25
0,25
0,5
Câu 6
(2,0
đi mể)
1. a) C p oxi-hóa kh : ặ ử
+− 2
4
MnMnO
,
+− 32
72 CrOCr
Catot (+): quá trình kh : ử
eHMnO 58
2
4++ +−
OHMn 2
24+
+
Anot (-): quá trình oxi hóa:
OHCr 2
372 +
+
eHOCr 614
2
72 ++ +−
⇒
S đ pin (-) ơ ồ Pt Cr2O72-, Cr3+, H+ MnO4-, Mn2+, H+ Pt (+)
b) Ch n đi n c c làm vi c thu n ngh ch v i ion Cuọ ệ ự ệ ậ ị ớ 2+: Cu2+/Cu, [Cu(NH3)4]2+/Cu
[ ]
+
+= ++
2
log
2
0592,0
22 CuEE o
CuCuCuCu
; [Cu2+] l n ớ
⇒
E l n ớ
⇒
c c (+)ự
(+) Cu2+/Cu: Cu2+ + 2e Cu
(-) [Cu(NH3)4]2+/Cu: Cu + 4NH3 [Cu(NH3)4]2+ + 2e
⇒
S đ pin (-) Cu [Cu(NHơ ồ 3)4]2+, NH3 Cu2+ Cu (+)
0,5
0,5
2. a) Các quá trình t i các đi n c c: (-) 2Hạ ệ ự + + 2e
→
H2
(+) Co2+
→
Co3+ + 1e
Ph ng trình đi n phân: 2Hươ ệ + + Co2+
→
Co3+ + H2
b) Tinh th màu xanh là mu i Coể ố 2(SO4)2.nH2O
% mCo =
100.
2.59
M
= 16,16
⇒
M = 730
⇒
n = 18
0,5
Công th c hóa h c c a tinh th : Coứ ọ ủ ể 2(SO4)2.18H2O 0,5
Câu S l c cách gi iơ ượ ả Đi mể
Câu
7 (2
đi mể
)
a/ T i th i đi m kh o sát : ạ ờ ể ả
2 5
5
2
0,00286
N O
N O
P
CRT
= =
(M) ⇒ t c đ c a ph n ng t iố ộ ủ ả ứ ạ
th i đi m kh o sát là : ờ ể ả v = K.
2 5
5 3 8 1
1,8.10 .2,86.10 5,148.10 ( . )
N O
C M S
− − − −
= =
V y : T c đ tiêu th Nậ ố ộ ụ 2O5 : v1 = 2v = 1,0296.10-7 (M.S-1); v2 = 4v = 2,0592.10-7 (M.S-1);
v3 = 2v = 5,148.10-8 (M.S-1)
b/ S mol ban đ u c a Nố ầ ủ 2O5 là:
2 5
0
0
0,818( )
N O
P V
n mol
RT
= =
. Vì là ph n ng b c 1: Ta cóả ứ ậ
5
0
0,818
ln 1,8.10 .30 ln
n
kt
n n
−
= ⇒ =
⇒ n = 0,8175 mol N2O5 t i đi m kh o sát sau 30ạ ể ả
giây.
V y ậ
2 5
N O
n
b phân h y sau 30 giây là: ị ủ
2 5
N O
n
= 6,022.1023.5.10-4 = 3,011.1020 (phân t ).ử
c/ N u ph n ng trên có ph ng trình ế ả ứ ươ
2 5( ) 2 2
1
22
K
N O NO O→ +
thì V ph n ng và Kả ứ
không đ i vì t c đ ph n ng ph thu c vào b c ph n ng ( đây là b c 1); nông đ cácổ ố ộ ả ứ ụ ộ ậ ả ứ ở ậ ộ
ch t ph n ng và h ng s t c đ ph n ng (mà K ch ph thu c vào nhi t đ ) ch khôngấ ả ứ ằ ố ố ộ ả ứ ỉ ụ ộ ệ ộ ứ
ph thu c vào h s t l ng c a ph ng trình.ụ ộ ệ ố ỉ ượ ủ ươ
0,25x 3
0,75
0,5
Câu
8
(2,0
đi mể
)
1. Xác đ nh công th c c u t o c a A, B, C và D trong s đ sau: ị ứ ấ ạ ủ ơ ồ
OH COOH
OH
COOH
OCOCH
3
AB C D
0,25x 4
2.X: CxHy:
5:4
1
4,9
:
12
6,90
y:x
==
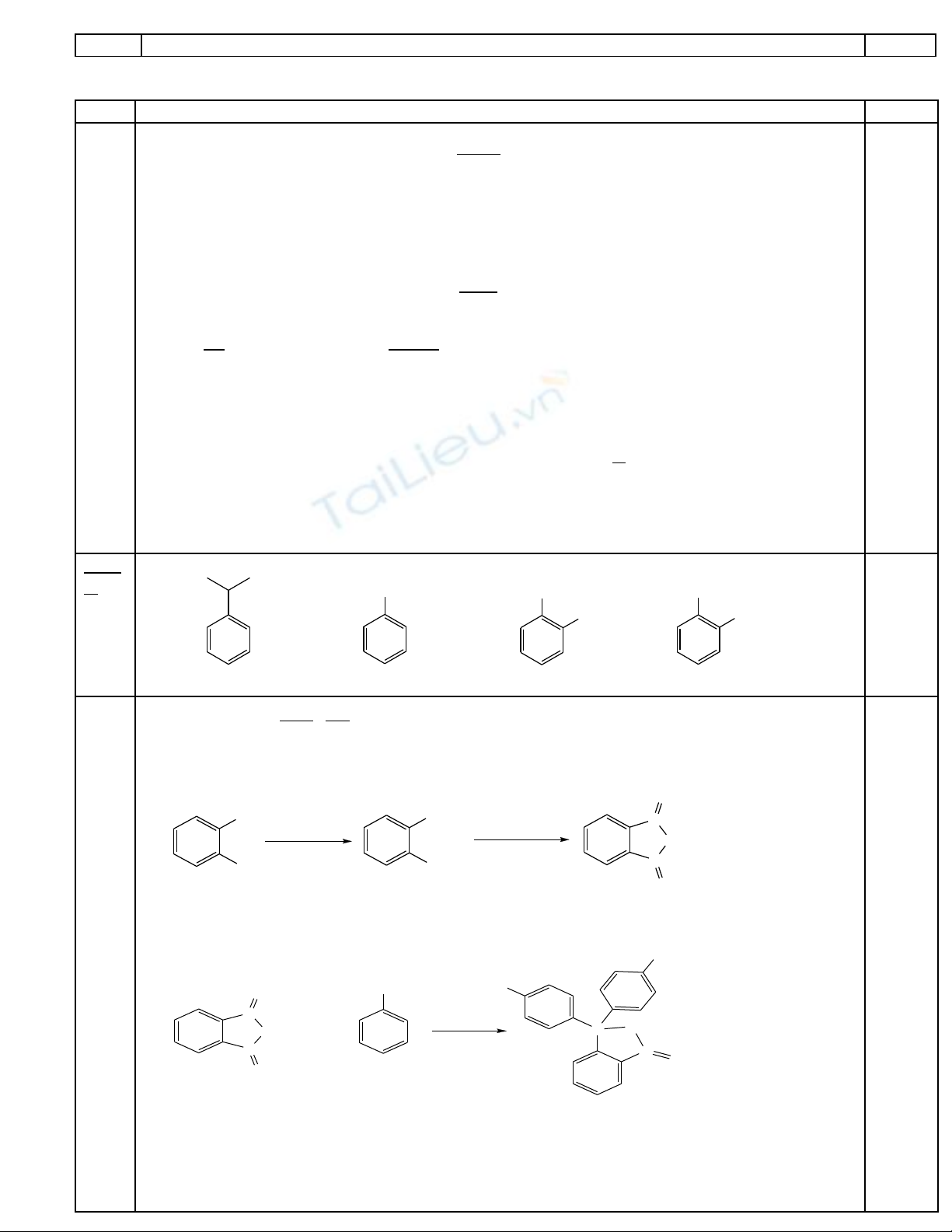
. X có d ng (Cạ4H5)n, kh i l ng mol c a X: Mố ượ ủ X = 106
g/mol
Công th c phân t c a X: Cứ ử ủ 8H10. Theo đ bài X ph i là ề ả o-xilen.
CH
3
CH
3
COOH
COOH C
O
C
O
O
o-xilen axit phtalic anhidrit phtalic
[O] t0
-H2O
XAB
Cho B tác d ng v i phenol ta đ c phenolphtaleinụ ớ ượ
C
O
C
O
O
OH
+2
H
2
SO
4
CO
CO
Phenolphtalein
Y
OH
HO
+2H
2
O
A và B tác d ng v i butan-1-ol đ u t o ra ch t h u c C:ụ ớ ề ạ ấ ữ ơ
0,2x 5










![Đề Thi Học Sinh Giỏi Hóa 11 Thành Phố Đà Nẵng [2005-2006] - Tuyển Tập Đề Thi](https://cdn.tailieu.vn/images/document/thumbnail/2010/20100913/trungtran5/135x160/_hoahoc11_thihsgthanhphodanang_2006_2007_4413.jpg)











![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



