
1
SỞ GIÁO DỤ C VÀ ĐÀO TẠ O
THÀNH PHỐ ĐÀ NẴ NG
HƯ Ớ NG DẪ N CHẤ M KÌ THI HỌ C SINH GIỎ I THÀNH PHỐ
NĂM HỌ C 2005 - 2006
MÔN: HÓA HỌ C LỚ P 11
Thờ i gian: 150 phút (không kể thờ i gian giao đề )
Câu I (4 điể m)
1. Nêu hiệ n tư ợ ng xả y ra và viế t phư ơ ng trình phả n ứ ng minh họ a trong các trư ờ ng hợ p sau:
(a) Hòa tan từ từ cho đế n dư dung dị ch NaOH vào dung dị ch AlCl3, sau đó thêm HCl vào dung
dị ch thu đư ợ c đế n dư .
(b) Thêm dung dị ch K2CO3 vào dung dị ch Fe(NO3)3
2. A là dung dị ch Na2CO3 0,1M; B là dung dị ch hỗ n hợ p Na2CO3 0,1M và KHCO3 0,1M và C là dung
dị ch KHCO3 0,1M.
(a) Tính thế tích khí CO2 (đktc) thoát ra khi cho từ từ từ ng giọ t đế n hế t 50 mL dung dị ch HCl 0,1M
vào 100 mL dung dị ch A và khi cho hế t 100 mL dung dị ch B vào 200 mL dung dị ch HCl 0,1M.
(b) Xác đị nh số mol các chấ t có trong dung dị ch thu đư ợ c khi thêm 100 mL dung dị ch Ba(OH)2
0,1M vào 150 mL dung dị ch C.
(c) Tính pH củ a các dung dị ch A và C, biế t axit cacbonic có pK1 = 6,35 và pK2 = 10,33.
(d) Đề nghị phư ơ ng pháp nhậ n biế t các anion có trong dung dị ch B.
ĐÁP ÁN
ĐIỂ M
1. (a) Thêm dung dị ch NaOH vào dung dị ch AlCl3 thấ y xuấ t hiệ n kế t tủ a trắ ng keo, sau đó
tan lạ i:
Al3+ + 3OH- Al(OH)3
Al(OH)3 + OH- Al(OH)4-
Thêm HCl vào dung dị ch thu đư ợ c lạ i thấ y xuấ t hiệ n kế t tủ a trắ ng keo, sau đó tan lạ i:
Al(OH)4- + H+ Al(OH)3 + H2O
Al(OH)3 + 3H+ Al3+ + 3H2O
0,50
(b) Thêm dung dị ch K2CO3 vào dung dị ch Fe(NO3)3 thấ y xuấ t hiệ n kế t tủ a đỏ nâu và sủ i
bọ t khí không màu: 2Fe3+ + 3CO32- + 3H2O 2Fe(OH)3 + 3CO2
0,25
2. (a) Cho từ từ từ ng giọ t đế n hế t 50 mL dung dị ch HCl 0,1M vào 100 mL dung dị ch
Na2CO3 0,1M
CO32- + H+ HCO3-
0,01 0,005
0,005 0,005
0,005 0
Do CO32- dư nên không có giai đoạ n tạ o CO2,
0V 2
CO
0,50
Cho hế t 100 mL dung dị ch Na2CO3 0,1M và KHCO3 0,1M vào 200 mL dung dị ch
HCl 0,1M:
CO32- + 2H+ H2O + CO2(1)
HCO3- + H+ H2O + CO2(2)
Vì
HHCOCO nnn2
3
2
3
nên H+ phả n ứ ng hế t.
Giả sử (1) xả y ra trư ớ c thì ta có
mol01,0n
2
1
nH
CO2
Giả sử (2) xả y ra trư ớ c thì từ (1) và (2) ta có
mol015,0n 2
CO
Thự c tế (1) và (2) đồ ng thờ i xả y ra nên:
L336,04,22015,0V4,2201,0L224,0 2
CO
1,00

2
(b) Thêm 100 mL dung dị ch Ba(OH)2 0,1M vào 150 mL dung dị ch KHCO3 0,1M
HCO3- + OH-CO32- + H2O
0,015 0,02
0,015 0,015
0 0,005 0,015
Ba2+ + CO32- BaCO3
0,01 0,015
0,01 0,01
0 0,005
Dung dị ch còn 0,005 mol KOH và 0,005 mol K2CO3
0,50
(c) Dung dị ch A có các cân bằ ng:
CO32- + H2O⇌ HCO3-+ OH-Kb1 = 10-3,67
HCO3- + H2O⇌ H2O + CO2 + OH-Kb2 = 10-7,65
H2O⇌ H+ + OH-KN = 10-14
Vì Kb1 >> Kb2 >> KN nên cân bằ ng (1) là chủ yế u:
pH = 14 -
2
1
(pKb1 + pC) = 14 -
2
1
(3,67 + 1) = 11,67
Dung dị ch C là dung dị ch lư ỡ ng tính nên:
pH =
2
1
(pK1 + pK2) =
2
1
(6,35 + 10,33) = 8,34
0,75
(d) Trích mẫ u thử, thêm BaCl2 dư vào mẫ u thử thấ y xuấ t hiệ n kế t tủ a trắ ng (tan trong
axit), như vậ y mẫ u thử có CO32-.
Ba2+ + CO32- BaCO3
Lọ c tách kế t tủ a, thêm HCl vào dung dị ch nư ớ c lọ c thấ y sủ i bọ t khí không màu (làm đụ c
nư ớ c vôi trong), vậ y dung dị ch có HCO3-
HCO3- + H+ H2O + CO2.
0,50
Câu II (4 điể m)
1. (a) Amoniac có tính oxi hóa hay tính khử? Viế t phư ơ ng trình phả n ứ ng minh họ a. (b) Trong dung
môi amoniac lỏ ng, các hợ p chấ t KNH2, NH4Cl, Al(NH2)3 có tính axit, bazơ hay lư ỡ ng tính ? Viế t
các phư ơ ng trình phả n ứ ng minh họ a.
2. Hòa tan 4,8 gam kim loạ i M bằ ng dung dị ch HNO3đặ c nóng dư, hay hòa tan 2,4 gam muố i sunfua
kim loạ i này cũng trong dung dị ch HNO3đặ c nóng, thì đề u cùng sinh ra khí NO2 duy nhấ t có thể
tích bằ ng nhau trong cùng điề u kiệ n.
(a) Viế t các phư ơ ng trình phả n ứ ng dư ớ i dạ ng phư ơ ng trình ion.
(b) Xác đị nh kim loạ i M, công thứ c phân tử muố i sunfua.
(c) Hấ p thụ khí sinh ra ở cả hai phả n ứ ng trên vào 300 mL dung dị ch NaOH 1M, rồ i thêm vào đó
mộ t ít phenolphtalein. Hỏ i dung dị ch thu đư ợ c có màu gì? Tạ i sao?
ĐÁP ÁN
ĐIỂ M
1. (a) NH3 vừ a có tính oxi hóa, vừ a có tính khử :
Tính oxi hóa: K + NH3 (l) KNH2 + 1/2H2
Tính khử : 2NH3 + 3CuO 3Cu + N2 + 3H2O
0,75
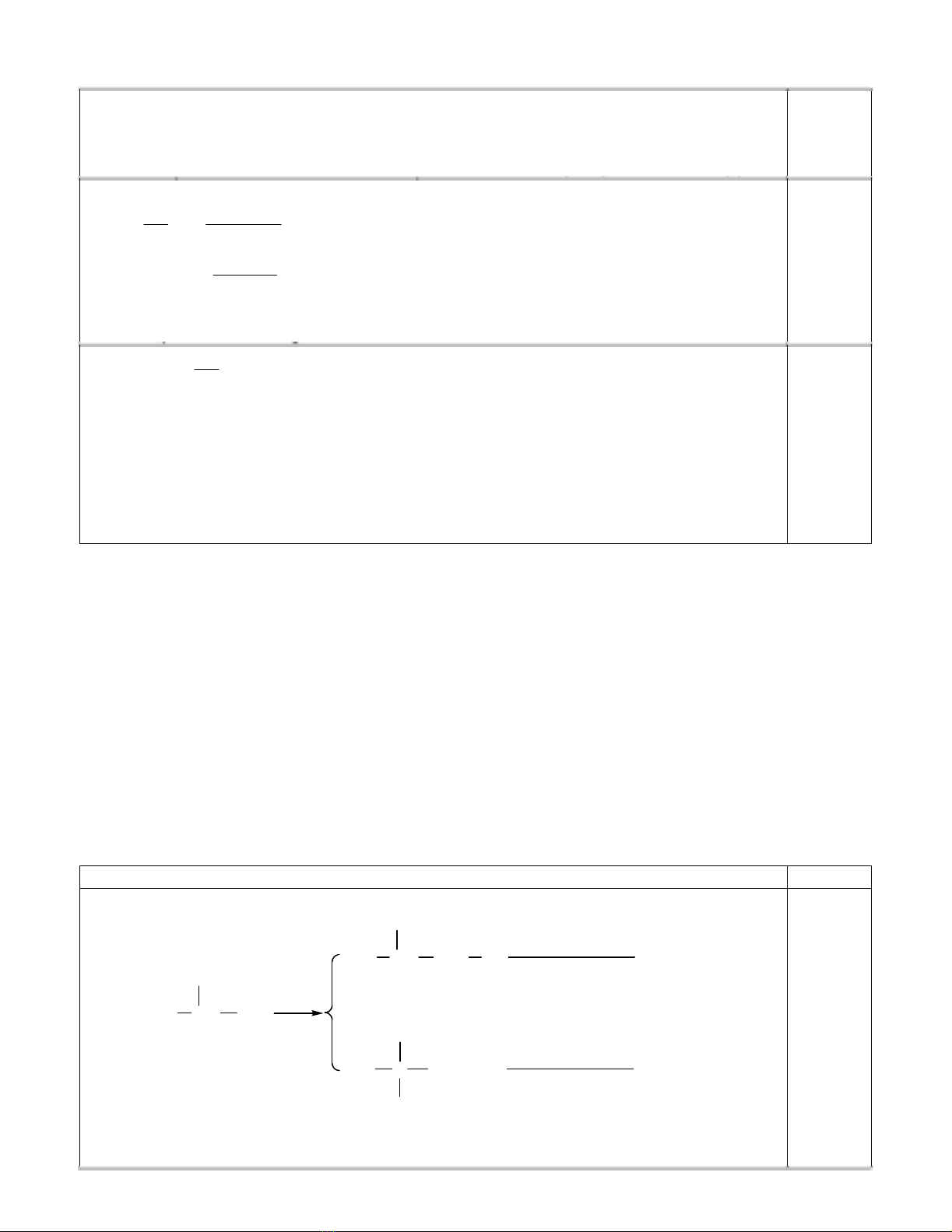
(b) KNH2 là mộ t bazơ , NH4Cl là axit và Al(NH2)3 có tính lư ỡ ng tính.
Phả n ứ ng trung hòa: KNH2 + NH4Cl KCl + 2NH3
Phả n ứ ng củ a chấ t lư ỡ ng tính vớ i axit: Al(NH2)3 + 3NH4Cl AlCl3 + 6NH3
Phả n ứ ng củ a chấ t lư ỡ ng tính vớ i bazơ : Al(NH2)3 + KNH2 K[Al(NH2)4]
075
3
2. (a) Phư ơ ng trình phả n ứ ng:
M + 2mH+ + mNO3- Mm+ + mNO2 + mH2O (1)
M2Sn + 4(m+n)H+ + (2m+6n)NO3- 2Mm+ + nSO42- + (2m+6n)NO2
+ 2(m+n)H2O (2)
1,00
(b) Vì số mol NO2ở hai trư ờ ng hợ p là bằ ng nhau nên ta có:
)n6m2(
n32M2
4,2
m
M
8,4
3,2,1m,n
m2n6
mn64
M
, nghiệ m thích hợ p là n = 1, m = 2 và M = 64.
Vậ y M là Cu và công thức muố i là Cu2S.
0,75
(c)
mol075,0
64
8,4
nCu
Cu + 4HNO3 Cu(NO3)2 + 2NO2 + 2H2O
NaOHNO nmol3,0075,022n 2
đã xả y ra vừ a đủ phả n ứ ng:
2NO2 + 2NaOH NaNO3 + NaNO2 + H2O
Dung dị ch thu đư ợ c có màu hồ ng do NO2- tạ o môi trư ờ ng bazơ:
NO2- + H2O⇌ HNO2 + OH-
0,75
Câu III (4 điể m)
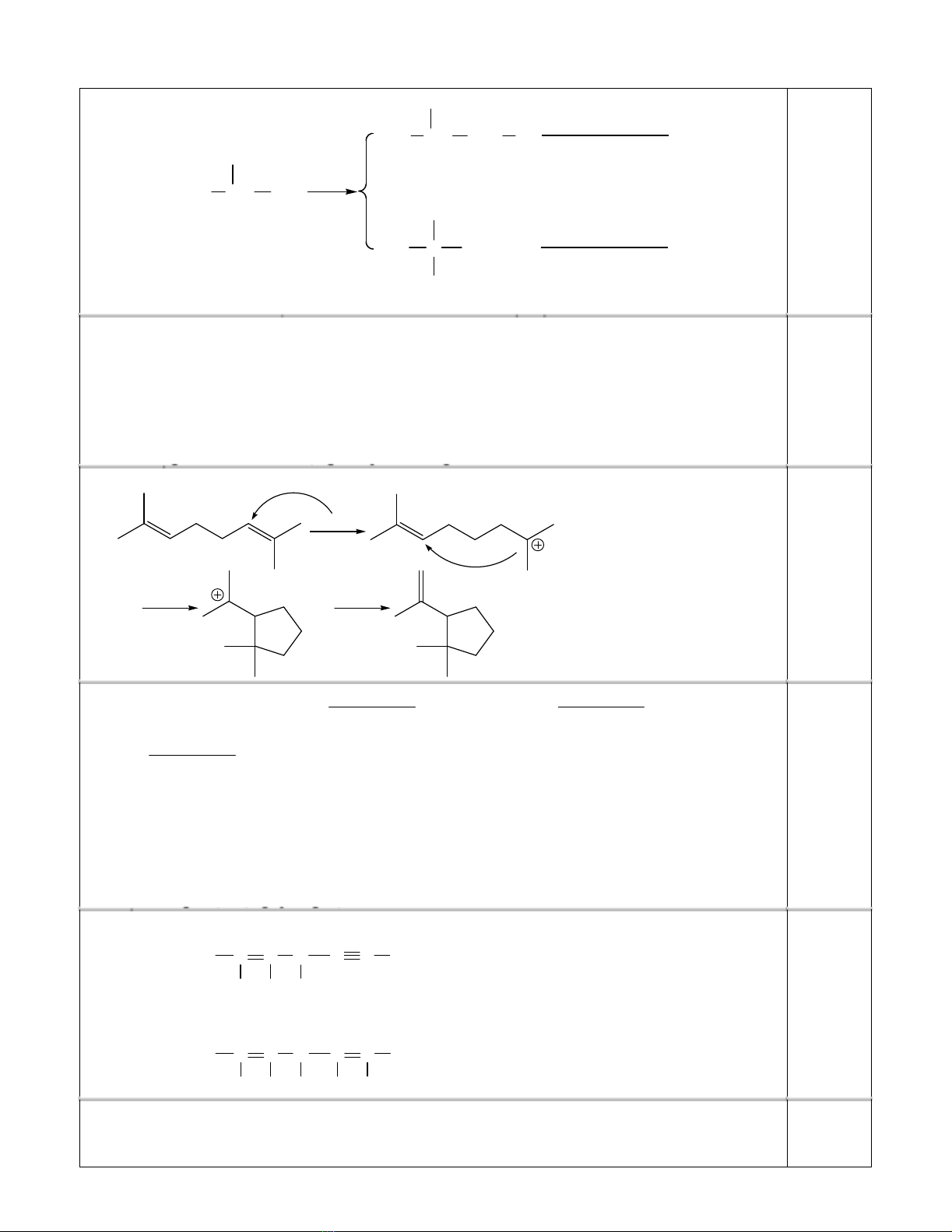
1. (a) Tính tỉ lệ các sả n phẩ m monoclo hóa (tạ i nhiệ t độ phòng) và monobrom hóa (tạ i 127oC)
isobutan. Biế t tỉ lệ khả năng phả n ứ ng tư ơ ng đố i củ a nguyên tử H trên cacbon bậ c nhấ t, bậ c hai và
bậ c ba trong phả n ứ ng clo hóa là 1,0 : 3,8 : 5,0 và trong phả n ứ ng brom hóa là 1 : 82 : 1600.
(b) Dự a vào kế t quả tính đư ợ c ở câu (a), cho nhậ n xét về các yế u tố ả nh hư ở ng đế n hàm lư ợ ng các
sả n phẩ m củ a phả n ứ ng halogen hóa ankan.
2. Dùng cơ chế phả n ứ ng giả i thích tạ i sao khi xử lý 2,7-đimetylocta-2,6-dien vớ i axit photphoric thì
thu đư ợ c 1,1-đimetyl-2-isopropenylxiclopentan.
3. Hiđro hóa mộ t hiđrocacbon A (C8H12) hoạ t độ ng quang họ c thu đư ợ c hiđrocacbon B (C8H18) không
hoạ t độ ng quang họ c. A không tác dụ ng vớ i Ag(NH3)2+ và khi tác dụ ng vớ i H2 trong sự có mặ t củ a
Pd/PbCO3 tạ o hợ p chấ t không hoạ t độ ng quang họ c C (C8H14).
(a) Lậ p luậ n xác đị nh cấ u tạ o (có lư u ý cấ u hình) và gọ i tên A, B, C.
(b) Oxi hóa mãnh liệ t A bằ ng dung dị ch KMnO4 trong H2SO4.Viế t phư ơ ng trình hoá họ c.
ĐÁP ÁN
ĐIỂ M
1. (a) Tỉ lệ sả n phẩ m:
CH3CH CH3
+ Cl2
- HCl
CH3CH CH2Cl
CH3C CH3
Cl
1-clo-2-metylpropan
2-clo-2-metylpropan
CH3
CH3
CH3
(9x1,0)
(9x1,0) + (1x5,0) = 64,3%
(1x5,0)
(9x1,0) + (1x5,0) = 35,7%
0,50
4
CH3CH CH3
+ Br2
- HCl
CH3CH CH2Br
CH3C CH3
Br
1-brom-2-metylpropan
2-brom-2-metylpropan
CH3
CH3
CH3
(9x1,0)
(9x1,0) + (1x1600) = 0,56%
(1x1600)
(9x1,0) + (1x1600) = 99,44%
0,50
(b) Hàm lư ợ ng sả n phẩ m halogen hóa phụ thuộ c ba yế u tố :
Khả năng tham gia phả n ứ ng thế củ a ankan: Phả n ứ ng halogen hóa ư u tiên thế hidro
trên nguyên tử cacbon bậ c cao hơ n.
Khả năng phả n ứ ng củ a halogen: Brom tham gia phả n ứ ng yế u hơ n so vớ i clo,
như ng có khả năng chọ n lọ c vị trí thế cao hơ n so vớ i clo.
Số nguyên tử hidro trên cacbon cùng bậ c: Khi số hidro trên các nguyên tử cacbon
càng nhiề u thì hàm lư ợ ng sả n phẩ m càng lớ n.
0,75
2. Cơ chế :
H+
-H+
0,75
3. (a) A có độ bấ t bão hòa
3
2
128.22
, B có
0
2
188.22
và C có
2
2
148.22
.
Vì A cộ ng 3 phân tử hidro để tạ o ra B nên A có các liên kế t bộ i hoặ c vòng ba cạ nh.
A cộ ng 1 phân tử H2 tạ o ra C và A không tác dụ ng vớ i Ag(NH3)2+ nên A có mộ t liên
kế t ba dạ ng -CC-R.
A cũng phả i chứ a mộ t liên kế t đôi dạ ng cis- (Z) ở vị trí đố i xứ ng vớ i liên kế t ba, vì
khi A cộ ng 1 phân tử H2 (xúc tác Pd làm cho phả n ứ ng chạ y theo kiể u cis-) tạ o C
không hoạ t độ ng quang họ c.
0,50
Cấ u tạ o củ a A, B, C là:
CH3C C
H H
H
C
CH3
C
*CCH32Z-4-metylhept-2-en-5-in
(A)
CH3CH2CH2CH(CH3)CH2CH2CH34-metylheptan
(B)
CH3C C
H H
H
C
CH3
C C CH32Z,5Z-4-metylhepta-2,5-dien
(C)
HH
0,75
(b) Phư ơ ng trình phả n ứ ng:
5CH3CH=CHCH(CH3)CC-CH3 + 14KMnO4 + 21H2SO4
10CH3COOH + 5CH3CH(COOH)2 + 14MnSO4 + 7K2SO4 + 16H2O
0,25
5
Câu IV (4 điể m)
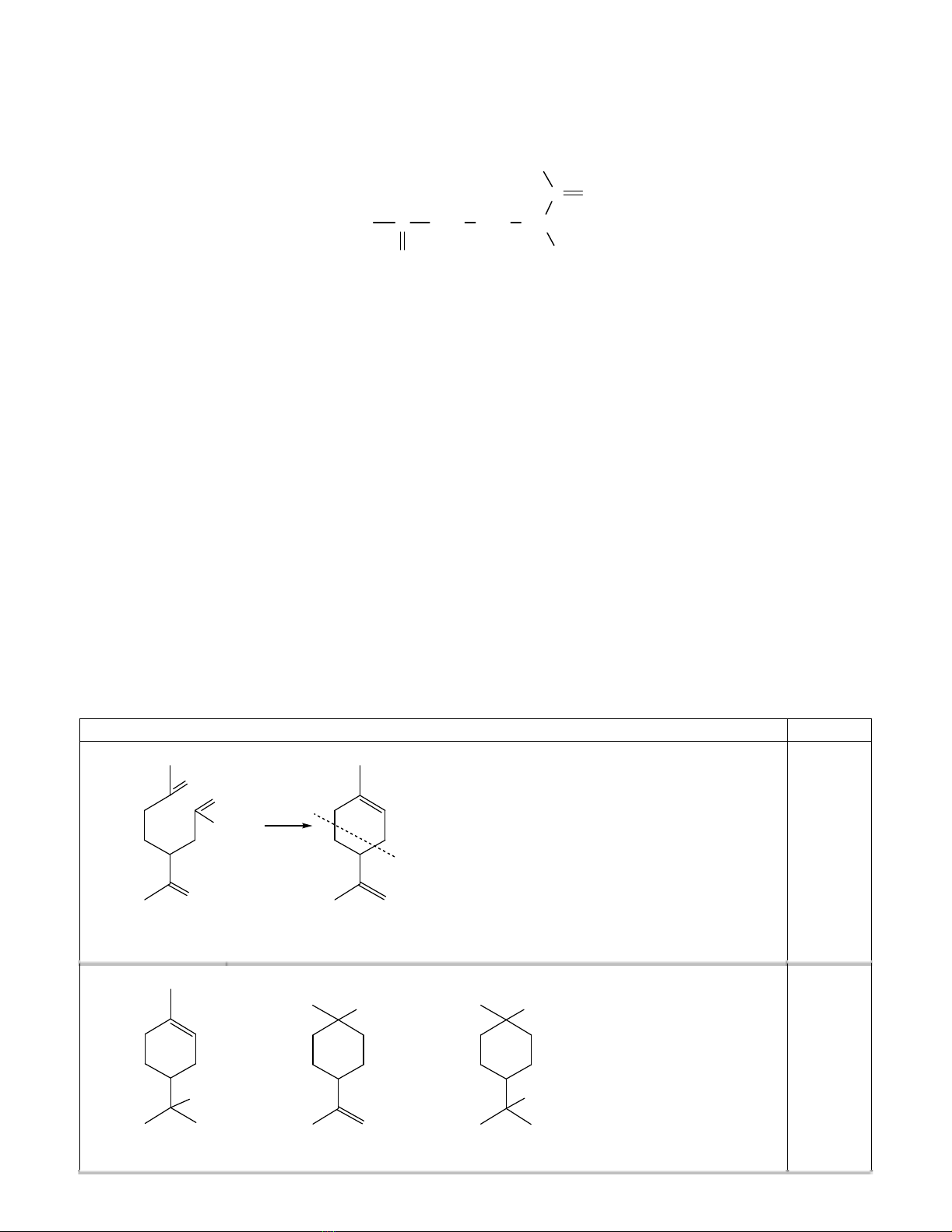
1. Limonen (C10H16) là tecpen có trong vỏ quả cam, chanh và bư ở i. Oxi hóa limonen bằ ng
kalipemanganat tạ o chấ t A.
CH3C
O
CH2CH2CH
CH2COOH
CO
H3C
(A)
(a) Dùng dữ kiệ n trên và qui tắ c isopren xác đị nh cấ u trúc củ a limonen.
(b) Viế t công thứ c các sả n phẩ m chính hình thành khi hidrat hóa limonen.
2. Để điề u chế nitrobenzen trong phòng thí nghiệ m và tính hiệ u suấ t phả n ứ ng, ngư ờ i ta tiế n hành các
bư ớ c sau:
Cho 19,5 ml axit nitric vào mộ t bình cầ u đáy tròn cỡ 200 mL làm lạ nh bình và lắ c, sau đó thêm từ
từ 15 mL H2SO4 đậ m đặ c, đồ ng thờ i lắ c và làm lạ nh đế n nhiệ t độ phòng. Lắ p ố ng sinh hàn hồ i lư u
(nư ớ c hay không khí), cho tiế p 13,5 mL benzen qua ố ng sinh hàn vớ i tố c độ chậ m và giữ nhiệ t độ
không quá 500C, đồ ng thờ i lắ c liên tụ c (a).
Sau khi cho hế t benzen, tiế p tụ c đun nóng bình phả n ứ ng trên bế p cách thuỷ trong 30-45 phút và
tiế p tụ c lắ c. Sau đó làm lạ nh hỗ n hợ p phả n ứ ng và đổ qua phễ u chiế t. Tách lấ y lớ p nitrobenzen ở
trên. Rử a nitrobenzen bằ ng nư ớ c rồ i bằ ng dung dị ch Na2CO3(b). Tách lấ y nitrobenzen cho vào bình
làm khô có chứ a chấ t làm khô A ở thể rắ n (c). Chư ng cấ t lấ y nitrobenzen bằ ng bình Vuy-êc trên bế p
cách thuỷ để thu lấ y nitrobenzen sạ ch. Cân lư ợ ng nitrobenzen thấ y đư ợ c 15 gam (d).
(a) Viế t phư ơ ng trình hoá họ c chính và các phư ơ ng trình thể hiệ n cơ chế củ a phả n ứ ng. Cho biế t vì
sao cầ n phả i lắ c bình liên tụ c và giữnhiệ t độ phả n ứ ng ở 500C? Nế u không dùng H2SO4 đậ m
đặ c, phả n ứ ng có xả y ra không?
(b) Vì sao cầ n phả i rử a nitrobenzen bằ ng nư ớ c, sau đó bằ ng dung dị ch Na2CO3?
(c) A có thể là chấ t nào?
(d) Tính hiệ u suấ t phả n ứ ng nế u khố i lư ợ ng riêng củ a benzen 0,8g/mL.
ĐÁP ÁN
ĐIỂ M
1. (a) Cấ u tạ o:
O + O=C=O
O
O
OH
limonen
0,75
(b) Các sả n phẩ m chính khi hidrat hóa:
OH
OH OH
OH
0,75










![Đề Thi Học Sinh Giỏi Hóa 11 Thành Phố Đà Nẵng [2005-2006] - Tuyển Tập Đề Thi](https://cdn.tailieu.vn/images/document/thumbnail/2010/20100913/trungtran5/135x160/_hoahoc11_thihsgthanhphodanang_2006_2007_4413.jpg)











![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



