
Bộ đề thi học sinh giỏi môn Hóa học lớp 11 cấp trường năm 2020-2021
lượt xem 31
download
 Download
Vui lòng tải xuống để xem tài liệu đầy đủ
Download
Vui lòng tải xuống để xem tài liệu đầy đủ
Nhằm giúp các bạn học sinh đang chuẩn bị bước vào kì thi học sinh giỏi cấp trước có thêm tài liệu ôn tập, TaiLieu.VN giới thiệu đến các bạn Bộ đề thi học sinh giỏi môn Hóa học lớp 11 cấp trường năm 2020-2021 có đáp án để ôn tập nắm vững kiến thức môn học. Tài liệu đi kèm có đáp án giúp các em so sánh kết quả và tự đánh giá được lực học của bản thân, từ đó đặt ra kế hoạch ôn tập phù hợp giúp các em đạt kết quả cao trong kì thi.
Bình luận(0) Đăng nhập để gửi bình luận!
Nội dung Text: Bộ đề thi học sinh giỏi môn Hóa học lớp 11 cấp trường năm 2020-2021
Tham khảo thêm:
- Bộ đề thi học sinh giỏi môn Vật lí lớp 11 cấp trường năm 2020-2021
- Bộ đề thi học sinh giỏi môn Sinh học lớp 11 cấp trường năm 2020-2021
- Bộ đề thi học sinh giỏi môn Toán lớp 11 cấp tỉnh năm 2020-2021
1. Đề thi HSG môn Hóa học lớp 11 cấp trường - Trường THPT Liễn Sơn, Vĩnh Phúc
Câu 1: Viết các phương trình phản ứng xảy ra trong các trường hợp sau:
1. Cho dung dịch NaHSO4 vào dung dịch NaAlO2 dư
2. Cho dung dịch Na2S vào dung dịch AlCl3.
3. Cho CuSO4 vào dung dịch KI.
4. Cho Fe3O4 vào dung dịch HI.
5. Cho Na2CO3 vào dung dịch FeCl3
Câu 2: Hình vẽ sau đây mô tả thí nghiệm điều chế khí Y từ hỗn hợp rắn gồm CaC2 và Al4C3 Xác định khí X, Y. Viết các phương trình phản ứng xảy ra trong thí nghiệm trên

Câu 3: Cho phản ứng sau: X+ HNO3 →Fe(NO3)3 + NO+ H2O. Tìm công thức của X thỏa mãn phản ứng trên. Viết các phương trình phản ứng với từng chất của X đã tìm.
Câu 4: Đốt cháy hoàn toàn 0,25 mol hỗn hợp X gồm hai hidrocacbon mạch hở cần dùng vừa đủ 14 lít O2 (đktc). Hấp thụ toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 , sau khi các phản ứng xảy ra hoàn toàn thu được 30 gam kết tủa và một dung dịch có khối lượng giảm 4,3 gam so với khối lượng dung dịch Ca(OH)2 ban đầu. Mặt khác, cho 8,55 gam X trên tác dụng với lượng dư dung dịch AgNO3 trong NH3 , thu được tối đa m gam kết tủa. Tính m.
Câu 5: Nung nóng 30,005 gam hỗn hợp gồm KMnO4, KClO3 và MnO2, sau một thời gian thu được khí oxi và 24,405 gam chất rắn Y gồm 4 chất: KMnO4, K2MnO4, MnO2, KCl. Để phản ứng hoàn toàn với Y cần vừa đủ 2 lít dung dịch HCl 0,4M thu được 4,844 lít Cl2(đktc). Phần trăm KMnO4 bị nhiệt phân là bao nhiêu?
Câu 6: Hỗn hợp X gồm MgO, Al2O3, Mg, Al, hòa tan m gam hỗn hợp X bằng dung dịch HCl vừa đủ thì thu được dung dịch chứa (m + 70,295) gam muối. Cho 2m gam hỗn hợp X tác dụng với dung dịch H2SO4 đặc nóng dư thu được 26,656 lít SO2 (đktc, sản phẩm khử duy nhất). Nếu cho 2m gam hỗn hợp X tác dụng với dung dịch HNO3 loãng dư thu được 7,616 lít hỗn hợp khí NO và N2O (đktc) có tỉ khối so với hidro là 318/17, dung dịch Y. Cô cạn dung dịch Y thu được 324,3 gam muối khan. Tính m?
Câu 7: Hỗn hợp X gồm Al, Fe2O3, Fe3O4, CuO, Cu trong đó oxi chiếm 25,39% về khối lượng hỗn hợp. Cho m gam hỗn hợp X tác dụng với 8,96 lít khí CO (ở đktc) sau một thời gian thu được hỗn hợp rắn Y và hỗn hợp khí Z có tỉ khối so với hiđro là 19. Cho hỗn hợp Y tác dụng với dung dịch HNO3 loãng dư thu được dung dịch T và 7,168 lít khí NO (ở đktc, sản phẩm khử duy nhất). Cô cạn T thu được 3,456m gam muối khan.Tính m.
Câu 8: Cho 3,5a gam hỗn hợp X gồm C và S tác dụng với lượng dư dung dịch HNO3 đặc, nóng, thu được hỗn hợp khí Y gồm NO2 và CO2 có thể tích 3,584 lít. Dẫn toàn bộ Y qua bình đựng dung dịch nước vôi trong dư thu được 12,5a gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là bao nhiêu?
Câu 9: Cho hỗn hợp chất rắn gồm CaC2, Al4C3, Ca vào nước thu được hỗn hợp X gồm 3 khí (trong đó có 2 khí có cùng số mol). Lấy 8,96 lít hỗn hợp X chia làm 2 phần bằng nhau.
Phần 1: cho vào dung dịch AgNO3 trong NH3 (dư), sau phản ứng thu được 24 gam kết tủa.
Phần 2: Cho qua Ni (đun nóng) thu được hỗn hợp khí Y. Thể tích O2 vừa đủ cần dùng để đốt cháy hoàn toàn Y là bao nhiêu?
Câu 10: Chia m gam hỗn hợp E gồm Fe2O3, CuO, FeS và FeS2 (trong đó mO = 11m/129) làm hai phần bằng nhau:
- Phần 1: Hòa tan hoàn toàn trong dung dịch H2SO4 (đặc, nóng, dư) thu được sản phẩm khử duy nhất là khí SO2 và dung dịch X có chứa (m + 0,96) gam muối sunfat.
- Phần 2: Hòa tan hoàn toàn trong dung dịch HNO3 (đặc, nóng, dư) thu được dung dịch A và thoát ra 17,248 lít hỗn hợp khí B gồm SO2 và NO2 (có tỉ lệ số mol NO SO 2 2 n : n = 18,25). Cô cạn A được muối khan C. Cho C vào bình đựng 400 ml dung dịch NaOH 1M thu được dung dịch D và a gam kết tủa. Cô cạn dung dịch D được (m + 8,08) gam chất rắn khan. Biết các phản ứng xảy ra hoàn toàn. Tính các giá trị m và a.
2. Đề thi HSG môn Hóa học lớp 11 cấp trường - Trường THPT Phan Chu Trinh, Phú Yên
Câu I. (4 điểm) 1. Hòa tan hoàn toàn m gam hỗn hợp X gồm Na, K2O, Ba và BaO (trong đó oxi chiếm 10% về khối lượng) vào nước, thu được 100 ml dung dịch Y và 0,56 lít khí H2 (đktc). Trộn 100 ml dung dịch Y với 400 ml dung dịch gồm HCl 0,4M và HNO3 0,1M, thu được 500 ml dung dịch có pH=1. 1) Viết các phương trình phản ứng hoá học đã xảy ra. 2) Tính giá trị của m.
2 .Trong phòng thí nghiệm thường điều chế CO2 từ CaCO3 và dung dịch HCl như hình vẽ sau:
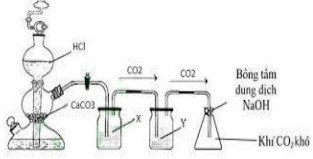
Để thu được CO2 tinh khiết có 2 học sinh (HS) cho sản phẩm khí qua 2 bình như sau:
HS1: Bình (X) đựng dung dịch NaHCO3 và bình (Y) đựng H2SO4 đặc.
HS2: Bình (X) đựng H2SO4 đặc và bình (Y) đựng dung dịch NaHCO3. Cho biết học sinh nào làm đúng? Viết phương trình hóa học giải thích cách làm
Câu II:(5,0 điểm)
1. Hai nguyên tố X, Y đều thuộc nhóm A trong bảng tuần hoàn. Nguyên tử X có tổng số electron ở các phân lớp p là 11, nguyên tử Y có 4 lớp electron và có 2 electron ở lớp ngoài cùng.
a.Viết cấu hình electron nguyên tử và xác định các nguyên tố X, Y. b.Hoàn thành dãy chuyển hóa (X, Y là các nguyên tố tìm được ở trên) X2 →(1) HX →(2) YX2 →(3) X2 →(4) YOX2
2. X, Y là 2 nguyên tố thuộc cùng một nhóm A ở 2 chu kì liên tiếp trong bảng tuần hoàn. Nguyên tửX có 6e lớp ngoài cùng. Hợp chất của X với hiđro có %mH = 11,1%. Xác định 2 nguyên tốX, Y.
3. Có hai dung dịch: Dung dịch A và dung dịch B, mỗi dung dịch chỉ chứa 2 loại cation và 2 loại anion khác nhau trong số các ion sau: NH4 + (0,15 mol); H+ (0,25 mol); Na+ (0,25 mol); CO3 2- (0,1 mol), NO3 - (0,1 mol); Al3+ ( 0,05 mol) ; Br- (0,2 mol) ; SO4 2- (0,15 mol). Xác định dung dịch A và dung dịch B. Biết rằng khi cho dung dịch NaOH vào dung dịch A và đun nóng nhẹ thì có khí thoát ra làm xanh giấy quỳ tím ẩm.
Câu III (6 điểm)
1. Cho X, Y là hai nguyên tố phi kim. Trong mỗi nguyên tử của các nguyên tố X, Y có số hạt mang điện nhiều hơn số hạt không mang điện lần lượt là 14 và 16. Hợp chất A có công thức phân tử là XYn có đặc điểm: X chiếm 15,0486% về khối lượng; tổng số proton và nơtron trong một phân tử A lần lượt là 100 và 106. Xác định các nguyên tố X, Y và công thức phân tử của A.
2. Hoàn thành sơ đồ phản ứng, cân bằng phương trình hóa học bằng phương pháp thăng bằng electron, xác định chất oxi hóa, chất khử trong các trường hợp sau:
a) FeCl2 + PbO2 + H2SO4 → … + … + … + …
b) HClO + PbS → … + …
c) H2O2 + KMnO4 + H2SO4 → … + … + … + …
3.Cho 21,8 gam chất X (hợp chất của lưu huỳnh) vào nước dư được dung dịch Y. Cho BaCl2 dư vào Y thu được kết tủa trắng và dung dịch Z. Cho Zn dư vào Z, thu được 5,6 lít (đktc) khí hiđro. Xác định công thức phân tử của X.
Câu IV (5 điểm)
1. Hấp thụ hoàn toàn 1,568 lít CO2 (đktc) vào 500ml dung dịch NaOH 0,16M, thu được dung dịch X. Thêm 250 ml dung dich Y gồm BaCl2 0,16M và Ba(OH)2 a M vào dung dịch X, thu được 3,94 gam kết tủa và dung dịch Z. Tính giá trị của a.
2. Xác định các chất và viết phương trình phản ứng xảy ra trong các sơ đồ sau: a) X1 + X2 + X3 HCl + H2SO4 b) A1 + A2 SO2 + H2O c) B1 + B2 NH3 + Ca(NO3)2 + H2O d) D1 + D2 + D3 Cl2 + MnSO4 + K2SO4 + Na2SO4 + H2O e) Y1 + Y2 Fe2(SO4)3 + FeCl3 g) Y3 + Y4 Na2SO4 + (NH4)2SO4 + H2O + CO2
3. Hòa tan hoàn toàn m gam hỗn hợp gồm Na, Na2O, NaOH và Na2CO3 trong dung dịch H2SO4 40% (loãng, vừa đủ) thu được 8,96 lít hỗn hợp khí có tỉ khối đối với H2 bằng 16,75 và dung dịch Y có nồng độ 51,449%. Cô cạn toàn bộ dung dịch Y thu được 170,4 gam muối trung hoà khan. Viết các phương trình phản ứng và tính giá trị của m.
3. Đề thi HSG môn Hóa học lớp 11 cấp trường - Trường THPT Phùng Khắc Khoan, Hà Nội
Câu 1 (3 điểm): Viết phương trình phân tử và phương trình ion thu gọn cho các thí nghiệm sau (mỗi thí nghiệm viết 1 phương trình)
a) Cho NaOH tác dụng với Ca(HCO3)2 dư.
b) 2 mol H3PO3 vào dung dịch chứa 3 mol KOH.
c) Hòa tan Fe3O4 trong dung dịch HNO3 đặc, dư và đun nóng.
d) Cho dung dịch NH4HSO4 vào dung dịch Ba(HSO3)2.
e) Cho dung dịch Ba(AlO2)2 vào dung dịch Al2(SO4)3.
f) Cho dung dịch KH2PO3vào dung dịch NaOH.
Câu 2: (2 điểm): Sục từ từ V lít khí CO2 vào 100ml dung dịch chứa hỗn hợp gồm Ca(OH)2 1M và NaOH 1M.
a) Vẽ đồ thị biểu diễn sự biến thiên số mol kết tủa thu được theo số mol của khí CO2 nếu thể tích CO2 lần lượt là: 2,24 lít, 4,48 lít, 6,72 lít.
b) Tính thể tích CO2 cần dùng để thu được 5 gam kết tủa. Biết rằng thể tích các khí đều đo ở điều kiện tiêu chuẩn.
Câu 3 (2,5 điểm).
a) Một oxit X, có nitơ chiếm 30,43% về khối lượng. Xác định công thức phân tử của X. Cho một lượng X phản ứng vừa đủ với dung dịch NaOH. Viết phương trình hóa học của phản ứng xảy ra dạng phân tử và ion rút gọn. Dung dịch sau phản ứng có môi trường gì, giải thích?
b) Bằng phương pháp hóa học hãy phân biệt các mẫu phân bón sau: Đạm 2 lá( NH4NO3), Đạm ure (NH2)2CO, amophot NH4H2PO4, supephotphat kép.
Câu 4 (2 điểm): Giải thích ngắn gọn các trường hợp sau:
a) Để tẩy uế hố rác, cống rãnh, chuồng trại người ta thường dùng clorua vôi.
b) Trong thiên nhiên có nhiều nguồn tạo ra H2S nhưng không có hiện tượng tích tụ khí H2S trong không khí.
c) I2 tan rất ít trong nước nhưng tan nhiều trong các dung môi hữu cơ như benzen, xăng, … và tan trong dung dịch KI. d) Ozon dễ hóa lỏng và tan trong nước nhiều hơn oxi.
Câu 5( 2điểm): Dung dịch X thu được khi trộn một thể tích dung dịch H2SO4 0,1M với một thể tích dung dịch HCl 0,2M. Dung dịch Y chứa NaOH 0,2M và Ba(OH)2 0,1M. Đổ 100 ml dung dịch X vào 100 ml dung dịch Y, khuấy đều để phản ứng xảy ra hoàn toàn, thu được 200 ml dd X có pH = a và m gam kết tủa Y. Đổ từ từ 200ml dung dịch X vào 50 ml dung dịch AlCl3 0,12M thì thấy có x gam kết tủa nữa. Viết phản ứng ở dạng ion và tính giá trị của a, m, x.
Câu 6 (1,5 điểm): Hợp chất C màu vàng cam được tạo thành từ phản ứng của kim loại A với phi kim B. Cho 0,1 mol chất C phản ứng với CO2 dư thì thu được hợp chất D và 2,4 gam B. Biết C chứa 45,07%B theo khối lượng, D không bị phân hủy ở nhiệt độ nóng chảy. Khi cho D phản ứng hết với 100 mL dung dịch HCl 1,0 M thì thu được 1,12 lít khí CO2 (đktc). Hãy xác định A, B, C, D và viết phương trình hóa học của các phản ứng xảy ra.
Câu 7 (2 điểm): Dung dịch X chứa HCl 4M và HNO3 aM. Cho từ từ Mg vào 100 ml dung dịch X cho tới khi khí ngừng thoát ra thấy tốn hết b gam Mg, thu được dung dịch B chỉ chứa các muối của Mg và thoát ra 17,92 lít hỗn hợp khí Y gồm 3 khí. Cho Y qua dung dịch NaOH dư thấy còn lại 5,6 lít hỗn hợp khí Z thoát ra có Z H2 d =3,8. Các phản ứng xảy ra hoàn toàn. Thể tích các khí đều đo ở đktc. Tính a, b?
Trên đây là phần trích dẫn nội dung Đề thi học sinh giỏi môn Hóa học lớp 11 cấp trường năm 2020-2021 để tham khảo đầy đủ, mời các bạn đăng nhập và tải về tài liệu về máy.

CÓ THỂ BẠN MUỐN DOWNLOAD
-

Bộ đề thi học sinh giỏi tỉnh môn Tiếng Anh 12
 145 p |
145 p |  4574
|
4574
|  2307
2307
-

Bộ đề thi học sinh giỏi Tiếng Anh 9
 58 p |
58 p |  2321
|
2321
|  898
898
-

Bộ đề thi học sinh giỏi Địa của các cấp lớp
 36 p |
36 p |  1727
|
1727
|  564
564
-

Bộ đề thi học sinh giỏi Tiếng Anh lớp 8
 92 p |
92 p |  1709
|
1709
|  421
421
-

Bộ đề thi học sinh giỏi môn Tiếng Anh lớp 6 năm 2017-2018 có đáp án
 31 p |
31 p |  4680
|
4680
|  112
112
-

Bộ đề thi học sinh giỏi môn Hóa học lớp 8 năm 2017-2018 có đáp án
 32 p |
32 p |  4368
|
4368
|  110
110
-

Bộ đề thi học sinh giỏi môn Tiếng Anh lớp 8 có đáp án
 39 p |
39 p |  1897
|
1897
|  101
101
-

Bộ đề thi học sinh giỏi môn Ngữ văn lớp 7 năm 2017-2018 có đáp án
 29 p |
29 p |  2799
|
2799
|  77
77
-

Bộ đề thi học sinh giỏi môn Toán lớp 8 năm 2017-2018 có đáp án
 35 p |
35 p |  1416
|
1416
|  76
76
-

Bộ đề thi học sinh giỏi lớp 9 môn Toán
 23 p |
23 p |  511
|
511
|  76
76
-

Bộ đề thi học sinh giỏi cấp huyện môn Toán lớp 9 năm 2018-2019 có đáp án
 36 p |
36 p |  1144
|
1144
|  62
62
-

Bộ đề thi học sinh giỏi môn Ngữ văn lớp 8 năm 2017-2018 có đáp án
 40 p |
40 p |  3670
|
3670
|  60
60
-

Bộ đề thi học sinh giỏi môn Toán lớp 9 năm 2018-2019 có đáp án
 60 p |
60 p |  641
|
641
|  59
59
-

Bộ đề thi học sinh giỏi môn Lịch sử lớp 12 cấp tỉnh năm 2020-2021 có đáp án
 26 p |
26 p |  273
|
273
|  20
20
-

Bộ đề thi học sinh giỏi môn Toán lớp 9 năm 2017-2018 có đáp án
 82 p |
82 p |  348
|
348
|  14
14
-

Bộ đề thi học sinh giỏi môn Hóa học lớp 10 cấp trường năm 2020-2021 có đáp án
 40 p |
40 p |  184
|
184
|  14
14
-

Bộ đề thi học sinh giỏi môn Địa lí lớp 11 cấp trường năm 2020-2021
 18 p |
18 p |  152
|
152
|  13
13
-

Bộ đề thi học sinh giỏi cấp tỉnh môn Toán lớp 9
 263 p |
263 p |  19
|
19
|  6
6
Chịu trách nhiệm nội dung:
Nguyễn Công Hà - Giám đốc Công ty TNHH TÀI LIỆU TRỰC TUYẾN VI NA
LIÊN HỆ
Địa chỉ: P402, 54A Nơ Trang Long, Phường 14, Q.Bình Thạnh, TP.HCM
Hotline: 093 303 0098
Email: support@tailieu.vn









