S GIÁO D C VÀ ĐÀO T OỞ Ụ Ạ
THÀNH PH ĐÀ N NGỐ Ẵ H NG D N CH M Đ THI H C SINH GI I THÀNH PHƯỚ Ẫ Ấ Ề Ọ Ỏ Ố
NĂM H C 2006 - 2007Ọ
MÔN: HÓA H C L P 11Ọ Ớ
Th i gian: 150 phút (không k th i gian giao đ )ờ ể ờ ề
Đ CHÍNH TH CỀ Ứ
Đ này có hai (2) trangề
Câu I (4 đi m)ể
1. Tính pH c a dung d ch thu đ c khi tr n l n 50,0 mL dung d ch NHủ ị ượ ộ ẫ ị 4Cl 0,200 M v i 75,0 mLớ
dung d ch NaOH 0,100 M. Bi t Kị ế b (NH3) = 1,8.10-5.
2. Phèn là mu i sunfat kép c a m t cation hóa tr m t (nh Kố ủ ộ ị ộ ư + hay NH4+) và m t cation hóa tr baộ ị
(nh Alư3+, Fe3+ hay Cr3+). Phèn s t amoni có công th c (NHắ ứ 4)aFe(SO4)b.nH2O. Hòa tan 1,00 gam
m u phèn s t vào 100 cmẫ ắ 3 H2O, r i chia dung d ch thu đ c thành hai ph n b ng nhau. Thêmồ ị ượ ầ ằ
dung d ch NaOH d vào ph n m t và đun sôi dung d ch. L ng NHị ư ầ ộ ị ượ 3 thoát ra ph n ng v a đả ứ ừ ủ
v i 10,37 cmớ3 dung d ch HCl 0,100 M. Dùng k m kim lo i kh h t Feị ẽ ạ ử ế 3+ ph n hai thành Feở ầ 2+.
Đ oxi hóa ion Feể2+ thành ion Fe3+ tr l i, c n 20,74 cmở ạ ầ 3 dung d ch KMnOị4 0,0100 M trong môi
tr ng axit.ườ
(a) Vi t các ph ng trình ph n ng d ng ion thu g n và xác đ nh các giá tr a, b, n.ế ươ ả ứ ạ ọ ị ị
(b) T i sao các phèn khi tan trong n c đ u t o môi tr ng axit ? ạ ướ ề ạ ườ
ĐÁP ÁN ĐI MỂ
1.
M08,0
L125,0
L.mol200,0L050,0
C
1
o
ClNH4=
×
=−
;
M06,0
L125,0
L.mol100,0L075,0
C
1
o
NaOH =
×
=−
NH4Cl + NaOH → NaCl + NH3 + H2O
0,08 0,06
0,06 0,06 0,06
0,02 0 0,06
Xét cân b ng :ằ
NH3 + H2O ⇄ NH4+ + OH-
0,06 0,02
x x x
0,06–x 0,02+x x
5
3
4
b10.8,1
x06,0
x)x02,0(
]NH[
]OH][NH[
K−
−+ =
−
+
==
, g n đúng ầ
M10.4,5
02,0
06,0
10.8,1x 55 −− =×=
⇒
73,9)]10.4,5lg([14pH 5=−−= −
0,50
1,00
2. (a) Đ t s mol c a phèn s t (NHặ ố ủ ắ 4)aFe(SO4)b.nH2O trong m i ph n là x mol.ỗ ầ
Ph ng trình ph n ng ph n m t :ươ ả ứ ầ ộ
NH4+ + OH- → NH3 + H2O
ax
0 ax
Fe3+ + 3OH- → Fe(OH)3
NH3 + H+ → NH4+
ax ax
Ph ng trình ph n ng ph n hai :ươ ả ứ ầ
Zn + 2Fe3+ → Zn2+ + 2Fe2+
x
0 x
5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O
x x/5
10,25
1
Ta có :
mol10.037,1L.mol100,0L01037,0ax 31 −− =×=
mol10.037,1L.mol010,0L02074,05x 31 −− =××=
⇒a = 1
Công th c c a phèn đ c vi t l i là NHứ ủ ượ ế ạ 4+Fe3+(SO42-)b.nH2O
⇒b = 2
T M = 18 + 56 + 96.2 + 18n = ừ
mol10.037,1
gam5,0
3−
⇒n = 12
Công th c c a phèn s t – amoni là NHứ ủ ắ 4Fe(SO4)2.12H2O
(b) Phèn tan trong n c t o môi tr ng axit vì các ion NHướ ạ ườ 4+, Al3+, Fe3+ và Cr3+ đ uề
nh ng ion axit (các ion Kữ+ có tính trung tính, còn SO42- có tính baz r t y u).ơ ấ ế
NH4+ + H2O ⇄ NH3 + H3O+
M3+ + H2O ⇄ M(OH)2+ + H+
Câu II (4 đi m)ể
1. Vi t ph ng trình ph n ng x y ra khi l n l t cho các đ n ch t As và Bi tác d ng v i dungế ươ ả ứ ả ầ ượ ơ ấ ụ ớ
d ch HNOị3 (gi thi t s n ph m kh ch là khí NO).ả ế ả ẩ ử ỉ
2. So sánh (có gi i thích) tính tan trong n c, tính baz và tính kh c a hai h p ch t v i hidro làả ướ ơ ử ủ ợ ấ ớ
amoniac (NH3) và photphin (PH3).
3. M t giai đo n quan tr ng trong quá trình t ng h p axit nitric là oxi hóa NHộ ạ ọ ổ ợ 3 trong không khí, có
m t Pt xúc tác.ặ
(a) Xác đ nh nhi t ph n ng c a ph n ng này, bi t nhi t hình thành các ch t NHị ệ ả ứ ủ ả ứ ế ệ ấ 3 (k), NO (k)
và H2O (k) l n l t b ng – 46 kJ/mol; + 90 kJ/mol và - 242 kJ/mol.ầ ượ ằ
(b) Trong công nghi p, ng i ta đã s d ng nhi t đ và áp su t th nào đ quá trình này là t iệ ườ ử ụ ệ ộ ấ ế ể ố
u ? T i sao ?ư ạ
ĐÁP ÁN ĐI MỂ
1. Ph ng trình ph n ng :ươ ả ứ
3As + 5HNO3 + 2H2O → 3H3AsO4 + 5NO
Bi + 4HNO3 → Bi(NO3)3 + NO + 2H2O1,00
2. Tính tan :
NH3 tan t t h n PHố ơ 3 trong n c, do phân t phân c c h n và có kh năng t o liênướ ử ự ơ ả ạ
k t hidro v i n c.ế ớ ướ
H N
H
H
H O
H
H N
H
H
... ... ......
Tính bazơ :
NH3 có tính baz m nh h n PHơ ạ ơ 3, do liên k t N-H phân c c m nh h n liên k t P-H,ế ự ạ ơ ế
làm cho nguyên t N trong phân t NHử ử 3 giàu electron h n, d dàng nh n proton h nơ ễ ậ ơ
(m t nguyên nhân n a gi i thích cho đi u này là ion NHộ ữ ả ề 4+ b n h n PHề ơ 4+).
Tính khử :
PH3 có tính kh m nh h n nhi u so v i NHử ạ ơ ề ớ 3, do nguyên t P là m t phi kim có đử ộ ộ
âm đi n nh và phân t PHệ ỏ ử 3 kém b n h n NHề ơ 3.
2

3. (a) 4NH3 (k) + 5O2 (k) → 4NO (k) + 6H2O (k)
=∆−∆+∆=∆ 32 NHOHNO H4H6H4H
kJ908)kJ46(4[)]kJ242(6[)kJ904(H −=−×−−×+×=∆
(b) Vì ph n ng là t a nhi t, nên đ tăng hi u su t c n gi m nhi t đ . Tuy nhiênả ứ ỏ ệ ể ệ ấ ầ ả ệ ộ
n u h nhi t đ quá th p s làm gi m t c đ ph n ng, nên th c t ph n ng nàyế ạ ệ ộ ấ ẽ ả ố ộ ả ứ ự ế ả ứ
đ c ti n hành 850-900ượ ế ở oC và có xúc tác Pt. Vì ph n ng thu n là chi u làm tăngả ứ ậ ề
s phân t khí, nên đ tăng hi u su t ph n ng c n gi m áp su t. Tuy nhiên, đi uố ử ể ệ ấ ả ứ ầ ả ấ ề
ki n áp su t gây tăng giá thành công ngh s n xu t, nên ta ch dùng áp su t th ngệ ấ ệ ả ấ ỉ ấ ườ
(1 atm).
Câu III (4 đi m)ể
1. Dùng hình v , mô t thí nghi m đ c ti n hành trong phòng thí nghi m đ xác đ nh s có m tẽ ả ệ ượ ế ệ ể ị ự ặ
c a các nguyên t C và H có trong glucoz .ủ ố ơ
2. Hoàn thành các ph n ng d i đây. Xác đ nh s n ph m chính c a m i ph n ng và dùng c chả ứ ướ ị ả ẩ ủ ỗ ả ứ ơ ế
gi i thích s hình thành s n ph m chính đó.ả ự ả ẩ
(a) CH3-CH=CH2 (propilen) + HCl →
(b) CH3-CH2-CH(OH)-CH3 (ancol s-butylic)
→ C180,SOH o
42
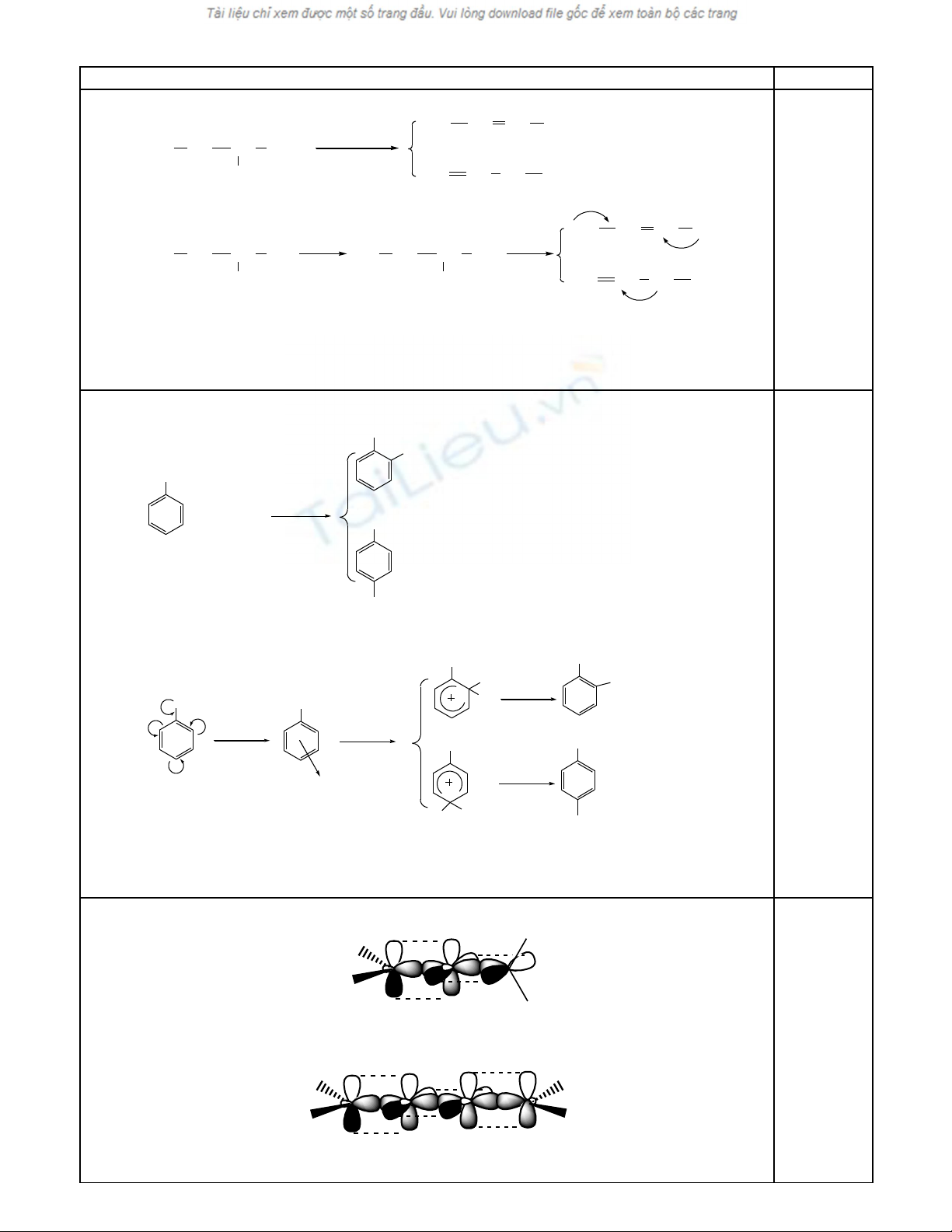
(c) C6H5CH3 + HNO3
→ o
42 t,SOH
3. Dùng s đ xen ph obitan nguyên t đ mô t các phân t CHơ ồ ủ ử ể ả ử 3-CH=C=CH-CH3 (phân t A) vàử
CH3-CH=C=C=CH-CH3 (phân t B). Cho bi t A, B có đ ng phân hình h c hay không ? T i sao ?ử ế ồ ọ ạ
ĐÁP ÁN ĐI MỂ
1. Thí nghi m xác đ nh s có m t c a các nguyên t C và H có trong glucoz :ệ ị ự ặ ủ ố ơ
1,5
2. Ph n ng và c ch ph n ng:ả ứ ơ ế ả ứ
(a) Ph n ng :ả ứ
CH
3
CH CH
2
+ HCl
CHCH
3
CH
3
Cl
CH
2
CH
3
CH
2
Cl
(s¶n phÈm chÝnh)
C ch (c ng Aơ ế ộ E) :
CH
3
CH CH
2
H
+
δ−
CH
3
CH CH
3
CH
3
CH
2
CH
2
Cl
-
CHCH
3
CH
3
Cl
(X)
(Y)
S n ph m chính hình thành theo h ng t o cacbocation trung gian b n v ngả ẩ ướ ạ ề ữ
h n. D th y r ng cacbocation (X) b n h n (Y) (do đi n tích đ c gi i t aơ ễ ấ ằ ề ơ ệ ượ ả ỏ
nhi u h n, v i 6Hề ơ ớ α), nên s n ph m chính là isopropyl clorua.ả ẩ
0,50
3
(b) Ph n ng :ả ứ
CH
3
CH
2
H
2
SO
4
(s¶n phÈm chÝnh)
CH CH
3
OH
CH
3
CH CH CH
3
+ H
2
O
CH
2
CH CH
2
CH
3
+ H
2
O
C ch (tách E1) :ơ ế
CH
3
CH
2
CH CH
3
OH
CH
3
CH CH CH
3
CH
2
CH CH
2
CH
3
H
+
CH
3
CH
2
CH CH
3
+
OH
2
-H
2
O
(X)
(Y)
S n ph m chính đ c hình thành theo h ng t o s n ph m b n h n. đây,ả ẩ ượ ướ ạ ả ẩ ề ơ Ở
(X) b n h n (Y) do có s nguyên t Hề ơ ố ử α tham gia liên h p, làm b n hóa liên k t πợ ề ế
nhi u h n. ề ơ
0,50
(c) Ph n ng :ả ứ
+ HONO
2
H
2
SO
4
+ H
2
O
CH
3
CH
3
NO
2
+ H
2
O
CH
3
NO
2
C ch (th Sơ ế ế E2Ar) : HONO2 + H2SO4 → HSO4- + H2O + +NO2
+
NO
2
+
NO
2
-H
+
CH
3
CH
3
CH
3
CH
3
-H
+
CH
3
CH
3
H
NO
2
HNO
2
NO
2
NO
2
Ph n ng d nh h ng th vào v trí ả ứ ị ướ ế ị meta-, do m t đ electron v trí này trongậ ộ ở ị
phân t toluen giàu h n các v trí ortho-, para-. Đ ng th i ph n ng th vào v tríử ơ ị ồ ờ ả ứ ế ị
này t o s gi i t a đi n tích t t nh t ph c π.ạ ự ả ỏ ệ ố ấ ở ứ
0,50
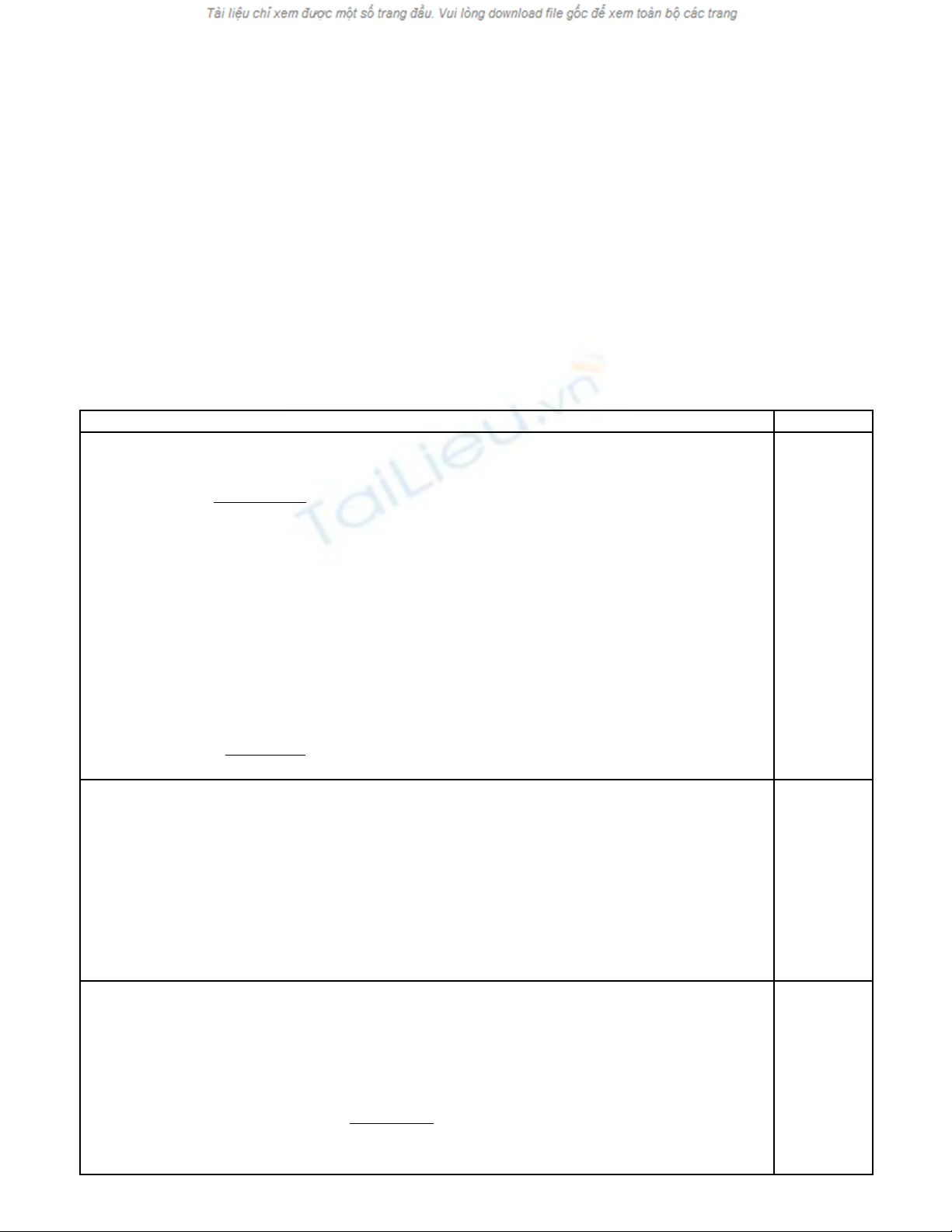
3. Mô hình phân t :ử
H
CH3
H
CH3
Trong tru ng h p này, các nhóm th không đ ng ph ng, nên phân t không xu tờ ợ ế ồ ẳ ử ấ
hi n hi n t ng đ ng phân hình h c.ệ ệ ượ ồ ọ
H
CH3
H
CH3
Trong tr ng h p này, các nhóm th đ ng ph ng, nên phân t xu t hi n hi n t ngườ ợ ế ồ ẳ ử ấ ệ ệ ượ
đ ng phân hình h c.ồ ọ
1,00
4
Câu IV (4 đi m)ể
1. Th i 672 mL (đktc) h n h p khí A g m m t ankan, m t anken và m t ankin (đ u có s nguyênổ ỗ ợ ồ ộ ộ ộ ề ố
t cacbon trong phân t b ng nhau) qua dung d ch AgNOử ử ằ ị 3/NH3, thì th y có 3,4 AgNOấ3 đã tham
gia ph n ng. Cũng l ng h n h p khí A trên làm m t màu v a h t 200 mL dung d ch Brả ứ ượ ỗ ợ ấ ừ ế ị 2 0,15
M.
(a) Xác đ nh thành ph n đ nh tính và đ nh l ng các ch t trong Aị ầ ị ị ượ ấ
(b) Đ ngh ph ng pháp tách riêng t ng ch t ra kh i h n h p A.ề ị ươ ừ ấ ỏ ỗ ợ
2. Oxi hóa m gam h p ch t h u c A b ng CuO r i cho s n ph m sinh ra g m COợ ấ ữ ơ ằ ồ ả ẩ ồ 2 và h i Hơ2O l nầ
l t đi qua bình 1 đ ng Mg(ClOượ ự 4)2 và bình 2 đ ng 2 lít Ca(OH)ự2 0,0 2 M thì thu đ c 2 gam k tượ ế
t a. Kh i l ng bình 1 tăng 1,08 gam và kh i l ng CuO gi m 3,2 gam, Mủ ố ượ ố ượ ả A < 100. Oxi hóa mãnh
li t A, thu đ c hai h p ch t h u c là CHệ ượ ợ ấ ữ ơ 3COOH và CH3COCOOH.
(a) Xác đ nh công th c c u t o và g i tên A.ị ứ ấ ạ ọ
(b) Vi t các d ng đ ng phân hình h c t ng ng c a A.ế ạ ồ ọ ươ ứ ủ
(c) Khi cho A tác d ng v i Brụ ớ 2 theo t l mol 1:1, thì t o đ c nh ng s n ph m nào ? Gi i thích.ỉ ệ ạ ượ ữ ả ẩ ả
ĐÁP ÁN ĐI MỂ
1. (a) N u ankin có d ng RCế ạ ≡CH :
RC≡CH + AgNO3 + NH3 → RC≡CAg + NH4NO3
⇒
mol02,0
mol/gam170
gam4,3
)ankin(n ==
và
mol04,0)ankin(n2n 2
Br =×≥
Đi u này trái gi thi t, vì s mol Brề ả ế ố 2 ch b ng ỉ ằ
mol03,0L/mol15,0L2,0
=×
V y ankin ph i là Cậ ả 2H2 và nh v y ankan là Cư ậ 2H6, anken là C2H4.
T ph n ng :ừ ả ứ
C2H2 + 2AgNO3 + 2NH3 → C2Ag2 + 2NH4NO3
⇒ n(C2H2) = 1/2n(AgNO3) = 0,01 mol
T các ph n ng :ừ ả ứ
C2H2 + 2Br2 → C2H2Br4
C2H4 + Br2 → C2H4Br2
⇒ n(C2H4) = 0,01 mol
⇒ n(C2H6) =
=−− mol01,0mol01,0
mol/L4,22
L672,0
0,01 mol
0,50
(b) Th i h n h p qua binh ch a dung d ch AgNOổ ỗ ợ ứ ị 3/NH3 d . L c tách k t t a, hòa tanư ọ ế ủ
k t t a trong dung d ch HCl d thu đ c khí Cế ủ ị ư ượ 2H2.
C2H2 + 2AgNO3 + 2NH3 → C2Ag2 + 2NH4NO3
C2Ag2 + 2HCl → C2H2 + 2AgCl
Khí ra kh i bình ch a dung d ch AgNOỏ ứ ị 3/NH3, th i ti p qua dung d ch n c brom d .ổ ế ị ướ ư
Chi t l y s n ph m và đun nóng v i b t Zn (trong CHế ấ ả ẩ ớ ộ 3COOH) thu đ c Cượ 2H4 :
C2H4 + Br2 → C2H4Br2
C2H4Br2 + Zn → C2H4 + ZnBr2
Khí ra kh i bình ch a dung d ch brom là khí Cỏ ứ ị 2H6
1,00
2. (a) n(H2O) = 0,06 mol ⇒ n(H) = 0,12 mol
T các ph n ng :ừ ả ứ
CO2 + Ca(OH)2 → CaCO3 + H2O
2CO2 + Ca(OH)2 → Ca(HCO3)2
v i ớ
mol045,0n 2
)OH(Ca =
và
mol02,0n 3
CaCO =
⇒ n(CO2) b ng 0,02 mol ho c 0,07 mol.ằ ặ
n(O) tham gia ph n ng b ng ả ứ ằ
mol2,0
mol/gam16
gam2,3 =
V y s mol O trong A b ng :ậ ố ằ
5






















![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



