
TRƯỜNG THPH NGUYỄN HUỆ ĐỀ THI HỌC SINH GIỎI 2009-2010
Tổ Hóa
Môn : Hóa học- khối 11
Thời gian làm bài :120 phút
Mã đề 657
Họ và tên:……………………………………… …SBD…………………
Câu 1 : Cho bari kim loại vào năm ống nghiệm đựng các dung dịch riêng rẽ sau: NaCl, NH4Cl,
FeCl3, AlCl3, (NH4)2CO3. Nhận xét các hiện tượng và viết các phương trình pư xảy ra.
Câu 2: Hòa tan hốn hợp FeCO3 và Fe3O4 trong dd HNO3 khi đun nóng đc khí A và dd B. Khí A
hóa nâu 1 phần trong không khí và có khả năng làm đục nước vôi trong. DD B t/d với dd NH3
cho kết tủa khi nung ở t0 cao tạo ra bột màu đỏ nâu. Viết các pt pư.
Câu 3: Một hh A gồm 2 khí N2 và H2 theo tỉ lệ mol 1:3 . Tạo pư giữa N2 và H2 cho ra NH3. Sau
pứ thu đc hỗn hợp khí B. Tỉ khối hơi của A đối với B là dd A/B = 0,6. Tính hiệu suất pứ tổng
hợp NH3.
Câu 4: Phải lấy dd axit mạnh PH=5 và dd bazo mạnh pH=9 theo tỉ lệ thể tích nào để đc dd có
pH =8.
Câu 5: Cho 3,58g hỗn hợp X hồm Al, Fe và Cu vào 200ml dd Cu(NO3)2 0,5M, đến khi kết thúc
pứ thu đc dd A và chất rắn B. Nung B trong không khí ở nhiệt độ cao đến pứ xảy ra hoàn toàn
có đc 6,4g chất rắn. Cho dd A t/d với dd NH3 dư, lọc lấy kết tủa đem nung trog không khí đến
khối lượng không đổi đc 2.62g chất rắn D. Tính khối lượng mỗi KL trong hh X.
Câu 6: Cho một bình kín dung tích 112 lít trong đó chứa N2 và H2 theo tỉ lệ thể tích 1 : 4 ở t0=
O0C và áp suất 200atm với 1 ít chất xúc tác thích hợp. Nung nóng bình 1 thời gian, sau đó đưa
vầ nhiệt độ OoC thấy áp suất trong bình giảm 10% so với áp suất ban đầu.
1. Tính hiệu suất pư điều chế NH3
2. Nếu lấy 12,5% lượng NH3 tạo thành có thể điều chế đc bao nhiu lít dd NH3 25 (d = 0,907
g/ml)?.
3. Nếu lấy 50% lượng NH3 tạo thành có thể điều chế đc bao nhiêu lít dd HNO3 67% (d= 1,40
g/ml), biết hiệu suất quá trình điều chế HNO3 là 80%
4. Lấy một thể tích dd HNO3 67% ở trên pha loãng bằng nước đc dd mới, dd này hòa tan vừ đủ
9g Al và giải phóng hỗn hợp khí NO và N2O có tỉ khối so với H2 là 16,75. Tính thể tích dd
HNO3 67% đã dùng.
-----------------------------------hết----------------------------------

Së gd & ®t nghÖ an k× thi chän hsg trêng
Trêng thpt b/c thanh ch¬ng n¨m häc 2009 - 2010
m«n ho¸ häc : líp 11
Thêi gian : 90 phót (kh«ng kÓ thêi gian giao ®Ò)
C©u I: ( 2 ®iÓm)
1, Dung dÞch CH3COOH 0,1M cã ®é ®iÖn li α = 1,39%
a, X¸c ®Þnh gi¸ trÞ pH vµ Ka cña dung dÞch trªn.
b, CÇn pha lo·ng dung dÞch trªn bao nhiªu lÇn ®Ó cho ®é ®iÖn li t¨ng lªn 4 lÇn?
2, a, Qu¸ tr×nh ®iÒu chÕ NH3 trong c«ng nghiÖp ngêi ta dïng ph¶n øng:
N2 + 3H2t0, xt 2NH3
H<0
§Ó ph¶n øng trªn thu ®îc lîng NH3 lín nhÊt th× cÇn ph¶i thay ®æi c¸c ®iÒu
kiÖn nhiÖt ®é, ¸p suÊt nh thÕ nµo?T¹i sao nhiÖt ®é cña ph¶n øng dõng l¹i kho¶ng
4500C – 5000C ?
b, Tèc ®é ph¶n øng sÏ t¨ng bao nhiªu lÇn khi t¨ng nhiÖt ®é tõ 200C lªn 600C.
BiÕt cø t¨ng 100C th× tèc ®é ph¶n øng t¨ng lªn 2 lÇn.
C©u II. (2 ®iÓm)
Dung dÞch A gåm x mol CO32-, y mol SO32-, z mol SO42-, 0,1 mol HCO3- vµ 0,3 mol
Na+. Cho vµo dung dÞch A V lÝt Ba(OH)21M. X¸c ®Þnh V ®Ó thu ®îc lîng kÕt tña lµ
lín nhÊt.
C©u III: ( 3 ®iÓm)
Nung 16,8 gam hçn hîp X gåm MgCO3 vµ CaCO3 ®Õn khèi lîng kh«ng ®æi, råi dÉn
khÝ thu ®îc vµo 180 ml dung dÞch Ba(OH)2 1M th× thu ®îc 33,49 gam kÕt tña. X¸c
®Þnh thµnh phÇn phÇn tr¨m khèi lîng c¸c chÊt trong X.
C©u IV: ( 3 ®iÓm)
Hçn hîp X gåm Fe vµ kim lo¹i R cã ho¸ trÞ kh«ng ®æi. Trén ®Òu vµ chia 15,06 gam
hçn hîp X thµnh 2 phÇn b»ng nhau.
- Hoµ tan phÇn mét b»ng HCl d thu ®îc 3,696 lÝt khÝ H2 .
- PhÇn hai t¸c dông hÕt víi dung dÞch HNO3 lo·ng thu ®îc 3,36 lÝt khÝ NO lµ
s¶n phÈm khö duy nhÊt ( c¸c thÓ tÝch ®o ë ®ktc)
1, X¸c ®Þnh kim lo¹i R?
2, Nhá dung dÞch NaOH vµo dung dÞch muèi clorua ë trªn ®Õn khi thÊy ph¶n øng
kh«ng cßn x¶y ra n÷a th× thÓ tÝch NaOH cÇn dïng lµ 600 ml . Läc lÊy kÕt tña ®em nung
trong kh«ng khÝ ®Õn khèi lîng kh«ng ®æi thu ®îc m gam chÊt r¾n. X¸c ®Þnh nång ®é
mol/l cña NaOH ®· dïng vµ gi¸ trÞ cña m?
( cho Fe =56, Na= 23, Al=27, Zn =65, Cr =52, Cu=64, O =16, H=1, N= 14, Ag =108, Mg
= 24, Ca = 40 )
Hä tªn thÝ sinh:..............................................Sè b¸o danh:.......................

§¸p ¸n: Thi HSG trêng khèi 11
M«n : Ho¸ Häc
C©u
®¸p ¸n
®iÓm
I
1, a,PT ®iÖn li : CH3 COOH ↔CH3COO- + H+ (1)
Víi α = 1,39% nªn [CH3COOH] ph©n li =
100
1,039,1 x
= 0,00139 M
Theo ph¬ng tr×nh 1 th× [H+] = 0,00139 = 1,39.10-3M
TÝnh pH = 3 - lg(1,39) = 2,857
TÝnh KC: KC =
cb
COOHCH
HxCOOCH
][
][][
3
3
=
)00139,01,0(
)00139,0()00139,0(
x
= 1,96.10-5
b, Khi pha lo·ng th× ®é ®iÖn li t¨ng lªn
sö dông c«ng thøc: α =
0
C
KC
Víi nång ®é [CH3COOH] = C0 , sau khi pha lo·ng [CH3COOH] = C1
®é ®iÖn li sau khi pha lo·ng gÊp 4 lÇn ®é ®iÖn li ban ®Çu
<=>
0
C
KC
= 4
1
C
KC
<=>
0
C
KC
=
1
C
KC
BiÕn ®æi biÓu thøc trªn ta thu ®îc V1 = 16V0. Nh vËy khi pha lo·ng
gÊp 16 lÇn th× tèc ®é p/ø t¨ng thªm 4 lÇn.
2.
a, Ph¬ng tr×nh : N2 + 3H2t0, xt 2NH3
§Ó thu ®îc lîng NH3 lín cã nghÜa lµ ®Ó p/ø diÔn ra theo chiÒu thuËn
( chiÒu ph¶n øng to¶ nhiÖt vµ cã sè mol khÝ gi¶m) th× cÇn t¨ng ¸p su©t
vµ gi¶m nhiÖt ®é cña p/ø
NÕu nhiÖt ®é h¹ thÊp h¬n th× p/ø diÔn ra theo chiÒu thuËn nhng khi ®ã
tèc ®é p/ø diÔn ra chËm v× N2 rÊt bÒn ë nhiÖt ®é thÊp
b,Sö dông c«ng thøc
t
t
v
v10
=
10 12 TT
khi ®ã ta cã:
t
t
v
v10
=
10
2060
2
= 16. VËy khi nhiÖt ®é t¨ng lªn 400C th× tèc
®é p/ø t¨ng lªn 16 lÇn.
0,25®
0,25®
0,5®
0,5®
0,5®
II
Khi cho Ba(OH)2 vµo dung dÞch A th× :
Ba(OH)2-> Ba2+ + 2OH- (1)
Khi ®ã cã c¸c PTHH x¶y ra: OH- + HCO3--> CO32- + H2O (2)
Ba2+ + CO32- -> BaCO3↓ (3)
Ba2+ + SO32- -> BaSO3↓ (4)
Ba2+ + SO42- -> BaSO4↓(5)
Trong dd A ¸p dông ®Þnh luËt b¶o toµn ®iÖn tÝch ta cã:
Na
n
= 2(
2
3
CO
n
+
2
3
SO
n
+
2
4
SO
n
) +
3
HCO
n
<=> 0,3 = 2( x+y +z) + 0,1
0,5 ®
0,5®
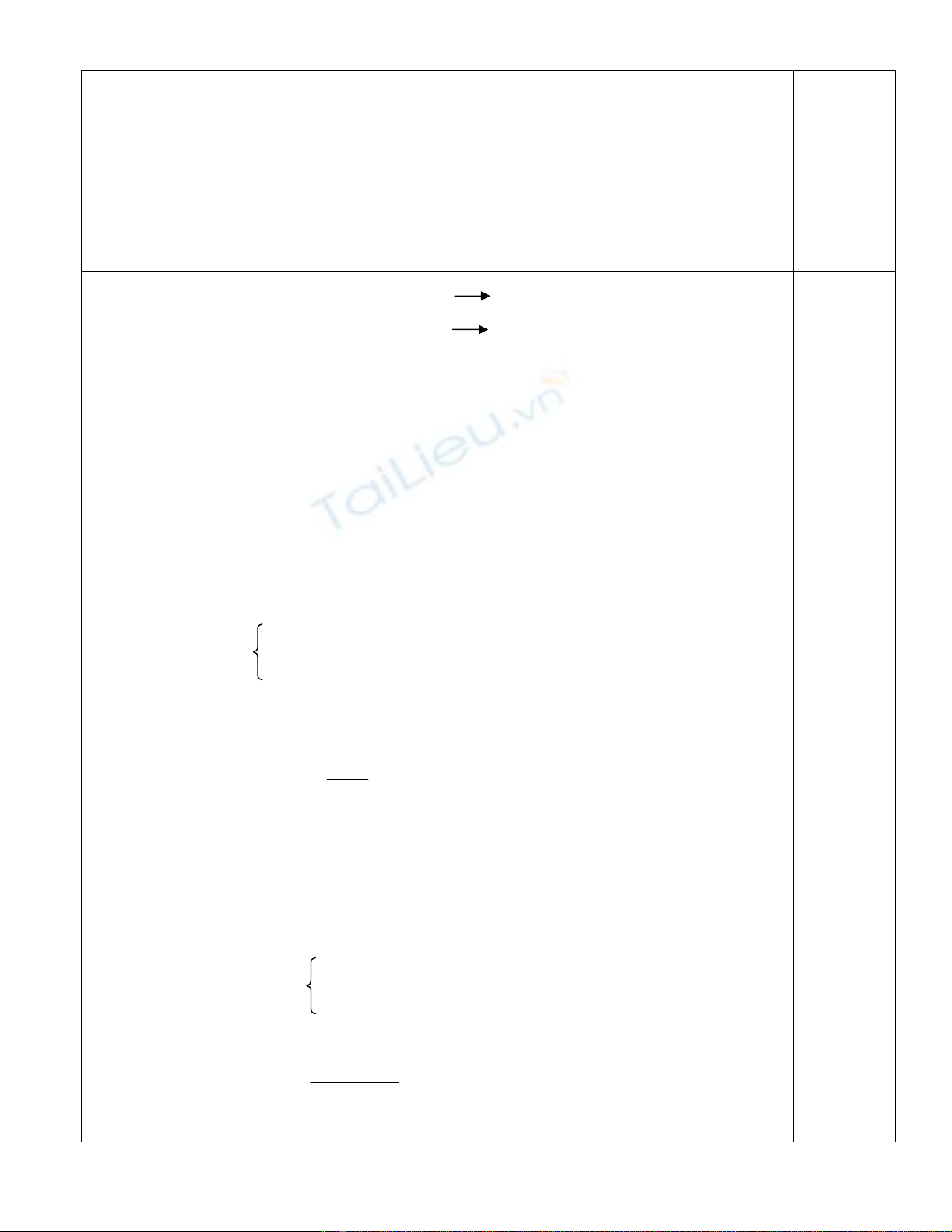
=> x + y +z = 0,1 mol
Theo c¸c PT trªn ta cã ®Ó thu ®îc lîng kÕt tña lín nhÊt th× lîng
Ba2+ ph¶i ph¶n øng hÕt ë p/ø 3,4,5
Khi ®ã theo pt 2 ta cã
2
Ba
n
=
2
3
CO
n
+
2
3
SO
n
+
2
4
SO
n
= 0,1 + x + y + z =
0,2 mol.
Khi ®ã
2
)(OHBa
n
=
2
Ba
n
= 0,2 mol. => VBa(OH)2 = 0,2/1 = 0,2 lÝt
0,5 ®
0,5 ®
III
Ta cã c¸c ph¬ng tr×nh: MgCO3 t0 MgO + CO2 (1)
CaCO3t0 CaO + CO2 (2)
Khi cho CO2 vµo dung dÞch Ba(OH)2 th× cã c¸c p/ø x¶y ra:
CO2 + Ba(OH)2-> BaCO3↓+ H2O (3)
2CO2 + Ba(OH)2-> Ba(HCO3)2 (4)
Mµ nBa(OH)2 = 0,18 mol
Trêng hîp 1: NÕu chØ x¶y ra p/ø 3 th× ta cã nCO2=nBaCO3 = 0,17
mol.
Khi ®ã Ba(OH)2 d = 0,1 mol.
Nh vËy nCO2 sinh ra ë 1,2 = 0,17 mol
Ta cã hÖ 84x + 100y = 16,8 gam
x + y = 0,17
=> y = 0,1575 mol, x = 0,0125 mol
VËy mCaCO3 = 0,1575 . 100 = 15,75 gam
%mCaCO3 =
%100
8,16
75,15
= 93,75%
%mMgCO3 = 100% - 93,75% = 6,25%
Trêng hîp 2: NÕu X¶y ra c¶ 2 p/ø 3,4 th×
nCO2 =nBaCO3 + 2 nBa(OH)2 (ë 4)
= 0,17 + 2 ( 0,18 -0,17) = 0,19 mol
V©y ta cã hÖ : 84x + 100y = 16,8 gam
x + y = 0,19
=> y = 0,0525 mol, x= 0,1375 mol
VËy %mCaCO3 =
%100
8,16
1000525,0 x
= 31,25%
=> %mMgCO3 = 100% - 31,25% = 68,75%
ViÕt
®îc
ph¬ng
tr×nh cho
0,5 ®iÓm
tÝnh
®îc
tr/hîp 1
cho 1,5
®iÓm.
Trêng
hîp 2
cho 1
®iÓm

IV
1, Ph¬ng tr×nh p/ø: ë phÇn 1
Fe + 2HCl -> FeCl2 + H2 (1)
2R + 2nHCl -> 2RCln + nH2 (2)
Theo bµi ra : nH2 = 0,165 mol
PhÇn 2: Fe + 4HNO3-> Fe(NO3)3 + NO + 2H2O (3)
3R + 4nHNO3-> 3R(NO3)n + nNO + 2nH2O (4)
Ta cã nNO= 0,15 mol
Sö dông b¶o toµn electron ta cã :
®Æt sè mol Fe vµ R trong mçi phÇn lµ x vµ y , khi ®ã ta cã
PhÇn 1: 2x + ny = 0,165x2= 0,33 mol
PhÇn 2: 3x + ny = 0,15x3 = 0,45 mol
x = 0,12 mol . ny = 0,09 mol
Nh vËy mFe = 0,12x2x56 = 13,44 gam
mR = 15,06 – 13,44 = 1,62 gam
MR=
09,02
62,1
x
x n = 9n
BiÖn luËn víi n ≤3 nªn n= 3 t/m => R lµ nh«m ( M = 27)
2, Trong mçi phÇn ta cã nFe = 0,12 mol, nAl = 0,03 mol
Khi nhá dd NaOH vµo dd muèi FeCl2 vµ AlCl3 ®Õn khi p/ø kh«ng cßn
diÔn ra n÷a th× ta cã c¸c p/ø lµ:
FeCl2 + 2NaOH -> 2NaCl + Fe(OH)2↓ (5)
AlCl3 + 3NaOH -> 3NaCl + Al(OH)3 (6)
Vµ Al(OH)3 + NaOH -> NaAlO2 + 2H2O (7)
Nh vËy kÕt tña cßn l¹i lµ Fe(OH)2
Khi nung trong kh«ng khÝ ®Õn khèi l¬ng kh«ng ®æi th× cã p/ø x¶y ra
Fe(OH)2 t0 FeO + H2O (8)
4FeO + O2-> 2Fe2O3(9)
VËy nNaOH ®· p/ø = 2nFeCl2 + 4nAlCl3 = 2.0,12 + 4. 0,03 = 0,36 mol.
VNaOH cÇn dïng =
6,0
36,0
= 0,6 mol/lÝt
nFe2O3= 2nFe(OH)2 = 0,12 x1/2 = 0,06 mol => mchÊt r¾n = 160x0,06 = 9,6 g
Gi¶i t×m
®îc kim
lo¹i R
cho 2
®iÓm
Gi¶i ®îc
c©u 2 cho
1 ®iÓm
NÕu HS gi¶i ®óng mµ kh«ng theo ph¬ng ph¸p trªn th× vÉn cho ®iÓm tèi ®a










![Đề Thi Học Sinh Giỏi Hóa 11 Thành Phố Đà Nẵng [2005-2006] - Tuyển Tập Đề Thi](https://cdn.tailieu.vn/images/document/thumbnail/2010/20100913/trungtran5/135x160/_hoahoc11_thihsgthanhphodanang_2006_2007_4413.jpg)











![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



