TRƯỜNG THPT BẮC THĂNG LONG
Tổ Hóa – Sinh – TD - KTNN
ĐỀ CƯƠNG HỌC KÌ I NĂM HỌC 2024 – 2025
MÔN HÓA HỌC LỚP 10
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 39. Mỗi câu
hỏi thí sinh chỉ chọn một phương án.
Câu 1. Nguyên tử gồm hạt nhân và vỏ nguyên tử. Vỏ nguyên tử chứa loại hạt nào sau đây?
A. Proton.
B. Electron.
C. Proton và neutron.
D. Neutron.
Câu 2. Dựa vào mô hình nguyên tử Rutherford – Bohr, hãy cho biết phát biểu nào sau đây là đúng.
A. Số lượng electron tối đa trên các lớp là như nhau.
B. Năng lượng của các electron trên các lớp khác nhau có thể bằng nhau.
C. Khi quay quanh hạt nhân theo một quỹ đạo xác định, năng lượng của electron là không đổi.
D. Electron ở gần hạt nhân nhất có năng lượng cao nhất
Câu 3. Cấu hình electron của nguyên tử Al (Z = 13) là
A. 1s22s22p63p3.
B. 1s22s22p53s23p2.
C. 1s22s22p62d3.
D. 1s22s22p63s23p1.
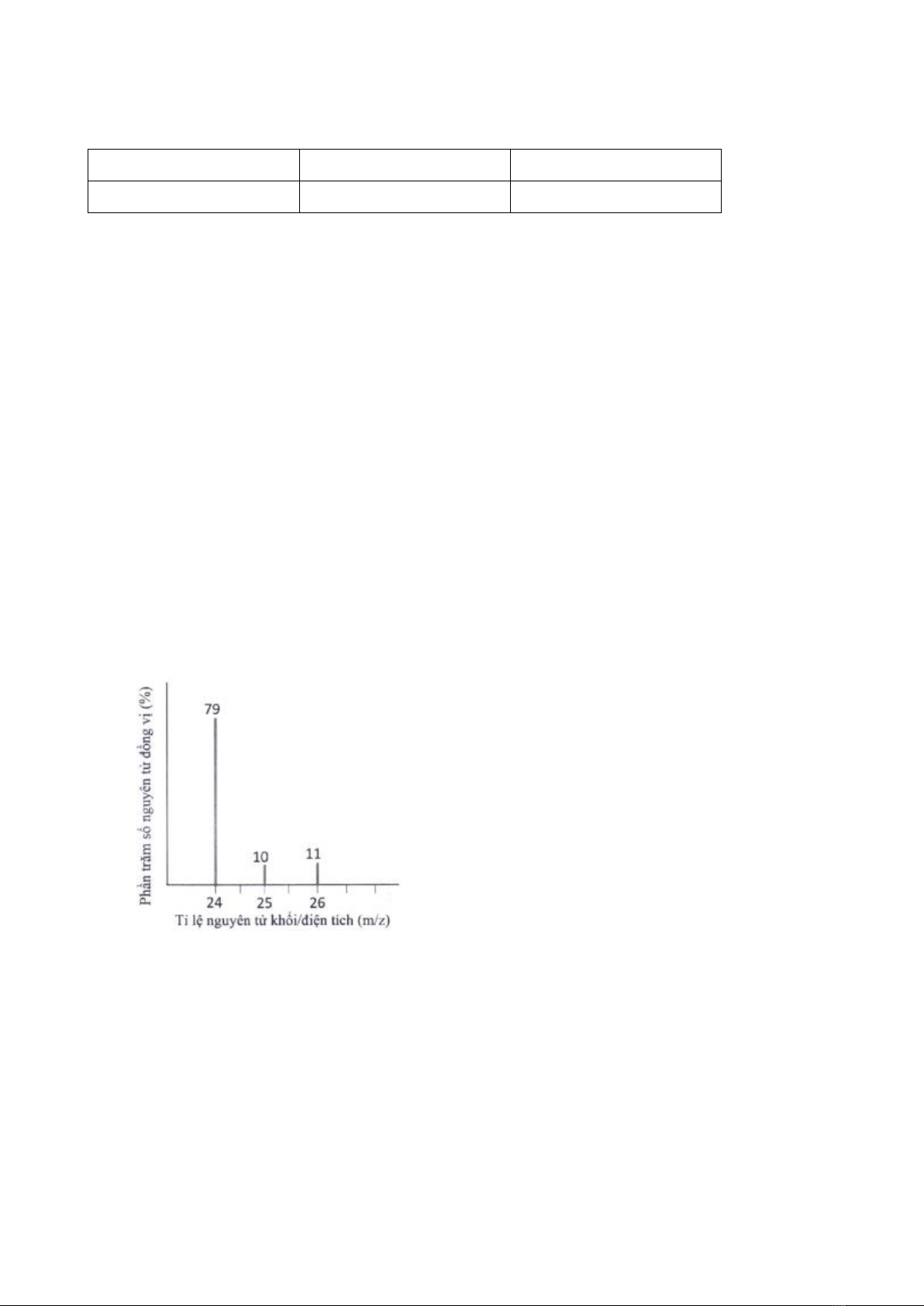
Câu 4. Các nguyên tử của cùng một nguyên tố hoá học là đồng vị của nhau có sự khác nhau về:
A. số neutron.
B. số proton.
C. số electron.
D. điện tích hạt nhân.
Câu 5. Lớp L có số phân lớp electron bằng
A. 1 B. 2. C. 3. D. 4.
Câu 6. Nguyên tử của nguyên tố A có 56 electron, trong hạt nhân có 81 neutron. Kí hiệu của nguyên tử
nguyên tố A là
A. 𝐴
56
137 . B. 𝐴
137
56 . C. 𝐴
56
81 . D. 𝐴
81
56
Câu 7. Có 3 nguyên tử: 𝑋
6
12 , 𝑌
7
14 , 𝑍
6
14 . Những nguyên tử nào là đồng vị của một nguyên tố?
A. X, Y. B. Y, Z C. X, Z. D. X, Y, Z.
Câu 8. Bảng tuần hoàn hiện nay không áp dụng nguyên tắc sắp xếp nào sau đây?
A. Mỗi nguyên tố hoá học được xếp vào một ô trong bảng tuần hoàn.
B. Các nguyên tố được sắp xếp theo chiều tăng dần khối lượng nguyên tử.
C. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
D. Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành một cột.
Câu 9. Lưu huỳnh (sulfur, S) thuộc nhóm VIA trong bảng tuần hoàn các nguyên tố hóa học. Công thức
của sulfuric acid (tương ứng với oxide cao nhất của S) là
A. H2S.
B. SO3.
C. H2SO3.
D. H2SO4.
Câu 10. Nguyên tố silicon (Si) thuộc chu kì 3, nhóm IVA trong bảng tuần hoàn các nguyên tố hoá học.
Công thức oxide cao nhất của silicon là
A. SiO2.
B. SiO.
C. H2SiO3.
D. SiH4.
Câu 11. Trong bảng tuần hoàn các nguyên tố hóa học, các nguyên tố khí hiếm thuộc nhóm
A. IA.
B. VIIIA.
C. IIA.
D. VIIA.
Câu 12. Trong một chu kì của bảng tuần hoàn các nguyên tố hóa học, theo chiều tăng dần điện tích hạt
nhân, bán kính nguyên tử của các nguyên tố giảm dần do số lớp electron...(I), lực hút giữa hạt nhân với
electron lớp ngoài cùng...(II). Cụm từ cần điền vào (I), (II) lần lượt là:
A. tăng dần, tăng dần.
B. giảm dẫn, giảm dần.
C. không đổi, tăng dần.
D. không đổi, giảm dần.
Câu 13. Hình bên biểu diễn hình dạng orbital nguyên tử (AO) nào sau đây?