TRƯỜNG THCS PHƯỚC HƯNG
ĐỀ CƯƠNG ÔN TẬP KIỂM TRA CUỐI HỌC KÌ I – NĂM HỌC 2020-2021 MÔN: HÓA HỌC 9
A. LÝ THUYẾT: 1. Tính chất hóa học của các loại hợp chất vô cơ
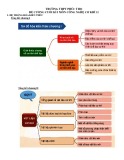
SƠ ĐỒ MỐI QUAN HỆ GIỮA CÁC LOẠI HỢ CHẤT VÔ CƠ
2. Tính chất hóa học của kim loại
+ phi kim oxi oxit kim loại
PTHH: 3Fe + 2O2 Fe3O4
Phi kim khác muối
KIM LOẠI
PTHH: 2Al + 3Cl2 2AlCl3
+ dd axit → muối + H2 (PƯ thế) PTHH: Zn + 2HCl → ZnCl2 + H2 + dd muối → muối mới + kim loại mới (PƯ thế) PTHH: Fe + CuSO4 → FeSO4 + Cu 3. Dãy hoạt động hóa học của kim loại
(1) Mức độ hoạt động hóa học giảm dần
(2) Kim loại đứng trước đẩy được KL đứng sau ra khỏi dd muối
K , Na , Mg , Al , Zn , Fe , Pb , (H ), Cu , Ag , Au
(3)+ H2O
(4) + dd HCl, H2SO4 loãng tạo ra H2
Lưu ý: H2 Không khử được các oxit kim loại của kim loại hoạt động hóa học mạnh từ Al trở về trước 4. Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn a) Thế nào là sự ăn mòn kim loại Ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim do tác dụng của các chất trong môi
trường. b) Biện pháp bảo vệ kim loại không bị ăn mòn
1. Ngăn không cho kim loại tiếp xúc với môi trường 2. Chế tạo các hợp kim ít bị ăn mòn: Inox, hợp kim nhôm… 5. Phi kim – Clo
1
a. Phi kim: - Tính chất vật lý:
Ở nhiệt độ thường, phi kim tồn tại ở ba trạng thái: + Rắn: C, S, P, . . . + Lỏng: Br2, . . . + Khí: O2, Cl2, H2, N2, . . . Phần lớn các nguyên tố phi kim không dẫn điện, không dẫn nhiệt và có nhiệt độ nóng chảy thấp. Một số phi kim độc như: Cl2, Br2, I2. - Tính chất hóa học
oxi + kim loại oxit kim loại
2CuO PTHH: 2Cu + O2
Phi kim khác + kim loại muối
Phi kim
2NaCl PTHH: 2Na + 3Cl2
+ H2 → hợp chất khí
2HCl PTHH: H2 + Cl2
+ O2 → oxit axit
PTHH: S + O2 SO2
b. Clo - Tính chất vật lí: Clo là chất khí, màu vàng lục, mùi hắc, nặng gấp 2,5 lần không khí, tan được trong nước. Clo là một khí độc. - Tính chất hóa học:
+ H2 → khí hiđro clorua PTHH: Cl2 + H2
2HCl
Tính chất của phi kim
+ kim loại → muối clorua PTHH: 2Fe + 3Cl2 Cu + Cl2
2FeCl3 CuCl2
+ H2O → axit clohiđric + axit hipoclorơ
Cl2
PTHH: Cl2 + H2O
HCl + HClO
+ dd NaOH → natri clorua + natri hipoclorit
PTHH: Cl2 + 2NaOH → NaCl + NaClO + H2O
Tính chất riêng của Cl2
Nước Gia-ven
Chú ý: Cl2 không phản ứng trực tiếp với O2 - Điều chế:
MnCl2 + Cl2 + 2H2O
+ Trong phòng thí nghiệm: + Trong công nghiệp: 4HCl(đặc) + MnO2 2NaCl + 2H2O Cl2 + H2 + 2NaOH
2
B. BÀI TẬP Câu 1: So sánh TCHH của nhôm và sắt. Câu 2: Vì sao nhôm hoạt động hóa học mạnh hơn sắt nhưng những dụng cụ làm bằng nhôm bền hơn các dụng cụ làm từ sắt? Câu 3: Sự ăn mòn kim loại là gì? Em hãy đề ra một số biện pháp hạn chế sự ăn mòn kim loại. Câu 4: Cho các kim loại: Mg, Na, Zn, Cu, Fe, Ag, Al.
a. Hãy sắp xếp các kim loại trên theo chiều tăng dần mức độ hoạt động hóa học từ
trái sang phải.
b. Kim loại nào tác dụng với dd H2SO4. c. Kim loại nào tác dụng được với cả H2O và dd HCl Viết PTHH.
Al
Al(OH)3
Al2O3
AlCl3 Fe(NO3)2
Al2(SO4)3 FeCl2
Fe2O3 CuO
Fe CuSO4
CuCl2
AlCl3 FeCl3 CuCl2 Cu
Fe(OH)3 Cu(OH)2 CuO
Cu
Câu 5: Bằng phương pháp hóa học hãy nhận biết: a) 3 Chất rắn: Cu, Al, Fe. b) 3 dung dịch: Na2CO3; BaCl2, CuCl2. c) 3 chất khí: Clo, hiđro clorua, oxi. Câu 6: Viết PTHH thực hiện dãy chuyển hóa sau: a) Al b) Fe c) Cu Cu(NO3)2 Câu 7: Hòa tan 15g hỗn hợp 2 kim loại đồng và sắt vào dung dịch H2SO4 loãng dư, sau phản ứng kết thúc thu được 2,24 lít khí (đktc) và một chất rắn không tan. a. Tính khối lượng chất rắn không tan. b. Lọc lấy chất rắn trên cho vào 200 ml dung dịch AgNO3. Sau khi phản ứng kết thúc, khối lượng chất rắn tăng thêm 15,2 gam. Tính nồng độ mol của dung dịch AgNO3 đã dùng.
a. khối lượng đồng tạo thành. b. nồng độ mol của dung dịch đồng (II) clorua đã dùng.
Câu 8: Hòa tan 4,5g hỗn hợp (Al, Mg) trong dd H2SO4 loãng dư thấy có 5,04 lít khí hiđro thoát ra (ở đktc). a) Viết PTHH. b) Tính thành phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp. Câu 8: Ngâm một đinh sắt nặng 20 gam vào 200ml dd đồng (II) clorua sau một thời gian lấy đinh sắt ra, rửa nhẹ, sấy khô, cân nặng 21,6 gam. Tính: Giả sử đồng sinh ra bám hết vào sắt.
3
C. ĐỀ THAM KHẢO
C. Mg, Al, Na
D. Pb, Al, Mg
B. Al, Zn, Na
C. Fe
B. Al
D. Cu
B. Dung dịch H2SO4 loãng D. Dung dịch HNO3 loãng .
B. Khí không màu và không mùi thoát ra D. Không có hiện tượng
D. rắn, lỏng, khí.
B. rắn và lỏng.
C. rắn và khí.
B. C, S, Br2, Cl2. C. Cl2, H2, N2, O2. D. Br2, P, N2, O2.
D. C, Cl2, Br2.
B. S, P, Cl2.
C. Si, P, Br2.
C. Br2, C, O2.
B. H2, S, O2.
D. N2, S, O2.
ĐỀ THAM KHẢO KIỂM TRA HỌC KỲ I MÔN: HOÁ 9 Thời gian: 45 phút I – TRẮC NGHIỆM: (5,0 điểm) Chọn và khoanh tròn trước phương án trả lời đúng nhất trong các câu sau Câu 1. Dãy kim loại được sắp xếp theo chiều hoạt động hóa học tăng dần: A. Na, Mg, Zn Câu 2. Có một mẫu dung dịch Al2(SO4)3 bị lẫn tạp chất là FeSO4, có thể làm sạch mẫu dung dịch này bằng kim loại A. Zn Câu 3. Có một mẫu Fe bị lẫn tạp chất là nhôm, để làm sạch mẫu sắt này bằng cách ngâm nó với A. Dung dịch NaOH dư C. Dung dịch HCl dư Câu 4. Hiện tượng gì xảy ra khi cho 1 thanh đồng vào dung dịch H2SO4 loãng? A. Thanh đồng tan dần, khí không màu thoát ra B. Thanh đồng tan dần, dung dịch chuyển thành màu xanh lam C. Không hiện tượng D. Có kết tủa trắng. Câu 5. Hiện tượng xảy ra khi cho 1 lá nhôm vào dung dịch H2SO4 đặc, nguội: A. Khí mùi hắc thoát ra C. Lá nhôm tan dần Câu 6: Ở điều kiện thường, phi kim có thể tồn tại ở trạng thái A. lỏng và khí. Câu 7: Dãy gồm các phi kim thể khí ở điều kiện thường A. S, C, N2, Cl2. Câu 8: Dãy phi kim tác dụng với oxi tạo thành oxit axit A. S, C, P. Câu 9: Dãy phi kim tác dụng được với nhau là A. S, Cl2, O2. Câu 10: Sau khi làm thí nghiệm, khí clo dư được loại bỏ bằng cách sục khí clo vào:
D. Nước.
C. Dung dịch NaCl.
B. Dung dịch NaOH.
Al
Al(OH)3
Al2O3
AlCl3
A. Dung dịch HCl. II – TỰ LUẬN (5,0 điểm) Câu 11: (0,75 điểm) Có nên sử dụng dụng cụ bằng nhôm để đựng nước vôi hoặc hồ xây dựng không? Giải thích. Câu 12: (0,75 điểm) Bằng phương pháp hóa học hãy nhận biết ba kim loại: Ag, Al, Mg. Câu 13: (2,0 điểm) Viết PTHH thực hiện dãy chuyển hóa sau: Al Câu 14: (1,5 điểm) Hòa tan 19,4 gam hỗn hợp bột 2 kim loại đồng và magie trong dung dịch axit sunfuric 10%. Sau khi phản ứng kết thúc thu được 4,48 lít khí hiđro (đo ở đktc) và 6,4 gam chất rắn. Tính: a) Thành phần % theo khối lượng mỗi kim loại trong hỗn hợp ban đầu. b) Khối lượng của dung dịch axit đã dùng.
Biết: Cu = 64, Mg = 24, H = 1, S = 32, O = 16. ---Hết---
4
D. MỘT SỐ CÔNG THỨC CẦN NHỚ D.1. MỘT SỐ CÔNG THỨC CẦN NHỚ 1) Công thức chuyển đổi giữa m, n: 2) Công thức chuyển đổi giữa V, n:
* Trong đó : + m là khối lượng chất (g)
+ n lượng chất (là số mol) (mol) + V là thể thích chất khí ở đktc (l) + M là khối lượng mol (g/mol)
3) Công thức tính nồng độ dung dịch: a) Nồng độ mol dung dịch:
* Trong đó: CM : là nồng độ mol dung dịch (M) hoặc (mol/l)
n : là số mol chất tan (mol) V là thể tích dung dịch (l) b) Nồng độ phần trăm dung dich:
* Trong đó: C% : là nồng độ phần trăm dung dịch (%)
mct: là khối lượng chất tan (g) mdd : là khối lượng dung dịch (g) c) Khối lượng riêng của dung dich:
* Trong đó: D: là khối lượng riêng của dung dich (g/ml)
mdd : là khối lượng dung dịch (g) Vdd :là thể tích dung dịch (l) D.2. HÓA TRỊ MỘT SỐ NGUYÊN TỐ VÀ NHÓM NGUYÊN TỬ Hóa trị Nguyên tố kim loại I K, Na, Ag III Al II, III Fe I, II Cu ( thường hóa trị II) II Ca , Mg, Zn, Ba Nguyên tố phi kim H, F, Cl, Br O Si Hóa trị I II IV
I II II II III Hiđroxit (−OH) I Kí hiệu Hóa trị Tên gốc bazơ Kí hiệu Hóa trị (−NO3) (=SO4) (=SO3) (=CO3) ( PO4)
Tên gốc axit Nitrat Sunfat sunfit Cacbonat Photphat D.3. TÍNH TAN TRONG NƯỚC CỦA MỘT SỐ AXIT- BAZƠ- MUỐI + Bazơ: Đa số không tan, trừ hợp chất bazơ của kim loại K, Na, Ba, Ca, Li + Axit: Đa số tan, trừ axitsilixic (H2SiO3) + Muối: - Muối của kim loại K, Na: tan hết - Muối nitrat ( − NO3): tan hết - Muối clorua(− Cl): đa số tan (trừ muối AgCl, PbCl2 ) - Muối sunfat( = SO4): đa số tan, (trừ muối BaSO4, PbSO4 )
5
- Muối của các gốc axit (=S), (=SO3), (=CO3), ( =SiO3), ( PO4): đa số không tan (trừ muối của kim loại K, Na.)
Chúc các em ôn tập và thi đạt kết quả tốt nhất!