
Trang 1/2 - Mã đề thi 209
Trường THPT Phú Ngọc Ngày ….. Tháng ….. Năm 200…
Họ & Tên: . . . . . . . . . . . . . . Kiểm tra 45' Môn: Hóa Học
Lớp: 12A…… Mã đề: 209
01. ; / = ~ 11. ; / = ~ 21. ; / = ~ 31. ; / = ~
02. ; / = ~ 12. ; / = ~ 22. ; / = ~ 32. ; / = ~
03. ; / = ~ 13. ; / = ~ 23. ; / = ~ 33. ; / = ~
04. ; / = ~ 14. ; / = ~ 24. ; / = ~ 34. ; / = ~
05. ; / = ~ 15. ; / = ~ 25. ; / = ~ 35. ; / = ~
06. ; / = ~ 16. ; / = ~ 26. ; / = ~ 36. ; / = ~
07. ; / = ~ 17. ; / = ~ 27. ; / = ~ 37. ; / = ~
08. ; / = ~ 18. ; / = ~ 28. ; / = ~ 38. ; / = ~
09. ; / = ~ 19. ; / = ~ 29. ; / = ~ 39. ; / = ~
10. ; / = ~ 20. ; / = ~ 30. ; / = ~ 40. ; / = ~
Chọn đáp án đúng nhất dùng bút chì tô đen vào bảng đáp án
Cho: Cr: 52; Fe: 56; Zn: 65; Cu: 64; Ag:108; Pb: 207;
Sn: 119; N: 14; O: 16; H: 1; Al: 27; dd: dung dịch;
Câu 1: Với sự có mặt của oxi trong không khí, đồng bị tan trong dd H2SO4 theo phản ứng sau:
A. 3Cu + 4H2SO4 + O2 → 3CuSO4 + SO2 + 4H2O B. Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O.
C. 2Cu + 2H2SO4 +O2 → 2CuSO4 + 2H2O D. Cu + H2SO4 → CuSO4 + H2.
Câu 2: Qua phản ứng: 2CrCl3 + Zn → 2CrCl2 + ZnCl2. Ta có thể khẳng định
A. Zn có tính khử mạnh hơn Cr2+. B. Zn có tính khử mạnh hơn Cr3+.
C. Zn có tính khử yếu hơn Cr2+. D. Zn có tính khử mạnh hơn Cr.
Câu 3: Bỏ 1 miếng Fe dư vào dd HNO3, sau khi phản ứng hoàn toàn kết thúc, trong dd chứa ....
A. Fe(NO3)2, Fe(NO3)3. B. Fe(NO3)3, HNO3. C. Fe(NO3)3. D. Fe(NO3)2.
Câu 4: Người ta đốt quặng Pirit sắt (FeS2) lấy SO2, để sản xuất H2SO4. Để đốt cháy 1 mol FeS2 cần mấy mol O2?
A. 4/7mol B. 11/4 mol C. 7/4 mol D. 4/11 mol
Câu 5: Chất nào sau đây làm mất màu thuốc tím (KMnO4) trong dd H2SO4 loãng.
A. Fe2(SO4)3. B. FeSO4. C. CuSO4. D. ZnSO4.
Câu 6: Không nên dùng cốc bằng Fe để chứa:
A. Dd HNO3 đặc nguội. B. Dd H2SO4 đặc nguội. C. Dd HNO3 loãng. D. Dd NaOH.
Câu 7: Cho CrO3 + NH3 → Cr2O3 + N2 + H2O. Vai trò của các chất trong phản ứng trên là:
A. CrO3 là chất bị oxi hóa, NH3 là chất bị khử. B. CrO3 là chất oxi hóa, và là chất khử.
C. CrO3 là chất oxi hóa, NH3 là chất khử. D. CrO3 là oxit axit, NH3 là 1 bazơ.
Câu 8: Có 3 lọ chứa: Fe + FeO, FeO + Fe2O3, Fe + Fe3O4. Để phân biệt các lọ chất bột màu đen này ta chỉ cần
dùng? A. Dd HCl và dd NaOH. B. Dd HCl và dd KMnO4/H2SO4. C. Dd HCl. D. Dd HNO3, dd NaOH.
Câu 9: Số oxi hóa của Cr trong Cr2O3, Cr2O72- lần lượt là: A. +3, +7 B. +3, +6. C. -3, -6. D. +2, +2
Câu 10: Trong quá trình luyện gang, than cốc không có vai trò nào sau đây?
A. Tác dụng với sắt sinh ra xementit (Fe3C) khi hình thành gang B. tạo chất khử CO.
C. Cháy tỏa nhiệt dùng để cung cấp cho phản ứng khử oxit sắt. D. Là chất khử oxit sắt.
Câu 11: Chọn phát biểu sai. Để chuyển CuO thành Cu, người ta đốt CuO với: A. NH3. B. CO. C. Cl2. D. H2.
Câu 12: Hợp kim Cu-Al được cấu tạo bằng tinh thể hợp chất hóa học, trong đó % khối lượng Al là 13,2%. Công
thức hóa học của hợp chất là: A. Cu38Al10. B. Cu18Al10. C. Cu28Al10. D. Cu8Al10.
Câu 13: Pb tan nhanh trong dd nào? A. H2SO4 loãng B. HNO3 loãng C. HCl D. HNO3 đặc
Câu 14: Có các dd: HCl, HNO3, NaOH, AgNO3, NaNO3. Chỉ dùng thêm chất nào sau đây để nhận biết?
A. Cu B. dd BaCl2. C. dd H2SO4 D. dd Ca(OH)2.
Câu 15: Để tiến hành thí nghiệm với dd Fe (II). Người ta cần bảo vệ dd Fe (II) mới sinh ra không bị O2 không khí
oxi hóa thành Fe (III). Người ta nên bỏ vào dd Fe (II) chất nào sau đây? A. Mg. B. Zn. C. Fe. D. Cu.
Câu 16: Fe tác dụng được với hơi nước, các thanh sắt ở nhà chúng ta thường tiếp xúc với hơi nước ở dưới 5700C.
Hỏi khi đó Fe bị oxi hóa tạo thành chủ yếu là: A. Fe3O4. B. Fe(OH)3. C. FeO. D. Fe2O3.
Câu 17: Cu không tan trong dd nào sau đây? A. HNO3 loãng. B. HCl. C. NaNO3 + HCl. D. HNO3 đặc nóng.
Câu 18: Fe sẽ bị ăn mòn trong trường hợp nào sau đây?
A. Fe được mạ thiếc (Sn) để trong không khí. B. Cho Fe vào H2O ở điều kiện thường.
C. Fe được mạ kẽm (Zn) để trong không khí. D. Cho Fe vào bình chứa O2 khô.
Điểm Lời phê
………………
………………

Trang 2/2 - Mã đề thi 209
Câu 19: Cấu hình electron của Fe2+ là: A. [Ar]3d6 B. [Ar]3d5 C. [Ar]3d54s1 D. [Ar]3d64s2
Câu 20: Khi để mẫu đồng ngoài không khí, người ta thấy phủ 1 lớp màu xanh, lớp bột màu xanh là
A. CuO B. CuCO3.Cu(OH)2. C. CuSO4. D. Cu(OH)2.
Câu 21: Qua phản ứng: 2CrCl3 + Zn → 2CrCl2 + ZnCl2. Ta có thể khẳng định
A. Zn có tính khử mạnh hơn Cr2+. B. Zn có tính khử mạnh hơn Cr3+.
C. Zn có tính khử mạnh hơn Cr. D. Zn có tính khử yếu hơn Cr2+.
Câu 22: Để sản xuất 1 tấn thép (99% Fe) cần dùng bao nhiêu tấn quặng manhetit (40% Fe3O4). Biết hiệu suất quá
trình sản xuất là 80%. A. 3,27 B. 3,24 C. 2,24 D. 4,27
Câu 23: Để chuyển Cr+6 (K2Cr2O7) thành Cr+3 ta dùng dd nào sau đây?
A. HCl đặc B. nước Br2. C. Dd KMnO4. D. Dd NaCl.
Câu 24: Cu được ứng dụng chủ yếu dựa vào tính
A. rẻ, dẻo, dẫn điện, khả năng tạo hợp kim B. dẻo, dẫn điện, bền, đẹp
C. dẻo, dẫn điện, bền, khả năng tạo hợp kim D. dẫn điện, màu sáng đẹp, khả năng tạo hợp kim
Câu 25: Nhúng một thanh Cu vào dd AgNO3, sau một thời gian lấy ra, rửa sạch, sấy khô, đem cân thì khối lượng
thanh đồng thay đổi thế nào? A. Tăng 152 gam B. Không thay đổi C. Giảm D. Tăng
Câu 26: Au không tan trong: A. dd NaCN. B. dd HNO3. C. Hg D. dd HCl + HNO3.
Câu 27: Cho dãy các chất: Cr(OH)3, Al2(SO4)3, Mg(OH)2, Zn(OH)2, MgO, CrO3. Số chất trong dãy có tính chất
lưỡng tính là: A. 5. B. 4. C. 2. D. 3.
Câu 28: Khi để một đồng tiền bằng bạc trong không khí thấy đồng tiền bị xỉn đen, do không khí nhiễm
A. HCl. B. O3. C. H2S hoặc O3. D. H2S.
Câu 29: Để sản xuất thép với chất lượng cao dùng trong các ngành đặc biệt người ta thường dùng loại thép bằng ....
A. Lò điện B. Lò thổi oxi (Bet-xơ-me) C. Lò bằng (Mac-tanh) D. Lò cao
Câu 30: Tôn thường được mạ nguyên tố nào? A. Ni B. Pb C. Sn D. Zn
Câu 31: Nung dây Cu trong không khí ở t0 cao, đến khi phản ứng xảy ra hoàn toàn, ta thu được chất rắn chứa:
A. Cu2O. B. CuCO3.Cu(OH)2. C. CuO2. D. CuO.
Câu 32: Phản ứng nào sau đây không đúng?
A. Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O B. Fe(OH)2 + 2HNO3 → Fe(NO3)2 + 2H2O
C. Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
D. 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Câu 33: Để loại Fe ra khỏi hỗn hợp với Cu ta có thể dùng: A. Dd NaOH. B. Dd HCl. C. Dd HNO3. D. H2O.
Câu 34: Hàm lượng Fe trong quặng nào sau đây giàu nhất?
A. Hematit đỏ (Fe2O3) B. Pirit sắt (FeS2) C. Manhetit (Fe3O4). D. Hematit nâu (Fe2O3.nH2O)
Câu 35: Ion Fe3+ có mấy electron độc thân? A. 3 B. 5 C. 2 D. 4
Câu 36: Mua một miếng thiếc xám (d=5,85g/cm3; bền ở dưới 140C) để trong không khí một thời gian. Hỏi miếng
thiếc đó có sự biến đổi gì?
A. Khối lượng riêng tăng. B. Chuyển thành màu trắng và khối lượng riêng tăng.
C. Chuyển thành màu trắng. D. Không có sự thay đổi
Câu 37: Fe tan trong dd nào sau đây? A. NaCl. B. Mg(NO3)2. C. AgNO3. D. NaNO3.
Câu 38: Hợp kim đồng bạch làm chân vịt tàu biển, là hợp kim của Cu với …
A. Zn B. Au-Ag. C. Ni D. Sn
Câu 39: Khử 2,4g hỗn hợp CuO và 1 oxit sắt có tỉ lệ mol 1:1. Sau phản ứng thu được 1,76g chất rắn, đem hòa tan
vào dd HCl dư thấy thoát ra 0,448 lit khí (đkc). Xác định công thức của oxit sắt.
A. Fe4O3. B. Fe3O4. C. FeO. D. Fe2O3.
Câu 40: Hòa tan hoàn toàn Fe trong dd H2SO4 loãng dư, sau phản ứng nhỏ tiếp dd NaOH vào thu lấy kết tủa đun
trong chân không, thu được chất rắn X. X là:
A. Fe2O3. B. Fe3O4. C. Fe. D. FeO
----------- HẾT ----------
KIM TRA HÓA HC 1 TIT
Trang : --- --- 1
Câu 1
: Hòa tan một lượng oxit Fe trong dung dịch H
2
SO
4
loãng, dư. Chia dung dịch thu được sau phản ứng thành hai
phần. Nhỏ dung dịch KMnO
4
vào phần 1 thấy màu tím biến mất. Cho bột đồng kim loại vào phần 2 thấy bột đồng
tan, dung dịch có màu xanh. Công thức của oxit Fe đã dùng là:
A. FeO B. Fe
2
O
3
C. Fe
3
O
4
D. FeO hoặc Fe
3
O
4
.
Câu 2
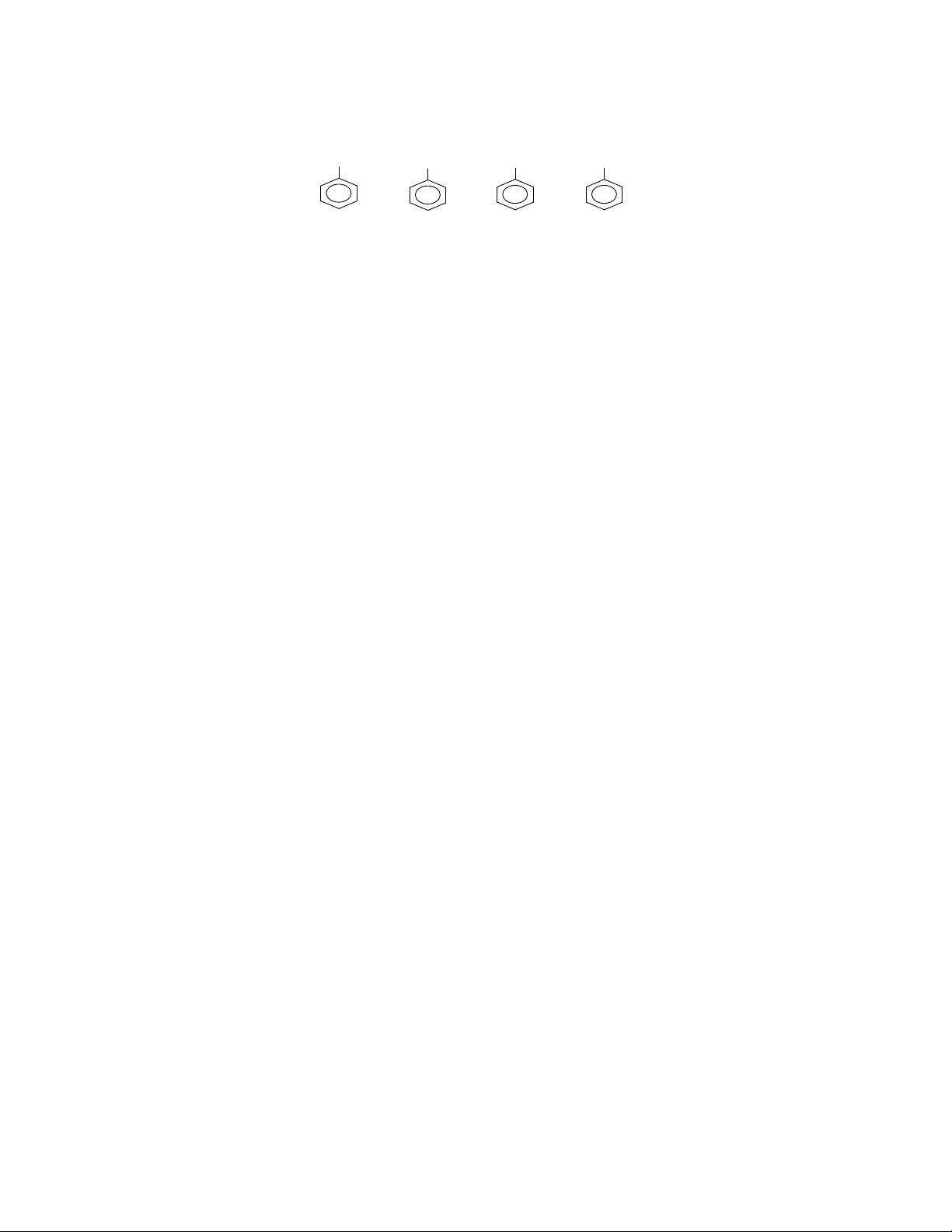
. Cho 4 hợp chất thơm sau :
O H N H 2C H O C O O H
(1 ) (2 ) ( 3 ) (4 )
Cho 4 chất trn tham gia phản ứng thế thì chất no sẽ định hướng vị trí mêta:
A. 1 ,3 ,4 B. 1, 2 , 3 C. 2 ,3 ,4 D. 3 ,4
Câu 3
. Cho 2 dung dịch H
2
SO
4
có pH =1 và pH =2. Thêm 100 ml dung dịch NaOH 0,1M vào 100 ml mỗi dung dịch
trên. Nồng độ mol/lít của muối trong dung dịch sau phản ứng là:
A. 0,025M và 0,0025M. B. 0,25M và 0,025M.
C. 0,25M và 0,0025M. D. 0,025M và 0,25M.
Câu 4
. Nhóm các dung dịch nào sau đây đều có chung một môi trường : ( axit, bazơ hay trung tính).
A. Na
2
CO
3
, KOH, KNO
3
. B. HCl, NH
4
Cl, K
2
SO
4
.
C. H
2
CO
3
, (NH
4
)
2
SO
4
, FeCl
3
. D. KMnO
4
, HCl, KAlO
2
.
Câu 5
. Phát biểu nào sau đây đúng?
A.
Axit là những chất có khả năng nhận prôtôn. C.d CH
3
COOH nồng độ 0,01M có pH =2.
B.
Chất điện li nguyên chất không dẫn được điện. Dung dịch muối sẽ có môi trường trung tính.
Câu 6
. Hòa tan 5,6 gam Fe bằng dung dịch H
2
SO
4
loãng (dư) thu được dung dịch X. Dung dịch X phản ứng vừa đủ
với V ml dung dịch KMnO
4
0,5M. Giá trị V là:
A. 20ml B. 80 ml C. 40 ml D. 60 ml.
Câu 7
. Trong phòng thí nghiệm người ta điều chế khí Cl
2
bằng cách:
A. Cho F
2
đẩy Cl
2
ra khỏi muối NaCl. B. Cho dd HCl đặc tác dụng với MnO
2
, đun nóng.
C. Điện phân NaCl nóng chảy. D. Điên phân dung dịch NaCl có màn ngăn.
Câu 8
. Nung 15,4g hỗn hợp gồm kim loại M và hóa trị II và muối nitrat của nó đến kết thúc phản ứng. Chất rắn còn
lại có khối lượng 4,6g cho tác dụng với dung dịchịch HCl thu được 0,56 lít H
2
(đktc). M là kim loại nào?.
A. Mg B. Cu C. Zn D. Fe
Câu 9
. Cho a mol Al vào dung dịch chứa b mol Cu
2+
và c mol Ag
+
. Kết thúc phản ứng thu được dung dịch chứa 2
loại ion kim loại. Kết luận nào sau đây là đúng:
A. c/3
a
2b/3. B. c/3
a
c/3 + 2b/3 C. c/3
a < c/3 + 2b/3 D. 3c
a
2b/3.
Câu 10
. Cho p gam Fe vào Vml dung dịch HNO
3
1M thấy Fe tan hết, thu được 0,672 lít khí NO (đktc). Cô cạn dung
dịch sau phản ứng thu được 7,82 gam muối Fe. Giá trị của p và V là:
A. 2,24 gam và 120 ml. B. 1,68 gam và 120 ml.
C. 1,8 gam và 129 ml. C. 2,43 gam và 116 ml
Câu 11
. Điện phân dung dịch CuCl
2
với điện cực trơ, sau một thời gian thu được 0,32 gam Cu ở catốt và một lượng
khí X ở anốt. Hấp thụ hoàn toàn lượng khí X ở trên vào 200 ml dung dịch NaOH ( ở nhiệt độ thường). Sau
phản ứng nồng độ NaOH còn lại là 0,05M ( giả thiết coi thể tích của dung dịch không thay đổi). Nồng độ
ban đầu của dung dịch NaOH là:
A. 0,15M B. 0,1M. C. 0,05M. D. 0,2M.
Câu 12
. Cho 14,6 gam hỗn hợp Fe và Zn tác dụng với dung dịch HCl dư thu được 5,264 lít khí H
2
(đktc). Cũng
lượng hỗn hợp như vậy cho tác dụng với 200 ml dung dịch CuSO
4
a mol/lít thu được 14,72 gam chất rắn.
Giá trị của a là:
A. 0,3M. B. 0,975M. C. 0,25M. D. 0,75M.
Câu 13
. Chất nào sau đây không làm xanh được quỳ tím:
A. Anilin. B. Metyl amin. C. Amoniăc. D. Natri axetat.
Câu 14
. Cho FeS
2
+ HNO
3
Fe
2
(SO
4
)
3
+ NO
2
+ … Chất nào được bổ sung trong dấu …
A.H
2
O. B.Fe(NO
3
)
3
và H
2
O. C. H
2
SO
4
và H
2
O. D.Fe(NO
3
)
3
, H
2
SO
4
và H
2
O.
Câu 15
. Cho 13,5 gam bột Al tác dụng với hết với dung dịch HNO
3
dư thu được hỗn hợp khí X gồm NO và N
2
O. Tỉ
khối hơi của X so với H
2
là 19,2. Thể tích hỗn hợp đo ở 27,3
o
C và 1atm là:
A. 5,6 lít. B. 6,16 lít. C. 7,142 lít D. 8,4 lít.
Câu 16
. Cation R
+
có phân lớp ngoài cùng là 3p
6
. Trong bảng hệ thống tuần hoàn R ở vị trí nào?
A. Ô thứ 18, chu kì 3, PNC nhóm VIII. B. Ô thứ 17, chu kì 3, PNC nhóm VII.
C. Ô thứ 19, chu kì 3, PNC nhóm I. D. Ô thứ 19, Chu kì 4, PNC nhóm I.
Câu 17
. Một hỗn hợp gồm 2 mol N
2
và 8 mol H
2
được dẫn vào một bình kín có xúc tác thích hợp. Khi phản ứng với
đạt tới trạng thái cân bằng thu được 9,04 mol hỗn hợp khí. Hiệu suất tổng hợp NH
3
là:
A. 20% B. 24% C. 25% D. 18%.
Câu 18
. Cho từng chất : C, Fe, BaCl
2
, Fe
3
O
4
, Fe
2
O
3
, FeCO
3
, Al
2
O
3
, H
2
S, HI, HCl, AgNO
3
, Na
2
SO
3
lần lượt phản ứng
với H
2
SO
4
đặc, nóng. Số phản ứng thuộc loại phản ứng oxi hóa khử là:
A. 5 B. 6 C. 7 D. 9
Câu 19
. Cho các chất sau: Phênol, êtanol, axit axetic, natri axetat, natriphenolat, natri hidroxit. Số cặp chất tác dụng
được với nhau là:
A. 2 B. 3 C. 1 D. 4
Câu 20
. Có 4 dung dịch muối riêng biệt: CuCl
2
, ZnCl
2
, FeCl
3
, AlCl
3
. Nếu thêm dung dịch KOH (dư) rồi thêm tiếp
dung dịch NH
3
(dư) vào 4 dung dịch trên thì số kết tủa thu được là:
A. 1 B. 2 C. 3 D. 4
Câu 21
. Để trung hòa 25 gam dung dịch của một amin đơn chức X nồng độ 12,4% cần dùng 100 ml dung dịch HCl
1M. Công thức phân tử của X là:

KIM TRA HÓA HC 1 TIT
Trang : --- --- 2
A. CH
5
N. B. C
2
H
7
N. C. C
3
H
7
N. D. C
3
H
5
N.
Câu 22
. Dẫn khí CO qua ống đựng 5 gam Fe
2
O
3
nung nóng thu được 4,2 gam hỗn hợp gồm Fe, FeO, Fe
3
O
4
và
Fe
2
O
3
. Dẫn khi ra khỏi ống qua dung dịch CaOH)
2
dư thu được a gam kết tủa. Giá trị của a là:
A. 4 gam. B. 5 gam C. 6 gam. D. 7,5 gam.
Câu 23
. Nung nóng mg bột Fe trong O
2
, sau phản ứng thu được 3 gam hỗn hợp chất rắn X. Hòa tan hết hỗn hợp X
trong dung dịch HNO
3
(dư), thoát ra 0,56 lít khí NO (đktc) là sản phẩm khử duy nhất. Giá trị của m là:
A. 2,52 gam B. 2,22 gam. C. 2,32 gam D. 2,62 gam.
Câu 24
. Trong hợp chất XY ( X là kim loại và Y là phi kim), số electron của cation bằng số electron của anion và
tổng số electron trong XY là 20. Biết trong mọi hợp chất Y chỉ có một mức OXH duy nhất. Công thức XY là:
A. MgO B. AlN. C. NaF D. LiF.
Câu 25
. Sục V lít khí CO
2
( ở đktc) vào 250 ml dung dịch Ba(OH)
2
1M thu được 19.7 gam kết tủa. Giá trị lớn nhất
của V là:
A. 2.24 lít B. 11,2 lít C. 6.72 lít D. 8.96 lít.
Câu 26
. Khi dần tăng nhiệt độ: SĐ nào sau đây là đúng về biến đổi trạng thái vật lí của lưu huỳnh:
A. S (rắn) ® S ( lỏng, linh động) ® S ( lỏng, quánh) ® S( hơi ở dạng phân tử ) ® S ( hơi ở dạng n.tử).
B. S ( rắn) ® S ( lỏng quánh) ® S ( lỏng, linh động) ® S ( hơi ở dạng phân tử ) ® S ( hơi ở dạng n.tử).
C. S ( rắn) ® S ( lỏng, linh động) ® S ( lỏng, quánh) ® S ( hơi ở dạng n.tử).® S( hơi ở dạng phân tử )
D. S ( rắn) ® S (lỏng, quánh ) ® S (lỏng, quánh) ® S ( hơi dạng n.tử) ® S ( hơi dạng phân tử).
Câu 27
. Cho 4,48 lít hỗn hợp X (đktc) gồm 2 hiđrôcacbon mạch hở lội từ từ qua bình 2 chứa 2 lít dung dịch brôm
0,35M. Sau khi phản ứng xảy ra hoàn toàn, số mol brôm giảm đi một nữa và khối lượng bình tăng thêm 6,0
gam. Công thức phân tử của hai hiđrôcacbon là:
A. C
2
H
2
và C
4
H
10
. B. C
3
H
4
và C
4
H
8
. C. C
2
H
2
và C
3
H
6
. D. C
2
H
2
và C
4
H
6
.
Câu 28
. Thủy phân hoàn toàn 3,96 gam vinyl fomiat trong dung dịch H
2
SO
4
loãng. Trung hòa hoàn toàn dung dịch
sau phản ứng rồi cho tác dụng tiếp với dung dịch AgNO
3
/NH
3
dư thu được m gam Ag. Giá trị của m là:
A. 23,76gam. B. 11,88 gam C. 21,6 gam. D. 15,12 gam.
Câu 29
. Cho chuỗi phản ứng: CH
4
A
C
2
H
6
. Chất A là:
(1). Axetylen. (2). Mêtyl clorua. (3). Mêtanal. (4). Etylen.
A. (1) hoặc (2) B. (1) hoặc (3). C. (1) hoặc (4). D. chỉ có (1).
Câu 30
. Lên men 1 lít ancol êtylic 9,2
o
C. Biết hiệu suất của quá trình lên men là 80% và khối lượng riêng của ancol
êtylic nguyên chất là 0,8g/ml. Khối lượng của sản phẩm hữu cơ thu được là:
A. 88,7 gam B. 76,8 gam. C. 75,8 gam D. 74,2 gam.
Câu 31
. Chọn mệnh đề không đúng:
A.
CH
3
CH
2
COOCH=CH
2
cùng dãy đồng đẳng với CH
2
=CHCOOCH
3
.
B.
CH
3
CH
2
COOCH=CH
2
có thể trùng hợp tạo polime.
C.
CH
3
CH
2
COOCH=CH
2
tác dụng được với dung dịch brôm.
D.
CH
3
CH
2
COOCH=CH
2
tác dụng được với dung dịch NaOH thu được anđêhit và muối.
Câu 32
. A,B,C có công thức phân tử tương ứng là : CH
2
O
2
, C
2
H
4
O
2
, C
3
H
4
O
2
. Phát biểu đúng về A, B,C là:
(1). A,B,C đều là axit. (2). A là axit, B là este, C là anđêhit có 2 chức.
(3). A,B,C đều là ancol có hai chức. (4). Đốt cháy a mol mỗi chất đều thu được 2a mol H
2
O.
A. (1,3) B. (2,4) C. (1,2) D. (1,2,3,4).
Câu 33
. Cho 1,8 gam một axit đơn chức A phản ứng hết với 40 ml dung dịch KOH 1M thu được dung dịch X. Cô
cạn dung dịch X được 3,59 gam chất rắn. A là:
A. Axit acrylic. B. Axit fomic. C. Axit propionic. D. Axit axetic.
Câu 34
. Hợp chất X mạch hở, có công thức là C
5
H
8
O
2
. Đun nóng X với dung dịch NaOH thu được muối Y và ancol
Z, Y tác dụng với H
2
SO
4
tạo ra axit T mạch phân nhánh. Tên của X là:
A. mêtyl acrylat. B. Metyl metacrylat. C. metyl isobutyrat. D. etyl isobutyrat.
Câu 35
. Hỗn hợp X gồm CH
3
OH , axit đơn no A và este B tạo bởi A và CH
3
OH. Đốt cháy hoàn toàn 0,13 mol hỗn
hợp X ( số mol CH
3
OH trong X là 0,08 mol) thu được 0,25 mol CO
2
. A,B lần lượt là:
A. HCOOH và HCOOCH
3
. B. CH
3
COOH và CH
3
COOCH
3
.
C. C
2
H
5
COOH và C
2
H
5
COOCH
3
. D. C
3
H
7
COOH và C
3
H
7
COOCH
3
.
Câu 36
. Cho sơ đồ chuyển hóa sau đây:
A
X
2
Br
B
CH
3
CHO
2
H / Ni
C
X
Chất X là chất nào trong các chất cho dưới đây:
A. C
2
H
2
B. C
2
H
4
C. C
3
H
6
D. C
4
H
8
.
Câu 37
. Cho 6,6 gam một anđêhit X đơn chức X, mạch hở phản ứng với lượng dư dung dịch AgNO
3
/ NH
3
, đun
nóng. Lượng Ag sinh ra cho phản ứng hết với HNO
3
loãng, thoát ra 2,24 lít NO duy nhất (đktc), Công thức
cấu tạo thu gọn của X là:
A. CH
3
CHO. B. HCHO. C. CH
3
CH
2
CHO. D. CH
2
=CH-CHO.
Câu 38
. Cho bay hơi 2,38 gam hỗn hợp X gồm 2 ancol đơn chức ở 136,5
o
C và 1 atm thu được 1,68 lít hơi. Oxi hóa
4,76 gam hỗn hợp X bởi CuO thu được hỗn hợp 2 andêhit. Hỗn hợp anđêhit tác dụng với dung dịch
AgNO
3
/NH
3
dư thu được 30,24 gam Ag. Phần trăm khối lượng mỗi ancol trong X.
A. 56,33% và 43,67%. B. 45,28% và 54,72%. C. 66,67% và 33,33% D. 26,89% và 73,11%.
Câu 39
. Cho hợp chất hữu cơ X có thành phần % về khối lượng là : 53,33%C ; 15,56%H; 31,11%N. Công thức phân
tử của X là:
A. C
2
H
7
N. B. C
6
H
7
N. C. C
3
H
9
N. D. C
4
H
11
N.
Câu 40
. Thủy phân hoàn toàn 444 gam một lipit thu được 46 gam glixerol (glixerin) và hai loại axit béo đó là

KIM TRA HÓA HC 1 TIT
Trang : --- --- 3
A.
C
15
H
31
COOH v C
17
H
35
COOH.
B.
C
17
H
31
COOH v C
17
H
33
COOH.
C.
C
17
H
33
COOH v C
15
H
31
COOH.
D.
C
17
H
33
COOH v C
17
H
35
COOH.
PhÇn riªng: thÝ sinh ch lµm 1 trong 2 phÇn sau ( PhÇn I hoỈc phÇn II)
.
PhÇn I. Theo ch¬ng tr×nh kh«ng ph©n ban (t c©u 41 ®n c©u 50)
Câu 41
: Cho phản ứng sau đây: N
2
+ 3H
2
2NH
3
H<0
Khi tăng áp suất, cân bằng chuyển dịch theo chiều nào?
A. Chiều nghịch B. Chiều giảm nồng độ NH
3
C. Chiều tỏa nhiệt. D. Chiều tăng số phân tử khí.
Câu 42
Đốt cháy hoàn toàn a mol axit hữu cơ Y được 2a mol CO
2
.Mặc khác để trung hoà a mol Y cần dùng vừa đủ
2a mol NaOH. Công thức cấu tạo thu gọn của Y là:
A. HOOC-COOH. B. HOOC-CH
2
-CH
2
-COOH.
C. CH
3
COOH. D. C
2
H
5
COOH.
Câu 43
. A là một axit no 2 chức mạch hở. B là một ancol đơn chức mạch hở chứa một nối đôi. E là este không chứa
nhóm chức khác tạo bởi A và B. E có công thức nào sau đây:
A. C
n
H
2n-6
O
4
B. C
n
H
2n-4
O
4
C. C
n
H
2n-2
O
4
D. C
n
H
2n+1
COOC
m
H
2m-1
.
Câu 44
. Chọn mệnh đề không đúng:
A. Fe khử được Cu
2+
trong dung dịch. B. Fe
3+
có tính oxi hóa mạnh hơn Cu
2+
.
C. Fe
2+
oxi hóa được Cu. D.Tính OXH của các ion tăng theo thứ tự Fe
2+
, H
+
, Cu
2+
, Ag
+
Câu 45
. Để thu lấy Ag tinh khiết từ hỗn hợp X ( gồm a mol Al
2
O
3
, b mol CuO, c mol Ag
2
O). Người ta hòa tan X bởi
dung dịch chứa (6a + 2b+2c) mol HNO
3
được dung dịch Y, sau đó thêm tiếp: … ( biết hiệu suất phản ứng là
100%).
A.
2c mol bột Cu vào Y. B.2 c mol bột Al vào Y.
C. c mol bột Al vào Y. D. c mol bột Cu vào Y.
Câu 46
. Cho 1,53 gam hỗn hợp gồm Mg, Cu và Zn vào dung dịch HCl dư thấy thoát ra 448 ml khí (đktc). Cô cạn
hỗn hợp sau phản ứng và nung trong chân không sẽ thu được một chất rắn có khối lượng gam là:
A. 2,95g. B. 3,9g C. 2,24 gam D. 1,885 gam.
Câu 47:
Có 3 dung dịch NaOH , HCl , H
2
SO
4
. Thuốc thử duy nhất để phân biệt 3 dung dịch đó là:
A. Na
2
CO
3
. B. Al C. CaCO
3
D. Quỳ tím.
Câu 48
. Hỗn hợp gồm ancol êtylic , phênol và anđehit axetic có khối lượng là: 55gam. Chia hỗn hợp thành hai phần
như nhau.Phần 1 tác dụng với Na dư thấy thoát ra 2.8 lít khí H
2
( đktc). Phần 2 cho tác dụng với dung dịch
AgNO
3
thì thấy tạo thành 43.2 gam Ag. % theo số mol của ancol trong hỗn hợp đầu là:
A. 25,35% B 25,27% C. 44,44% D. 22,22%.
Cu 49
.Cc pht biểu sau lin quan đến cacbohidrat, pht biểu no sai :
1)
Khc với glucozơ (chứa nhĩm anđhit),frutozơ (chứa nhĩm xeton) khơng cho phản ứng trng gương.
2)
Saccarozơ là đisacarit của glucozơ nên Saccarozơ cũng cho ph ản ứng tr áng gương như glucozơ.
3)
Tinh bột chứa nhiều nhĩm OH nn tan nhiều trong nước.
A.2,3 B.1,2 C.1 D.(1), (2), (3).
Câu 50
.
-aminoaxit X chứa một nhóm –NH
2
. Cho 10,3 gam chất X tác dụng với axit HCl ( dư) thu được 13,95 gam
muối khan. Công thức cấu tạo thu gọn của X là:
A. H
2
NCH
2
COOH. B. CH
3
CH
2
CH(NH
2
)COOH.
C. CH
3
CH(NH
2
)COOH. D. CH
3
CH(NH
2
)CH
2
COOH.
PhÇn II. Theo ch¬ng tr×nh ph©n ban (t c©u 51 ®n c©u 60)
Câu 51
. Cho 0,255 mol N
2
O
4
phân huỷ và đạt đến cân bằng trong thể tích bình là 1,5 lít. Theo sơ đồ sau:
N
2
O
4
(k)
2NO
2
(k)
. K
CB
= 0,36 tại 100
o
C. Nồng độ của NO
2
và N
2
O
4
ở 100
o
C tại thời điểm cân bằng:
A.[N
2
O
4
]
0,0833M và [NO
2
]
0,174M. C. [N
2
O
4
]
0,1394M, [NO
2
]
0.0612
B.[N
2
O
4
]
0,144 và [NO
2
]
0.052M D. [N
2
O
4
]
0,1394M, [NO
2
]
0.0306.
Câu 52
. Một hợp chất X có M
X
< 170. Đốt cháy hoàn toàn 0,486 gam X sinh ra 405,2 ml CO
2
( đktc) và 0,270 gam
H
2
O. X tác dụng với dung dịch NaHCO
3
và Na đều dinh ra chất khí với số mol đúng bằng số mol X đã dùng.
Công thức cấu tạo của A là:
A.
HO – C
6
H
4
O
2
-COOH. B. HO – C
3
H
4
– COOH.
C. HOOC – (CH
2
)
5
– COOH. D. HO – C
5
H
8
O
2
-COOH.
Câu 53
. Từ khí B người ta điều chế một số hợp chất hữu cơ theo sơ đồ sau:
B
2
,
o
H
Ni t
C
1
2
Cl
askt
C
2
2
H O
OH
C
3
2
0
,
O
Cu t
C
4
.
Tên gọi C
1
, C
2
( sản phẩm chính), C
3
, C
4
lần lượt là:
A.
n – propylic, anđêhit propionic, propan, n –propyl clorua.
B.
etan, etyl clorua, ancol etylic, anđehit axetic.
C.
propan, iso propyl clorua, ancol iso – propylic, axeton.
D.
Propin , 1-clo propan, propan-1-ol, propanal.
Câu 54
. Cho phản ứng sau: Cr(OH)
3
+ KNO
3
+ 4KOH
K
2
CrO
4
+ KNO
2
+ H
2
O.
Sau khi cân bằng phản ứng oxi hóa khử trên tổng các hệ số nhận giá trị là:
A. 18 B.19 C. 20 D. 21
Câu 55
. Dung dịch X có màu da cam, nếu cho vào một lượng KOH, màu đỏ của dung dịch dần dần chuyển sang màu
vàng tươi, từ dung dịch có màu vàng tươi thu được nếu thêm vào một lượng dung dịch H
2
SO
4
, màu của dung
dịch chuyển sàng màu đỏ da cam. Xác định dung dịch X.
A. dung dịch K
2
Cr
2
O
7
. C. Dung dịch CrCl
3
B. Dung dịch K
2
CrO
4
. D. Dung dịch KCrO
2
.
Câu 56
. Cho các dung dịch sau đây: Na
2
CO
3
, BaCl
2
, H
2
SO
4
, AlCl
3
, FeCl
3




![10 Đề kiểm tra 1 tiết Hoá lớp 12 [Kèm đáp án chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2011/20111025/tottenham6811/135x160/mot_so_de_kiem_tra_1587.jpg)
![Đề kiểm tra Hoá 12 học kỳ 2: Tuyển tập đề 1 tiết [kèm đáp án]](https://cdn.tailieu.vn/images/document/thumbnail/2011/20111025/tottenham6811/135x160/kiem_tra_sat_6881.jpg)






![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)




![Đề thi học kì 2 Vật lý lớp 11: Đề minh họa [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/linhnhil/135x160/711752026408.jpg)








