
S GD - ĐT B C GIANGỞ Ắ
C M S N Đ NGỤ Ơ Ộ ĐỀ THI CH N H C SINH GI I C P C MỌ Ọ Ỏ Ấ Ụ
NĂM H C: 2008 - 2009Ọ
MÔN HOÁ H C L P 10Ọ Ớ
Thêi gian: 120 phút (không k th i gian phát đ )ể ờ ề
C âu I (4,0 đi m)ể:
Anion X- có c u hình electron l p ngoài cùng là 3pấ ớ 6 .
1. Vi t c u hình electron và s phân b electron trong obitan c a nguyên t X.ế ấ ự ố ủ ử
2. Cho bi t v trí c a X trong B ng tu n hoàn? Tên g i c a X? Gi i thích b n ch t liênế ị ủ ả ầ ọ ủ ả ả ấ
k t c a X v i các kim lo i nhóm IA.ế ủ ớ ạ
3. Tính ch t hoá h c đ c tr ng c a X là gì? L y ví d minh ho .ấ ọ ặ ư ủ ấ ụ ạ
4. T Xừ- làm th nào đ đi u ch đ c X.ế ể ề ế ượ
C âu II (4,5 đi mể):
H p ch t M có công th c ABợ ấ ứ 3. T ng s h t proton trong phân t M là 40. Trong thànhổ ố ạ ử
ph n h t nhân c a A cũng nh B đ u có s h t proton b ng n tron. A thu c chu kì 3 trongầ ạ ủ ư ề ố ạ ằ ơ ộ
b ng HTTH .ả
a) Xác đ nh A, B. Vi t c u hình electron c a A và B.ị ế ấ ủ
b) Xác đ nh các lo i liên k t có trong phân t ABị ạ ế ử 3 .
c) M t khác ta cũng có ion ABặ32-. Trong các ph n ng hoá h c c a ABả ứ ọ ủ 3 ch th hi n tínhỉ ể ệ
oxi hóa còn AB32- v a th hi n tính oxi hóa, v a th hi n tính kh . Hãy gi i thíchừ ể ệ ừ ể ệ ử ả
hi n t ng trên. Cho ví d minh h a.ệ ượ ụ ọ
C âu III (4,5 đi mể):
1. B ng ph ng pháp hoá h c hãy phân bi t các dung d ch đ ng trong các l m t nhãn sau:ằ ươ ọ ệ ị ự ọ ấ
NaCl, NaNO3, HCl, HBr, NaOH
2. Cân b ng các ph n ng sau theo ph ng pháp thăng b ng electron:ằ ả ứ ươ ằ
a. Zn + HNO3 →Zn(NO3)2 + NH4NO3 + H2O
b. H2SO4 + HI → I2 + H2S + H2O
c. NaClO + KI + H2SO4 → I2 + NaCl + K2SO4 + H2O
d. K2Cr2O7 + HCl → KCl + CrCl3 + Cl2 + H2O
Câu IV (5,0 đi m)ể:
Hoà tan 6,25 g h n h p g m Zn và Al vào 275 ml dung d ch HNOỗ ợ ồ ị 3, thu đ c dung d chượ ị
A, ch t r n B g m các kim lo i ch a tan h t cân n ng 2,516g và 1,12 lít h n h p khí D (đktc)ấ ắ ồ ạ ư ế ặ ỗ ợ
g m NO và Nồ2O. H n h p khí D có t kh i h i so v i Hỗ ợ ỉ ố ơ ớ 2 là 16,75.
a. Khi cô c n dung d ch A thì thu đ c bao nhiêu gam mu i khan.ạ ị ượ ố
b. Tính thành ph n % m i kim lo i trong h n h p đ u.ầ ỗ ạ ỗ ợ ầ
c. Tính n ng đ mol c a dung d ch HNOồ ộ ủ ị 3 ban đ u.ầ
C âu V (2,0 đi mể):
Cho 2,13 gam h nỗ h pợ X gồm ba kim lo iạ Mg, Cu và Al ở d ngạ b tộ tác d ngụ
hoàn toàn v i oxiớ thu đưcợ h nỗ h pợ Y gồm các oxit có kh iố lưngợ 3,33 gam. Tính thể tích
dung d chị HCl 2M vừa đủ đ ph n ể ả ứng h t v i Y?ế ớ
-----H t----ế
H NG D N CH MƯỚ Ẫ Ấ
Câu N i dungộThang
đi mể
Câu I 4,0
1/
(1.00)
C u hình electron đ y đ c a X: 1sấ ầ ủ ủ 22s22p63s23p5
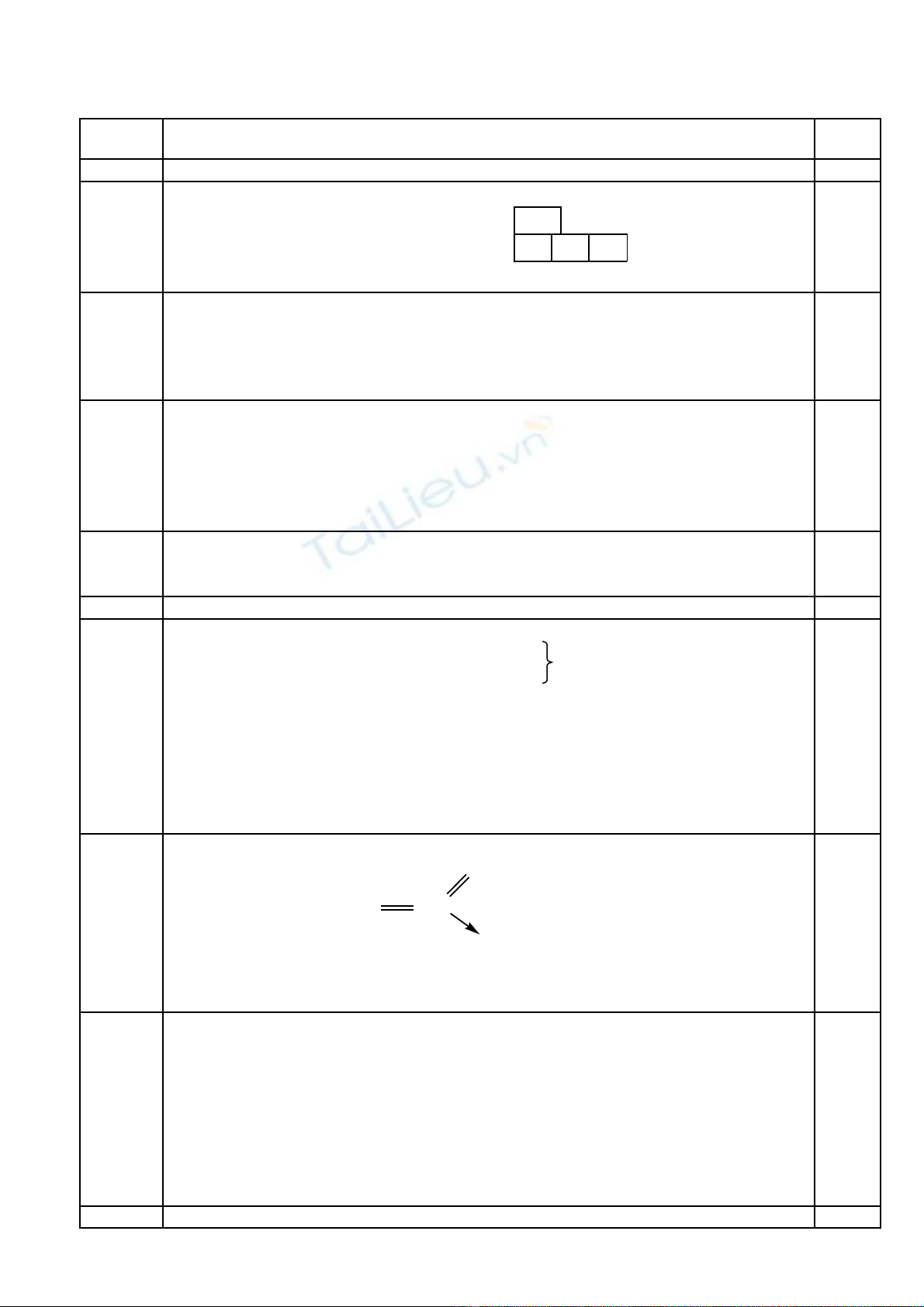
S phân b các e trong các obitan: ự ố
3s 3p
0,5
0,5
2/
(1.00)
V trí c a X trong b ng tu n hoàn: Ô s 17, chu kỳ 3; nhóm VIIAị ủ ả ầ ố
X là clo (Cl)
Khi liên k t v i các nguyên t nhóm IA đ t o thành h p ch t:ế ớ ố ể ạ ợ ấ
X + 1e -> X-
R -> R+ + 1e => X- liên k t v i Rế ớ + b ng liên k t ionằ ế
0,5
0,5
3/
(1.00)
Tính ch t hoá h c đ c tr ng c a clo là tính oxi hoá m nhấ ọ ặ ư ủ ạ
Vd:
1. Cl20+ 2Na0 -> 2Na+Cl-
2. 3Cl20 + 2Fe0 -> 2Fe+3Cl3-
Ngoài ra clo còn có th là ch t kh :ể ấ ử
VD: Cl20 + H2O
テ
HCl- + HCl+1O
0,75
0,25
4/
(1.00)
2Cl- ->Cl2 + 2.1e
VD:
4HCl- + MnO2 -> MnCl2 + Cl2 + 2H2O
1,0
Câu II 4,5
a/
(1.50)
G i ZọA, ZB l n l t là s đ n v đi n tích h t nhân trong A, Bầ ượ ố ơ ị ệ ạ
Ta có: ZA + 3ZB = 40
A thu c chu kỳ 3 => 11 ộ
ZA
18 => 7,3
ZB
9,6
=> ZB = 8; 9
ZB = 8 (O) => ZA = 16 (S) (ch n)ọ
ZB = 9 (F) => ZA = 13 (Al) (lo i) vì trong nguyên t A, B s proton b ng sạ ử ố ằ ố
n tron.ơ
C u hình e c a A và Bấ ủ
A(Z = 8): 1s22s22p4
B (Z = 16): 1s22s22p63s23p4
1,0
0,5
b/
(1.00)
Phân t ABử3: SO3 CTCT:
S
O
O
O
Trong phân t SOử3 có 2 liên k t c ng hóa tr (liên k t đôi) đ c hình thành b i sế ộ ị ế ượ ở ự
góp chung e c a S v i O và 1 liên k t cho nh n (đ c hình thành b ng đôi e ch doủ ớ ế ậ ượ ằ ỉ
S đóng góp).
1,0
c/
(2.00)
L u huỳnh có các m c oxh: -2; 0; +4; +6ư ứ .
Trong ion SO32-, S có s oxi hoá +4 là m c oxh trung gian c a S => trong các pố ứ ủ ư
SO32- v a th hi n tính kh , v a th hi n tính oxh:ừ ể ệ ử ừ ể ệ
1. Na2SO3 + Br2 + H2O -> Na2SO4 + 2HBr (S+4 -> S+6+ 2e : tính kh )ử
2. Na2SO3 + 6HI -> 2NaI + S + 2I2 + 3H2O (S+4 +4e-> S : tính oxh)
Trong phân t SOử3, S có m c oxi hoá +6, là m c oxh cao nh t c a S. Do đó trongứ ứ ấ ủ
các p SOư3 ch th hi n tính oxi hóa:ỉ ể ệ
1. SO3 + NO -> SO2 + NO2 (S+6 + 2e-> S+4)
1,0
1,0
Câu III 4,5
1/
(2.50)
+ L y m u th t các dung d ch trên.ấ ẫ ử ừ ị
+ Dùng quỳ tím:
-Dung d ch làm quỳ hoá xanh là NaOHị
-Dung d ch làm quỳ hoá đ là: HCl; HBr (axit)ị ỏ
-Dung d ch không làm đ i màu quỳ là NaCl, NaNOị ổ 3 (mu i)ố
+ Nh n bi t các axit: dùng dung d ch AgNOậ ế ị 3
-Dung d ch có t o k t t a tr ng v i AgNOị ạ ế ủ ắ ớ 3 là HCl
Ptp : HCl + AgNOư3
AgCl
+ HNO3
-Dung d ch có t o k t t a vàng v i AgNOị ạ ế ủ ớ 3 là HBr
Ptp : HưBr + AgNO3
AgBr
+ HNO3
+ Nh n bi t các dung d ch mu i: dùng dung d ch AgNOậ ế ị ố ị 3:
-Dung d ch có t o k t t a v i AgNOị ạ ế ủ ớ 3 là NaCl
Ptp : NaCl + AgNOư3
AgCl
+ NaNO3
- Dung d ch còn l i là NaNOị ạ 3
0,5
0,5
0,5
0,5
0,5
2/
(2.00) a. 4Zn + 10HNO3 →4Zn(NO3)2 + NH4NO3 + 3H2O
b. H2SO4 + 8HI → 4I2 + H2S + 4H2O
c. NaClO + 2KI + H2SO4 → I2 + NaCl + K2SO4 + H2O
d. K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
0,5
0,5
0,5
0,5
Câu IV 5,0
a/
(2.00)
6,25 2,516 3,734
pu
m g= − =
; Đ t s mol Zn và Al ph n ng l n l t là x và y.ặ ố ả ứ ầ ượ
Ta có: 65x + 27y = 3,7734 gam (1)
G i a, b l n l t là s mol NO, Nọ ầ ượ ố 2O trong h n h p. ỗ ợ
Ta có:
1,12
a + b = 0,05 0,0375
22,4 ( )
0,0125
30 44 16,75.2 33,5
amol
b
a b
a b
=
=
� � =
+
= =
+
Các quá trình cho nh n e: ậ
2
3
1, 2
2
2, 3
3
Zn Zn e
x x x
Al Al e
y y y
+
+
+
+
và
5 2
5 1
1', 3
3
2', 4
8 2
N e N
a a a
N e N
b b b
+ +
+ +
+
+
Áp d ng đlbt e: ụ
3
2 3 3 8 0,2125
NO
x y a b n
−
+ = + = =
(2)
3
'
3,734 0,2125.62 16,909
m KL NO
m m m gam
−
= + = + =�
0,5
0,5
1,0
b/
(1.00)
Gi i (1) và (2) ta đ c: x = 0,03875; y = 0,045 (mol)ả ượ
% 67,45%;% 32,55%
Zn Al
m m= =
1,0
c/
(2.00)
5
33
3
( ') ( )
( )
(2 3 ) ( 2 ) 0,275
0,275 1( / )
0,275
HNO NO m N kh
M HNO
n n n x y a b mol
C mol l
− +
= + = + + + =
= =�
1,0
1,0
Câu V 2,0
G i R là công th c chung c a 3 kim lo i. R hóa tr nọ ứ ủ ạ ị
Ta có s đ ph n ng:ơ ồ ả ứ
2
2
'
2 2
3,33 2,13
2 2. 0,15
16
2,13 0,15.35,5 7,455
O HCl
n n
O
Cl Cl
m KL Cl
R R O RCl
n n n mol
m m m gam
− −
−
−
= = =� �
= + = + =�
2,0


![Đề thi học sinh giỏi lớp 10 năm 2010-2011 kèm đáp án [có lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2013/20130614/mayin_123/135x160/4081371173819.jpg)




















![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



