
S GIÁO D C & ĐÀO T O ĐAKLAKỞ Ụ Ạ
TR NG THPT C MGARƯỜ Ư KỲ THI CH N H C SINH GI I C P TR NGỌ Ọ Ỏ Ấ ƯỜ
MÔN: HÓA H C – L P 10Ọ Ớ
NĂM H C: 2010 – 2011 Ọ
Th i gian: 180 phút (không k phát đ )ờ ể ề
Ngày thi: 23/01/2011
Câu 1.(3 đi m)ể
a. Hãy nêu s khác nhau c b n trong c u t o m ng tinh th nguyên t và m ng tinh th ion. Liên k t hoáự ơ ả ấ ạ ạ ể ử ạ ể ế
h c trong hai lo i m ng đó thu c lo i liên k t gì ? ọ ạ ạ ộ ạ ế
b. Gi i thích t i sao COả ạ 32 –, không th nh n thêm m t oxi đ t o COể ậ ộ ể ạ 42 – trong khi đó SO32 – có th nh n thêmể ậ
1 nguyên t oxi đ cho ra SOử ể 42 – ?
c. Gi i thích t i sao hai phân t NOả ạ ử 2 có th k t h p v i nhau t o ra phân t Nể ế ợ ớ ạ ử 2O4, trong khi đó hai phân tử
CO2 không th k t h p v i nhau đ t o ra phân t Cể ế ợ ớ ể ạ ử 2O4
Câu 2. (2 đi m)ể
B túc và cân b ng các ph n ng sau b ng ph ng pháp thăng b ng electromổ ằ ả ứ ằ ươ ằ
a. Cr2S3 + Mn(NO3)2 + K2CO3K2CrO4 + K2SO4 + K2MnO4 + NO + CO2
b. P + NH4ClO4 H3PO4 + N2 + Cl2 + …
c. FexOy + HNO3 … + NnOm + H2O
Câu 3(3 đi m). ể
H p ch t A có công th c MXợ ấ ứ 2, trong đó M chi m 46,67% v kh i l ng. Trong h t nhân c a M có n – p = 4;ế ề ố ượ ạ ủ
c a X có nủ’ = p’, trong đó n, n’, p, p’ là s n tron và s proton. T ng s proton trong MXố ơ ố ổ ố 2 là 58. Vi t kí hi u nguyênế ệ
t c a M, X và c u hình electron M ử ủ ấ 2+
Câu 4(3 đi m)ể
a. Nguyên t vàng có bán kính và kh i l ng mol l n l t là 1,44Aử ố ượ ầ ượ O và 197g/mol. Bi t r ng kh i l ngế ằ ố ượ
riêng c a vàng kim lo i là 19,36g/cmủ ạ 3. H i các nguyên t vàng chi m bao nhiêu % th tích trong tinh th ? (cho Nỏ ử ế ể ể
= 6,02.1023)
b. Vi t công th c c u t o các ch t sau: HClOế ứ ấ ạ ấ 4, H3PO3, NH4NO3, H2SO4
Câu 5 (3 đi m)ể
Cho vào n c d 3g oxit c a 1 kim lo i hoá tr 1, ta đ c dung d ch ki m, chia dung d ch làm hai ph n b ng nhau:ướ ư ủ ạ ị ượ ị ề ị ầ ằ
- Ph n 1: Cho tác d ng hoàn toàn v i 90 ml dung d ch HCl 1M, sau ph n ng dung d ch làm quỳ tím hoá xanh.ầ ụ ớ ị ả ứ ị
- Ph n 2: Cho tác d ng v i V(ml) dung d ch HCl 1M sau ph n ng dung d ch không làm đ i màu quỳ tímầ ụ ớ ị ả ứ ị ổ
a. Tìm công th c phân t oxitứ ử
b. Tính V
(Cho: Ba = 137; Li = 7; Na = 23; k = 39; Rb = 85; Cs = 133)
Câu 6(3 đi m)ể
3,28g h n h p 3 kim lo i A, B, C có t l s mol t ng ng là 4 : 3: 2 và có t l kh i l ng nguyên t t ngỗ ợ ạ ỉ ệ ố ươ ứ ỉ ệ ố ượ ử ươ
ng là 3 : 5 : 7. Hoà tan hoàn toàn h n h p 3 kim lo i trên trong dung d ch HCl d thì thu đ c 2,0161 lít khí (đktc)ứ ỗ ợ ạ ị ư ượ
và dung d ch Aị
a. Xác đ nh 3 kim lo i A, B, C, Bi t r ng khi chúng tác d ng v i axit đ u t o mu i kim lo i hoá tr 2ị ạ ế ằ ụ ớ ề ạ ố ạ ị
b. Cho dung d ch xút d vào dung d ch A, đun nóng trong không khí cho ph n ng x y ra hoàn toàn. Tínhị ư ị ả ứ ả
l ng k t t a thu đ c, bi t r ng ch có 50% mu i c a kim lo i B k t t a v i xútượ ế ủ ượ ế ằ ỉ ố ủ ạ ế ủ ớ
(cho: Ca = 40; Mg = 24; Fe = 56; Ni = 5; Sn = 118; Pb = 207; H = 1; O = 16)
Câu 7(3 đi m)ể
Hoà tan 46g m t h n h p g m Ba và 2 kim lo i ki m A, B thu c hai chu kì k ti p vào n c thì thu đ c dungộ ỗ ợ ồ ạ ề ộ ế ế ướ ượ
d ch (D) và 11,2 lít khí (đktc). N u cho thêm 0,18 mol Naị ế 2SO4 vào dung d ch (D) thì dung d ch sau ph n ng ch aị ị ả ứ ư
k t t a h t Ba. N u cho thêm 0,21 mol Naế ủ ế ế 2SO4 vào dung d ch (D) thì dung d ch sau ph n ng còn d Naị ị ả ứ ư 2SO4. Xác
đ nh tên 2 kim lo i ki mị ạ ề
(Cho: Ba = 137; Li = 7; Na = 23; k = 39; Rb = 85; Cs = 133)
(Thí sinh không đ c s d ng b ng h th ng tu n hoàn, giáo viên coi thi không gi i thích gì thêm)ượ ử ụ ả ệ ố ầ ả

S GIÁO D C & ĐÀO T O ĐAKLAKỞ Ụ Ạ
TR NG THPT C MGAR ĐÁP ÁN KỲ THI CH N H C SINH GI I C PƯỜ Ư Ọ Ọ Ỏ Ấ
TR NGƯỜ
MÔN: HÓA H C – L P 10Ọ Ớ
NĂM H C: 2010 – 2011 Ọ
Câu 1
(3 đ)
a.- Trong m ng tinh th nguyên t v trí các nút c a m ng là các nguyên t , chúngạ ể ử ở ị ủ ạ ử
liên k t v i nhau b ng liên k t c ng hoá trế ớ ằ ế ộ ị
- Tronh m ng tinh th ion v trí các nút c a m ng là các ion, chúng liên k t v iạ ể ở ị ủ ạ ế ớ
nhau b ng l c hút t nh đi nằ ự ỉ ệ
0,5
0,5
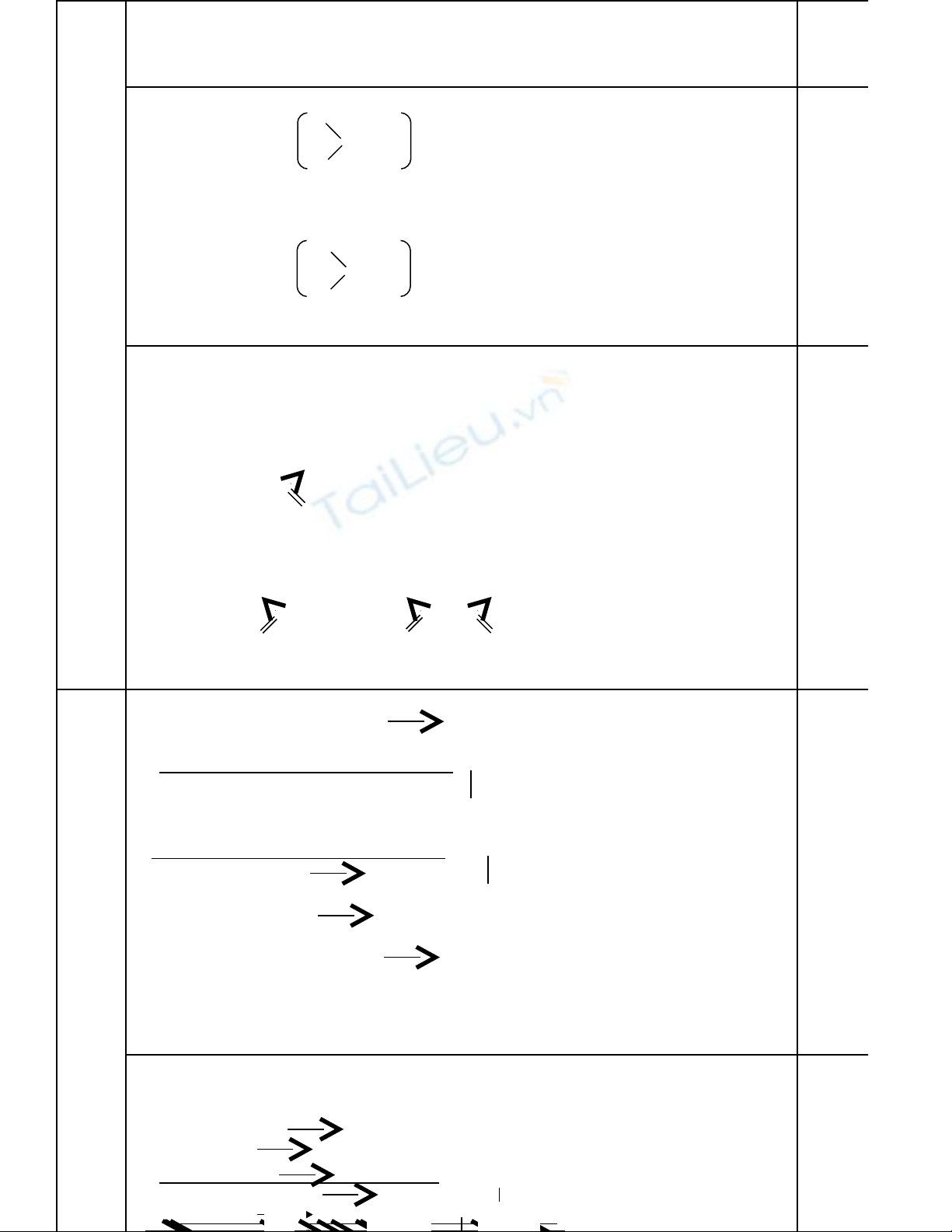
b. - C u t o c a COấ ạ ủ 32 –
O 2–
C = O
O
Trên nguyên t cacbon trong COử32 – không còn electron t do ch a liên k t nênự ư ế
không có kh năng liên k t thêm v i 1 nguyên t oxi đ t o ra COả ế ớ ử ể ạ 42 –
- C u t o c a SOấ ạ ủ 32 –
O . . 2–
S = O
O
Trên nguyên t l u huỳnh còn 1 c p electron t do ch a liên k t, do đó nguyên tử ư ặ ự ư ế ử
l u huỳnh có th t o liên k t cho nh n v i 1 nguyên t oxi th t đ t o ra SOư ể ạ ế ậ ớ ử ứ ư ể ạ 42 –
0,25
0,25
0,25
0,25
c. - C u t o c a COấ ạ ủ 2
O = C = O
Trên nguyên t cacbon không còn electron t do nên hai phân t COử ự ử 2 không thể
liên k t v i nhau đ t o ra Cế ớ ể ạ 2O4
- C u t o c a NOấ ạ ủ 2
O
∙ N
O
Trên nguyên t nit còn 1 electron đ c thân t do, nên nguyên t nit này cóử ơ ộ ự ử ơ
kh n ng t o ra liên k t c ng hoá tr v i nguyên t nit trong phân t th hai đ t oả ặ ạ ế ộ ị ớ ử ơ ử ứ ể ạ
ra phân t Nử2O4
O O O
2 N∙ N – N
O O O
0,25
0,25
0,25
0,25
Câu 2
(2 đ)
a Cr2S3 + Mn(NO3)2 + K2CO3 K2CrO4 + K2SO4 + K2MnO4 + NO + CO2
2Cr+3 2Cr+6 + 6e
3S–2 3S+6 + 24e
Cr2S3 2Cr+ 6 + 3S+ 6 + 30e x 1 (a)
Mn+ 2 Mn+ 6 + 4e
2N+ 5 + 6e 2N+ 2
Mn(NO3)2 + 2e Mn+ 6 + 2N+2 x 15 (b)
C ng (a) và (b)ộ
Cr2S3 + 15Mn(NO3)2 2Cr+ 6 + 3S+ 6 + 15Mn+ 6 + 30N+ 2
Hoàn thành:
Cr2S3 + 15Mn(NO3)2 + 20K2CO3 2K2CrO4 + 3K2SO4 +15 K2MnO4 + 30NO +
20CO2
0,25
0,25
0,5
b. P + NH4ClO4 H3PO4 + N2 + Cl2 + H2O
2N –3 2NO + 6e
2Cl+ 7 + 14e 2ClO
2NH4ClO3 + 8e 2NO + 2ClO x 5
PO P+ 5 + 5e x 8
10NH4NO3 + 8PO 8P+ 5 + 10NO + 10ClO + 16H2O 0,25
=
56
26 M16 X
Câu 4
(3đ)
a. Ta có: mng t Auử = 197/6,02.1023 = 327,24.10 – 24g
r = 1,44AO = 1,44.10 – 8cm
VAu = 4/3.п r3 = 4/3. 3,14.(1,44.10 – 8)3 = 12,5.10 – 24cm3
d = (327,24.10– 24)/(12,5.10 – 24) = 26,179g/cm3
G i x là % th tích Au chi m chọ ể ế ỗ
Ta có: x = (19,36.100)/26,179 = 73,95 %
0,5
0,5
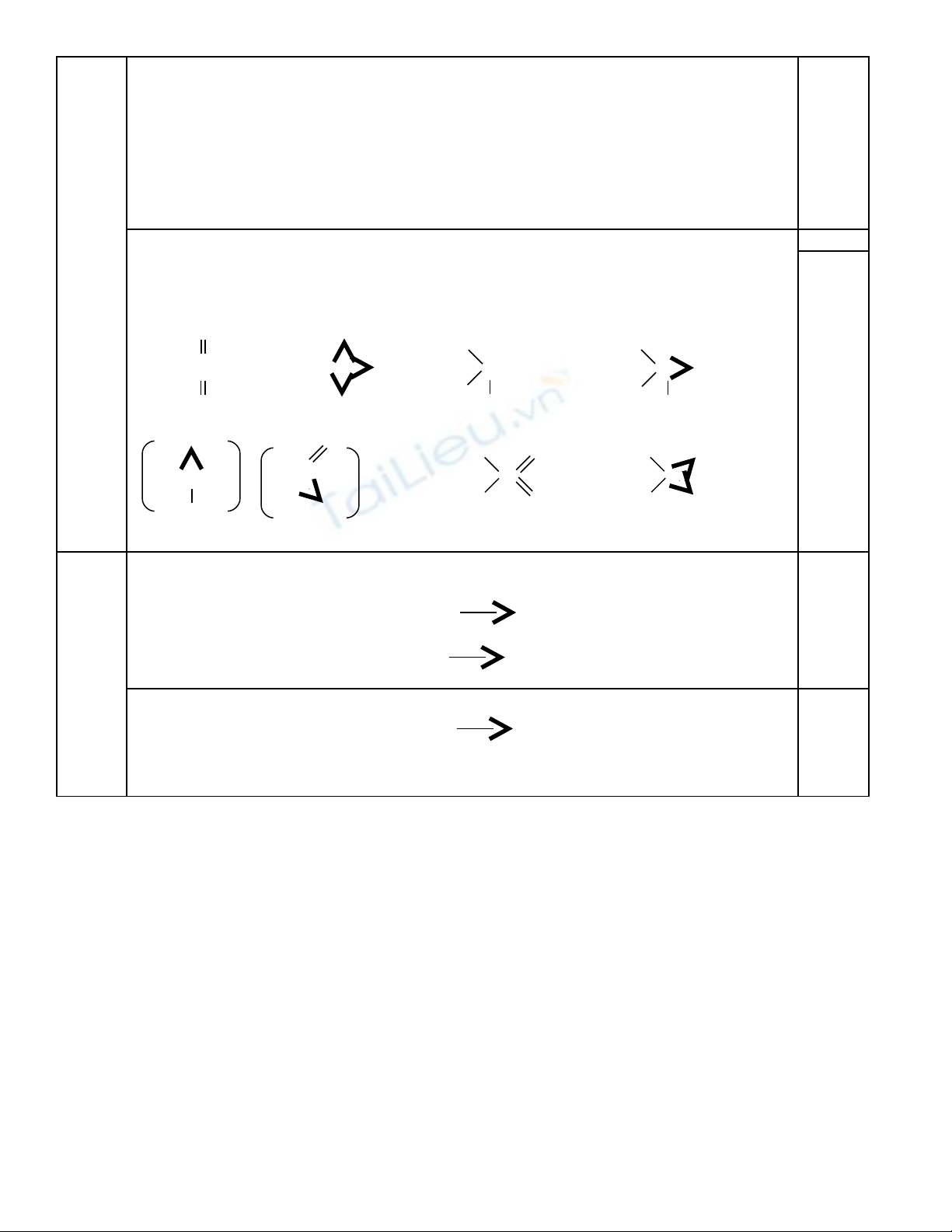
c. Công th c c u t o:ứ ấ ạ
O O
H – O H – O
H – Cl = O Hay: H – Cl O ; P = O Hay: P O
H – O H – O
O O H H
H O
+ – H – O O H – O O
H – N – H O – N ; S Hay: S
H – O O H – O O
H O
Vi t 1 công th c c u t o cho 0,25 đi mế ứ ấ ạ ể
Câu 5
(3đ)
a. G i công th c oxit kim lo i hóa tr I: Mọ ứ ạ ị 2O
nHCl = 1.0,09 = 0,09mol
Ph ng trình ph n ng: Mươ ả ứ 2O + 2HCl 2MCl + H2O (1)
1,5/(2M + 16) 3/(2M + 16)
(1) suy ra: 3/(2M + 16) > 0,09 M < 8,67
Suy ra: M là Li
0,5
1
0,5
b. nL2O(1/2 h n h p) = 1,5/30 = 0,05 molỗ ợ
Ph ng trình ph n ng: Liươ ả ứ 2O + 2HCl 2LiCl + H2O (2)
0,05 0,1
(2) suy ra: V = 0,1/1 = 0,1 lít = 100 ml
0,5
0,5
Câu 6
(3đ)
a. G i s mol 3 kim lo i A, B, C l n l t là: 4x, 3x, 2x và KLNT t ng ng là Mọ ố ạ ầ ượ ươ ứ A,
MB, MC
s mol Hố2 = 2,0262/22,4 = 0,09 mol
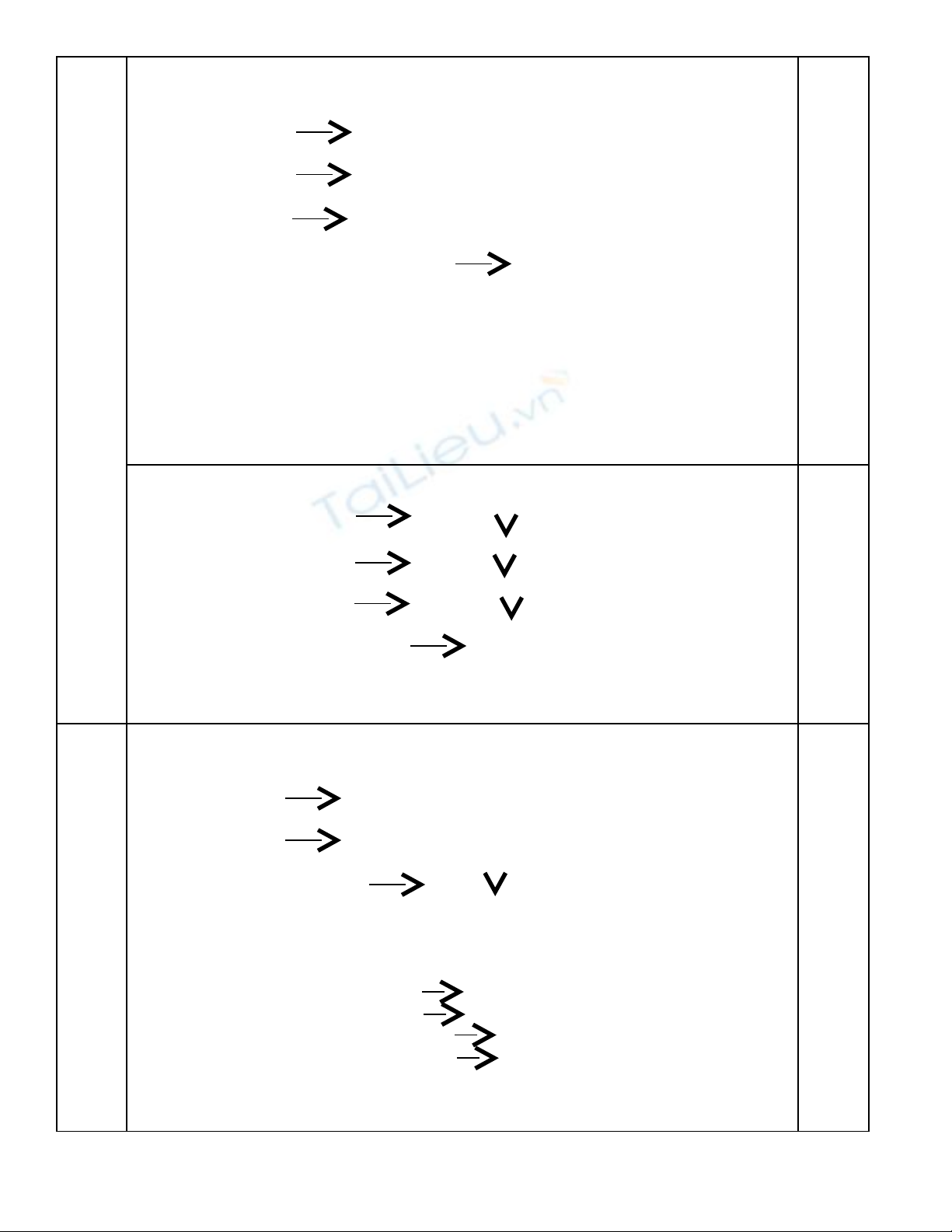
ptp : A + 2HCl AClư2 + H2 (1)
4x 4x 4x
B + 2HCl BCl2 + H2 (2)
3x 3x 3x
C + 2HCl CCl2 + H2 (3)
2x 2x 2x
T (1), (2), (3) ta có : 4x + 3x + 2x = 0,09 x = 0,01 (a)ừ
Ta có: MB = 5/3MA (b)
MC = 7/3MA (c)
M c khác ta có: MặA.4x + MB.3x + MC.2x = 3,28 (d)
T (a), (b), (c), (d) suy ra: MừA(0,04 + 5/3.0,03 + 7/3.0,02) = 3,28
Suy ra: MA = 24 A: Mg
MB = 5/3.24 = 40 B: Ca
MC = 7/3.24 = 56 C: Fe
0,125
0,125
0,125
0,125
0,25
0,25
0,25
0,25
0,25
0,25
b. Dung d ch (A): MgClị2, CaCl2, FeCl2
Ph ng trình ph n ng:ươ ả ứ
MgCl2 + 2NaOH Mg(OH)2 + 2NaCl (4)
4x 4x
CaCl2 + 2NaOH Ca(OH)2 + 2NaCl (5)
1,5x 1,5x
FeCl2 + 2NaOH Fe(OH)2 + 2NaCl (6)
2x 2x
4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3 (7)
2x 2x
T (4), (5), (6), (7) suy ra: 58.0,04 +74.0,015 + 107.0,02 = 5,57gừ
0,125
0,125
0,125
0,125
0,5
Câu 7
(3đ)
s mol Hố2 = 11,2/22,4 = 0,5 mol
G i công th c trung bình 2 kim lo i ki m: Mọ ứ ạ ề
Ph ng trình ph n ng là:ươ ả ứ
Ba + H2O Ba(OH)2 + H2 (1)
x x x
M + H2O MOH + 1/2H2 (2)
y y y/2
Ba(OH)2 + Na2SO4 BaSO4 + 2NaOH (3)
x x
T (1) và (2) suy ra: x + y/2 = 0,5 (a)ừ
Ta có: 137x + My = 46 (b)
T (3) suy ra: 0,18 < x < 0,21 (c)ừ
T (a) và (c) suy ra: x = 0,18 y = 0,64ừ
x = 0,21 y = 0,58
T (b) suy ra: x = 0,18, y = 0,54 M = 33,34ừ
x = 0,21, y = 0,58 M = 29,7
Na = 23 < 29,7 < M < 33,34 , K = 39
Hai kim lo i ki m là; Na và Kạ ề
0,25
0,25
0,25
0,25
0,25
0,25
0,25
0,25
0,25
0,25
0,25
0,25
Thí sinh gi i theo cách khác n u đúng v n cho đi m t i đaả ế ẫ ể ố

![Đề thi học sinh giỏi lớp 10 năm 2010-2011 kèm đáp án [có lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2013/20130614/mayin_123/135x160/4081371173819.jpg)




















![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



