
TR NG THPT NGÔ GIA TƯỜ Ự
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯
(Đ thi g m 01 trang)ề ồ
KỲ THI CH N Đ I TUY N H C SINH GI I VÒNG 1Ọ Ộ Ể Ọ Ỏ
L P Ớ10 - NĂM H CỌ 2011-2012
MÔN: HOÁ H CỌ
Th i gian làm bài:ờ 150 phút (không k th i gian giao đ )ể ờ ề
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯
Câu 1(1,0 đi m)ể
Cho BaO tác d ng v i dd Hụ ớ 2SO4 thu đ c k t t a A và dd B. Cho B tác d ng v i Al d thuượ ế ủ ụ ớ ư
đ c dd D và khí E. Thêm Kượ 2CO3 vào dd D th y t o k t t a F. Xác đ nh các ch t A, B, D, E, F vàấ ạ ế ủ ị ấ
vi t PTP x y ra.ế Ư ả
Câu 2(1,0 đi m)ể
Cân b ng các ph ng trình hoá h c sau:ằ ươ ọ
a) K2Cr2O7 + FeCl2 + HCl → CrCl3 + Cl2↑ + FeCl3 + KCl + H2O
b) FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO2↑ + H2O
Câu 3(1,0 đi m)ể
Cho các ch t sau đây: KHCOấ3; KHSO4; Ba(OH)2; SO2; (NH4)2SO4. Nh ng ch t nào có th ph nữ ấ ể ả
ng đ c v i nhau? Vi t các PTP và nêu đi u ki n ph n ng (n u có).ứ ượ ớ ế Ư ề ệ ả ứ ế
Câu 4(2,0 đi m)ể
M t h n h p A g m FeSộ ỗ ợ ồ 2; FeS; CuS đ c hoà tan v a đ trong m t dd có ch a 0,33 molượ ừ ủ ộ ứ
H2SO4 đ c nóng. Thu đ c 7,28 lít SOặ ượ 2 (đktc) và dung d ch B. Nhúng m t thanh s t n ng 50 gam vàoị ộ ắ ặ
dung d ch B, ph n ng xong nh c thanh s t ra đem cân th y kh i l ng thanh s t lúc này là 49,48ị ả ứ ấ ắ ấ ố ượ ắ
gam và còn l i dd C.ạ
a) Xác đ nhị kh i l ng các ch t có trong A (coi l ng đ ng đ c đ y ra bám h t lên thanh s t).ố ượ ấ ượ ồ ượ ẩ ế ắ
b) Vi t PTP x y ra (n u có) khi cho dd C l n l t tác d ng v i dd NaOH; dd Kế Ư ả ế ầ ượ ụ ớ 2S; khí Cl2.
Câu 5(1,0 đi m)ể
H p ch t ion G t o nên t các ion đ n nguyên t Mợ ấ ạ ừ ơ ử 2+ và X2-. T ng s h t (n tron, proton,ổ ố ạ ơ
electron) trong phân t G là 84, trong đó s h t mang đi n nhi u h n s h t không mang đi n là 28ử ố ạ ệ ề ơ ố ạ ệ
h t. S h t mang đi n c a ion Xạ ố ạ ệ ủ 2- ít h n s h t mang đi n c a ion Mơ ố ạ ệ ủ 2+ là 20 h t. Xác đ nh s kh i,ạ ị ố ố
s hi u nguyên t c a M, X và công th c phân t c a G.ố ệ ử ủ ứ ử ủ
Câu 6(1,0 đi m)ể
Nguyên t Au có bán kính và kh i l ng mol l n l t là 1,44Aử ố ượ ầ ượ O và 197g/mol. Bi t r ng kh iế ằ ố
l ng riêng c a vàng kim lo i là 19,36g/cmượ ủ ạ 3. H i các nguyên t vàng chi m bao nhiêu % th tíchỏ ử ế ể
trong tinh th ? (ểcho NA = 6,022.1023 và Vhình c uầ
3
4
3R
π
=
).
Câu 7(1,0 đi m)ể
Cho 2,13 gam h nỗ h pợ X gồm ba kim lo iạ Mg, Cu và Al ở d ngạ b tộ tác d ngụ hoàn toàn
v i oxiớ thu đưcợ h nỗ h pợ Y gồm các oxit có kh iố lưngợ 3,33 gam. Tính thể tích dung d chị HCl
2M vừa đủ đ ph n ể ả ứng h t v i Y?ế ớ
Câu 8(2,0 đi m)ể
H n h p A g m Fe, FeCOỗ ợ ồ 3 và Fe3O4. Hòa tan (đun nóng) m gam h n h p A b ng 896 ml dungỗ ợ ằ
d ch HNOị3 0,5M thì thu đ c dung d ch B và h n h p khí C g m COượ ị ỗ ợ ồ 2 và NO.
- L ng HNOượ 3 d trong dung d ch B tác d ng v a đ v i 1,4 gam CaCOư ị ụ ừ ủ ớ 3.
- Có m t bình kín dung tích 4,48 lít ch a không khí (4/5 th tích là Nộ ứ ể 2 và 1/5 th tích là Oể2) 0ởoC
và 0,375 atm. Sau khi nén t t c h n h p khí C vào bình và gi nhi t đ bình 0ấ ả ỗ ợ ữ ệ ộ ở oC thì th y ápấ
su t cu i cùng trong bình là 0,6 atm.ấ ố
M t khác đem nung nóng (không có m t oxi) m gam h n h p A r i cho tác d ng v i Hặ ặ ỗ ợ ồ ụ ớ 2 d ;ư
l ng n c t o ra lúc này cho h p th hoàn toàn vào 100 gam dung d ch Hượ ướ ạ ấ ụ ị 2SO4 97,565% thì dung d chị
axit b loãng thành n ng đ 95%.ị ồ ộ
Tính % kh i l ng m i ch t trong h n h p A.ố ượ ỗ ấ ỗ ợ
-----------H t-----------ế
Thí sinh đ c s d ng b ng tu n hoàn - Giám th coi thi không gi i thích gì thêmượ ử ụ ả ầ ị ả

H NG D N CH M THI CH N HSG HÓA 10ƯỚ Ẫ Ấ Ọ
L N 1 - NĂM H C 2011-2012Ầ Ọ
N i dungộĐi mể
Câu 1 Cho BaO tác d ng v i dd Hụ ớ 2SO4 thu đ c k t t a A và dd B. Cho B tác d ng v i Alượ ế ủ ụ ớ
d thu đ c dd D và khí E. Thêm Kư ượ 2CO3 vào dd D th y t o k t t a F. Xác đ nh cácấ ạ ế ủ ị
ch t A, B, D, E, F và vi t PTP x y ra.ấ ế Ư ả
TH1: d BaOư
BaO + H2SO4 → BaSO4↓ + H2O
BaO + H2O → Ba(OH)2
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2↑
K2CO3 + Ba(AlO2)2 → BaCO3↓ + 2KAlO2
A: BaSO4; B: Ba(OH)2; D: Ba(AlO2)2; E: H2; F: BaCO3
0,5
TH2: d Hư2SO4
BaO + H2SO4 → BaSO4↓ + H2O
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
Al2(SO4)3 + 3K2CO3 + 3H2O → 2Al(OH)3 + 3K2SO4 + 3CO2
A: BaSO4; B: H2SO4; D: Al2(SO4)3; E: H2; F: Al(OH)3
0,5
Câu 2 Cân b ng các ph ng trình hoá h c sau:ằ ươ ọ
a) K2Cr2O7 + FeCl2 + HCl → CrCl3 + Cl2↑ + FeCl3 + KCl + H2O
b) FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO2↑ + H2O
a) K2Cr2O7 + 2FeCl2 + 14HCl → 2CrCl3 + 2Cl2↑ + 2FeCl3 + 2KCl + 7H2O
b) FeS2 + 18HNO3 → Fe(NO3)3 + 2H2SO4 + 15NO2↑ + 7H2O
0,5
0,5
Câu 3 Cho các ch t sau đây: KHCOấ3; KHSO4; Ba(OH)2; SO2; (NH4)2SO4. Nh ng ch t nàoữ ấ
có th ph n ng đ c v i nhau? Vi t các PTP và nêu đi u ki n ph n ng (n uể ả ứ ượ ớ ế Ư ề ệ ả ứ ế
có).
KHCO3 + KHSO4 → K2SO4 + CO2↑ + H2O
KHCO3 + Ba(OH)2 → BaCO3↓ + KOH + H2O
2KHCO3 + Ba(OH)2 → BaCO3↓ + K2CO3 + 2H2O
2KHCO3 + (NH4)2SO4 → K2SO4 + 2CO2↑ + 2NH3↑ + 2H2O
2KHSO4 + Ba(OH)2 → BaSO4↓ + K2SO4 + 2H2O
Ba(OH)2 + SO2 → BaSO3↓ + H2O
Ba(OH)2 + 2SO2 → Ba(HSO3)2
Ba(OH)2 + (NH4)2SO4 → BaSO4↓ + 2NH3↑ + 2H2O
1
Câu 4 M t h n h p A g m FeSộ ỗ ợ ồ 2; FeS; CuS đ c hoà tan v a đ trong m t dd có ch a 0,33ượ ừ ủ ộ ứ
mol H2SO4 đ c nóng. Thu đ c 7,28 lít SOặ ượ 2 (đktc) và dung d ch B. Nhúng m t thanhị ộ
s t n ng 50 gam vào dung d ch B, ph n ng xong nh c thanh s t ra đem cân th yắ ặ ị ả ứ ấ ắ ấ
kh i l ng thanh s t lúc này là 49,48 gam và còn l i dd C.ố ượ ắ ạ
a) Xác đ nh kh i l ng các ch t có trong A (coi l ng đ ng đ c đ y ra bám h tị ố ượ ấ ượ ồ ượ ẩ ế
lên thanh s t).ắ
b) Vi t PTP x y ra (n u có) khi cho dd C l n l t tác d ng v i dd NaOH; dd Kế Ư ả ế ầ ượ ụ ớ 2S;
khí Cl2.
a) PTHH 2FeS2 + 14H2SO4 đ cặ
o
t
Fe2(SO4)3 + 15SO2↑ + 14H2O
2FeS + 10H2SO4 đ cặ
o
t
Fe2(SO4)3 + 9SO2↑ + 10H2O
CuS + 4H2SO4 đ cặ
o
t
CuSO4 + 4SO2↑ + 4H2O
Fe + CuSO4 → FeSO4 + Cu
Fe + Fe2(SO4)3 → 3FeSO4
- Đ t s mol FeSặ ố 2, FeS và CuS l n l t là x,y,z mol.ầ ượ
- Theo bài ra và theo các pthh ta có h : ệ
7 5 4 0,33
7, 28
7,5 4,5 4 0,325
22, 4
50 56(0,5 0,5 ) 64 49, 48
x y z
x y z
x y z z
+ + =
+ + = =
− + + + =
1,75
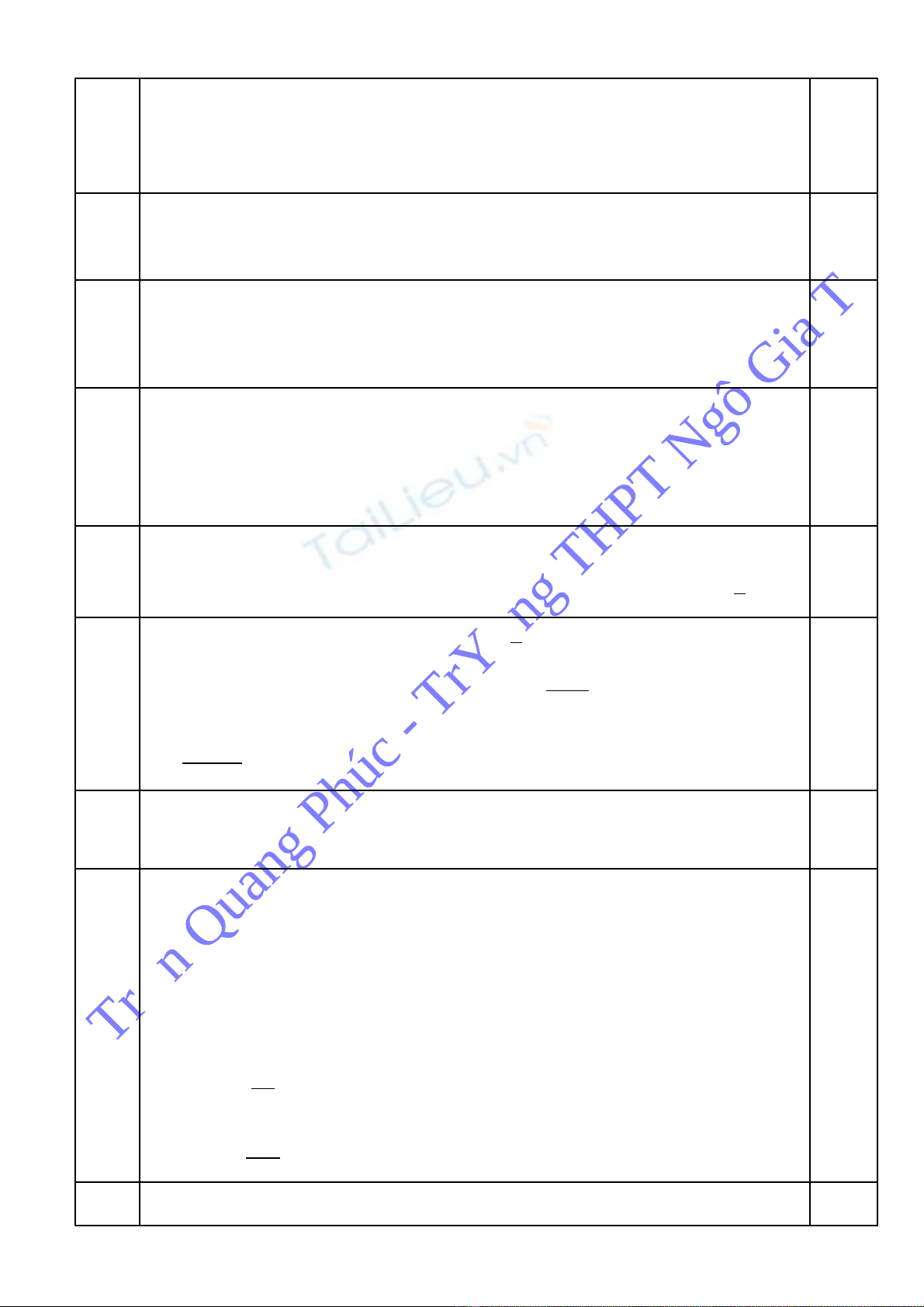
- Gi i h PT ta đ c x = 0,01; y = 0,02; z = 0,04ả ệ ượ
- Kh i l ng các ch t có trong A là ố ượ ấ
2
1, 2( )
1, 76( )
3,84( )
FeS
FeS
CuS
m g
m g
m g
=
=
=
b) Dung d ch C là FeSịO4
FeSO4 + 2NaOH → Fe(OH)2↓ + Na2SO4
FeSO4 + K2S → FeS↓ + K2SO4
6FeSO4 + 3Cl2 → 2Fe2(SO4)3 + 2FeCl3
0,25
Câu 5 H p ch t ion G t o nên t các ion đ n nguyên t Mợ ấ ạ ừ ơ ử 2+ và X2-. T ng s h t (n tron,ổ ố ạ ơ
proton, electron) trong phân t G là 84, trong đó s h t mang đi n nhi u h n s h tử ố ạ ệ ề ơ ố ạ
không mang đi n là 28 h t. S h t mang đi n c a ion Xệ ạ ố ạ ệ ủ 2- ít h n s h t mang đi nơ ố ạ ệ
c a ion Mủ2+ là 20 h t. Xác đ nh s kh i, s hi u nguyên t c a M, X và công th cạ ị ố ố ố ệ ử ủ ứ
phân t c a G.ử ủ
Theo đ bài ta có h pt sau: ề ệ
2 2 84
2 2 28
(2 2) (2 2) 20
X X M M
X X M M
X M
P N P N
P N P N
P P
+ + + =
− + − =
+ − − = −
Gi i ra ta đ c: Pả ượ M = 20; PX = 8. V y M là ậ
40
20
Ca
; X là
16
8
O
; G là CaO
1,0
Câu 6 Nguyên t Au có bán kính và kh i l ng mol l n l t là 1,44Aử ố ượ ầ ượ O và 197g/mol. Bi tế
r ng kh i l ng riêng c a vàng kim lo i là 19,36g/cmằ ố ượ ủ ạ 3. H i các nguyên t vàngỏ ử
chi m bao nhiêu % th tích trong tinh th ? (cho Nế ể ể A = 6,022.1023 và Vhình c uầ
3
4
3R
π
=
)
- Th tích c a 1 mol nguyên t Au là: Vể ủ ử 1 =
3 3
4
. 7,5321( )
3
A
N R cm
π
=
- Th tích c a 1 mol tinh th nguyên t Au là: Vể ủ ể ử 2 =
3
197 10,1756( )
19,36 cm=
V y đ đ c khít c a Au là:ậ ộ ặ ủ
7,5321 .100% 74%
10,1756
ρ
= =
1,0
Câu 7 Cho 2,13 gam h nỗ h pợ X gồm ba kim lo iạ Mg, Cu và Al ở d ngạ b tộ tác d ngụ hoàn
toàn v i oxiớ thu đưcợ h nỗ h pợ Y gồm các oxit có kh iố lưngợ 3,33 gam. Tính thể tích
dung d chị HCl 2M vừa đủ đ ph n ể ả ứng h t v i Y?ế ớ
Ta có s đ ph n ng sau:ơ ồ ả ứ
2
2
2 2
2 3 3
OHCl
MgCl
Mg MgO
Cu CuO CuCl H O
Al Al O AlCl
++
� �
� � �
+
� � �
� � �
� �
B o toàn nguyên t cho H: ả ố
2
2
HCl H O
n n=
(1)
B o toàn nguyên t cho O: ả ố
2
/oxO it H O
n n=
(2)
Theo ĐLBTKL:
/ox
3,33 2,13 1, 2( )
O it
m g= − =
V y: nậO/oxit =
1, 2 0,075( )
16 mol=
Theo (1), (2) ta có: nHCl = 2.0,075 = 0,15(mol)
V y: VậHCl =
0,15 0,075( ) 75( )
2l ml= =
1,0
Câu 8 H n h p A g m Fe, FeCOỗ ợ ồ 3 và Fe3O4. Hòa tan (đun nóng) m gam h n h p A b ngỗ ợ ằ
896 ml dung d ch HNOị3 0,5M thì thu đ c dung d ch B và h n h p khí C g m COượ ị ỗ ợ ồ 2 và
NO.
-L ng HNOượ 3 d trong dung d ch B tác d ng v a đ v i 1,4 gam CaCOư ị ụ ừ ủ ớ 3.
-Có m t bình kín dung tích 4,48 lít ch a không khí (4/5 th tích là Nộ ứ ể 2 và 1/5 thể
tích là O2) 0ởoC và 0,375 atm. Sau khi nén t t c h n h p khí C vào bình vàấ ả ỗ ợ
gi nhi t đ bình 0ữ ệ ộ ở oC thì th y áp su t cu i cùng trong bình là 0,6 atm.ấ ấ ố
M t khác đem nung nóng (không có m t oxi) m gam h n h p A r i cho tácặ ặ ỗ ợ ồ
d ng v i Hụ ớ 2 d ; l ng n c t o ra lúc này cho h p th hoàn toàn vào 100 gamư ượ ướ ạ ấ ụ
dung d ch Hị2SO4 97,565% thì dung d ch axit b loãng thành n ng đ 95%.ị ị ồ ộ
Tính % kh i l ng m i ch t trong h n h p A.ố ượ ỗ ấ ỗ ợ
Các ph n ng:ả ứ
Fe + 4HNO3
Fe(NO3)3 + NO↑ + 2H2O (1)
3Fe3O4 + 28HNO3
9Fe(NO3)3 + NO↑ + 14H2O (2)
3FeCO3 + 10HNO3
3Fe(NO3)3 + NO↑ + 3CO2↑ + 5H2O (3)
CaCO3 + 2HNO3
Ca(NO3)2 + CO2↑ + H2O (4)
2NO + O2
2NO2 (5)
Fe3O4 + 4H2
3Fe + 4H2O (6)
FeCO3
o
t
FeO + CO2↑ (7)
FeO + H2
Fe + H2O (8)
S mol không khí trong bình lúc đ u là n:ố ầ
0,075( )
PV
n mol
RT
= =
Trong đó,
2 2
0,075 0,015( ); 0,06( )
5
O N
n mol n mol= = =
Vì nhi t đ bình tr c và sau ph n ng là không đ i nên áp su t trong bình tr c vàệ ộ ướ ả ứ ổ ấ ướ
sau ph n ng t l v i s mol khí. G i s mol khí sau ph n ng (5) là n’. Ta có:ả ứ ỉ ệ ớ ố ọ ố ả ứ
0,075 0.375 ' 0,12( )
' 0.6 n mol
n= =�
S mol khí trong bình sau ph n ng (5) g m:ố ả ứ ồ
2 2 2
0, 06( ); 2. 2.0, 015 0,03( )
N NO O
n mol n n mol= = = =
và t ng s mol ổ ố
2
0,12 0,06 0,03 0,03( )CO NO mol+ = − − =
=> T ng s mol CO2 + NO ph n ng (1,2,3) = 0,03 + 0,03 = 0,06ổ ố ở ả ứ (mol)
S mol HNOố3 tham gia ph n ng (1,2,3) = ả ứ
14
0,896.0,5 2. 0, 42( )
100 mol− =
G i x, y, z là s mol Fe, Feọ ố 3O4 và FeCO3 trong m (g) h n h p A, ta có h pt:ỗ ợ ệ
- S mol HNOố3 ph n ng (1,2,3) : ả ứ ở
28 10
4 0, 42
3 3
x y z+ + =
(I)
- S mol COố2 + NO (1,2,3) : ở
( ) 0,06
3 3
y z
z x+ + + =
(II)
G i p là l ng n c t o ra trong ph n ng (6,8) ta có:ọ ượ ướ ạ ả ứ
2
97,565.100 2,7
95 2,7( ) 0,15( )
100 18
H O
p g n mol
p
= = = =� �
+
- S mol Hố2O:
4 0,15y z+ =
(III)
Gi i h (I, II, III) ta đ c: x = 0,01; y = 0,03; z = 0,03ả ệ ượ
Kh i l ng h n h p A: m = 0,01.56 + 0,03.232 + 0,03.116 = 11(g)ố ượ ỗ ợ
V y: %Fe = 5,09%; %Feậ3O4 = 63,27%; %FeCO3 = 31,64%.
2,0

![Đề thi học sinh giỏi lớp 10 năm 2010-2011 kèm đáp án [có lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2013/20130614/mayin_123/135x160/4081371173819.jpg)




















![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



